浮游植物、浮游动物、鱼类虫卵、土壤微生物、果蝇、斑马鱼等中呼吸与能量代谢检测方案(动物代谢检测)
检测样品 生物环保
检测项目 呼吸与能量代谢

 金牌会员
452 篇解决方案
金牌会员
452 篇解决方案
方案详情文
智能文字提取功能测试中
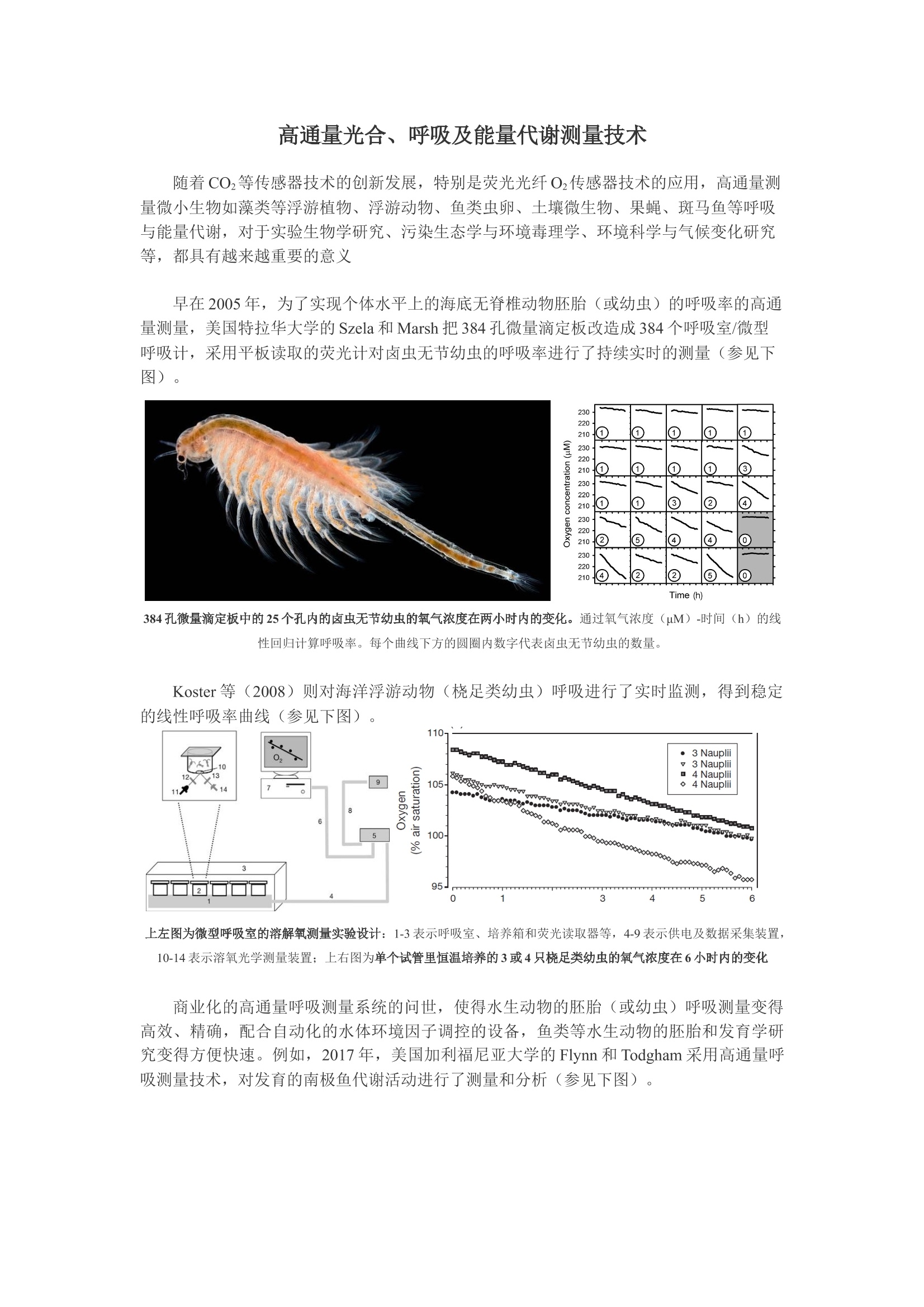
高通量光合、呼吸及能量代谢测量技术 随着CO2等传感器技术的创新发展,特别是荧光光纤O2传感器技术的应用,高通量测量微小生物如藻类等浮游植物、浮游动物、鱼类虫卵、土壤微生物、果蝇、斑马鱼等呼吸与能量代谢,对于实验生物学研究、污染生态学与环境毒理学、环境科学与气候变化研究等,都具有越来越重要的意义 早在2005年,为了实现个体水平上的海底无脊椎动物胚胎(或幼虫)的呼吸率的高通量测量,美国特拉华大学的Szela和Marsh把384孔微量滴定板改造成384个呼吸室/微型呼吸计,采用平板读取的荧光计对卤虫无节幼虫的呼吸率进行了持续实时的测量(参见下图)。 384孔微量滴定板中的25个孔内的卤虫无节幼虫的氧气浓度在两小时内的变化。通过氧气浓度(μM)-时间(h)的线性回归计算呼吸率。每个曲线下方的圆圈内数字代表卤虫无节幼虫的数量。 Koster等(2008)则对海洋浮游动物(桡足类幼虫)呼吸进行了实时监测,得到稳定的线性呼吸率曲线(参见下图)。 上左图为微型呼吸室的溶解氧测量实验设计:1-3表示呼吸室、培养箱和荧光读取器等,4-9表示供电及数据采集装置,10-14表示溶氧光学测量装置;上右图为单个试管里恒温培养的3或4只桡足类幼虫的氧气浓度在6小时内的变化 商业化的高通量呼吸测量系统的问世,使得水生动物的胚胎(或幼虫)呼吸测量变得高效、精确,配合自动化的水体环境因子调控的设备,鱼类等水生动物的胚胎和发育学研究变得方便快速。例如,2017年,美国加利福尼亚大学的Flynn和Todgham采用高通量呼吸测量技术,对发育的南极鱼代谢活动进行了测量和分析(参见下图)。 左图成年深海龙鱼保护着一次产的胚胎;右图深海龙鱼胚胎处于开放的呼吸室;呼吸测量(氧气饱和度VS时间) 美国海洋和大气管理和研究局的(NOAA)Xaymara Serrano等(2018)使用200微升的高通量呼吸系统测量了两个物种的加勒比礁珊瑚幼虫的耗氧率(参见下图)。研究团队的成员来自位于迈阿密的大西洋海洋和气象实验室以及迈阿密大学海洋与大气学院,他们研究了多种因子(如温度、硝酸盐富集)对幼虫的活动的影响,研究结果刊登在《Coral Reefs》杂志上,并在论文里详细介绍了他们是如何使用该技术测量如此微小的生物的耗氧率。 礁珊瑚幼虫耗氧率测量 不列颠哥伦比亚大学的Bernhardt等(2017),则利用200微升的高通量溶解氧测量技术,对浮游植物细胞光照条件下的放氧量及黑暗条件下的氧气消耗量进行了测量分析,并计算其质量归一化代谢率(氧通量/总细胞体积)和光合作用的活化能。实验中使用了透明的PCR膜密封呼吸室,在3小时内每隔15秒测量一次氧气浓度(参见下图)。 图8 Tetraselmis tetrahele质量归一化代谢率随温度的变化。 英国约克大学的Prendergast-Miller等(2017),借助高通量呼吸测量技术对土壤微生物耗氧率进行测量进而对土壤质量进行快速评估。该研究小组使用600微升的高通量呼吸测量系统,通过实时测量不同土壤类型、蚯蚓处理及C源供给的土壤悬浮液的子样品的2小时内的氧气消耗,发现蚯蚓能够改变土壤微生物结构,进而影响土壤微生物的耗氧率。 土壤微生物耗氧率测量概念示意图 北京易科泰生态技术公司近20年来致力于生物呼吸与能量代谢技术的推广和技术服务,为您提供全面高通量生物呼吸与能量代谢测量方案: 高通量藻类光合-呼吸测量技术方案 高通量浮游动物呼吸测量技术方案 高通量斑马鱼鱼卵与鱼苗发育期呼吸测量技术方案 高通量果蝇呼吸与能量代谢测量技术方案(CO2与O2测量) 高通量土壤呼吸/土壤微生物呼吸测量技术方案 参考文献: Szela T L, Marsh A G. Microtiter plate, optode respirometry, and inter-individual variance in metabolic rates among nauplii of Artemia sp[J]. Marine Ecology Progress, 2005, 296:281-289. Köster M, Krause C, Paffenhöfer G. Time-series measurements of oxygen consumption of copepod nauplii[J]. Marine Ecology Progress, 2008, 353(01):157-164. Flynn E E, Todgham A E. Thermal windows and metabolic performance curves in a developing Antarctic fish.[J]. Journal of Comparative Physiology B, 2017, 188(2):1-12. Serrano X M, Miller M W, Hendee J C, et al. Effects of thermal stress and nitrate enrichment on the larval performance of two Caribbean reef corals[J]. Coral Reefs, 2018, 37(1):173-182. Bernhardt J, Sunday J M, O'Connor M I. An empirical test of the temperature dependence of carrying capacity[J]. bioRxiv, 2017: 210690. Prendergastmiller M T, Thurston J, Taylor J, et al. Rapid determination of soil quality and earthworm impacts on soil microbial communities using fluorescence-based respirometry[C]// EGU General Assembly Conference. EGU General Assembly Conference Abstracts, 2017. Mclamore E S, Garland J L, Mackowiak C, et al. Development and validation of an open source O2-sensitive gel for physiological profiling of soil microbial communities[J]. J Microbiol Methods, 2014, 96(1):62-67. 随着CO2等传感器技术的创新发展,特别是荧光光纤O2传感器技术的应用,高通量测量微小生物如藻类等浮游植物、浮游动物、鱼类虫卵、土壤微生物、果蝇、斑马鱼等呼吸与能量代谢,对于实验生物学研究、污染生态学与环境毒理学、环境科学与气候变化研究等,都具有越来越重要的意义。北京易科泰生态技术公司近20年来致力于生物呼吸与能量代谢技术的推广和技术服务,为您提供全面高通量生物呼吸与能量代谢测量方案:1) 高通量藻类光合-呼吸测量技术方案2) 高通量浮游动物呼吸测量技术方案3) 高通量斑马鱼鱼卵与鱼苗发育期呼吸测量技术方案4) 高通量果蝇呼吸与能量代谢测量技术方案(CO2与O2测量)5) 高通量土壤呼吸/土壤微生物呼吸测量技术方案
关闭-
1/4
-
2/4

还剩2页未读,是否继续阅读?
继续免费阅读全文产品配置单
北京易科泰生态技术有限公司为您提供《浮游植物、浮游动物、鱼类虫卵、土壤微生物、果蝇、斑马鱼等中呼吸与能量代谢检测方案(动物代谢检测)》,该方案主要用于生物环保中呼吸与能量代谢检测,参考标准《暂无》,《浮游植物、浮游动物、鱼类虫卵、土壤微生物、果蝇、斑马鱼等中呼吸与能量代谢检测方案(动物代谢检测)》用到的仪器有Loligo斑马鱼呼吸代谢测量系统、便携式土壤呼吸测量系统、水生生物呼吸测量系统。
我要纠错
推荐专场
动物呼吸机
更多相关方案









 咨询
咨询





