

标准方法 | 修改方法 | |||
5RT缓冲液 | 5.0 | 2Χ RT-qPCR预混液 | 10 | |
MgCl2(25mmol/L) | 3.0 | 酶混合液 | 1 | |
dNTP(10mmol/L) | 1.0 | ROX | 0.4 | |
H7正向引物(20μmol/L) | 0.5 | H7正向引物(10μmol/L) | 0.8 | |
H7反向引物(20μmol/L) | 0.5 | H7反向引物(10μmol/L) | 0.8 | |
H7探针(10μmol/L) | 0.375 | H7探针(5μmol/L) | 0.6 | |
N9正向引物(20μmol/L) | 0.625 | N9正向引物(10μmol/L) | 1.0 | |
N9反向引物(20μmol/L) | 0.625 | N9反向引物(10μmol/L) | 1.0 | |
N9探针(10μmol/L) | 0.5 | N9探针(5μmol/L) | 0.8 | |
M-MLV反转录酶(200U/μL) | 0.5 | 总RNA | 2 | |
RNA酶抑制剂(40U/μL) | 0.25 | 无核酸酶水 | 1.6 | |
Ex Taq HS酶(5U/μL) | 0.25 | 总体积 | 20 | |
无核酸酶水 | 1.875 | |||
总RNA | 10 | |||
总体积 | 25 |
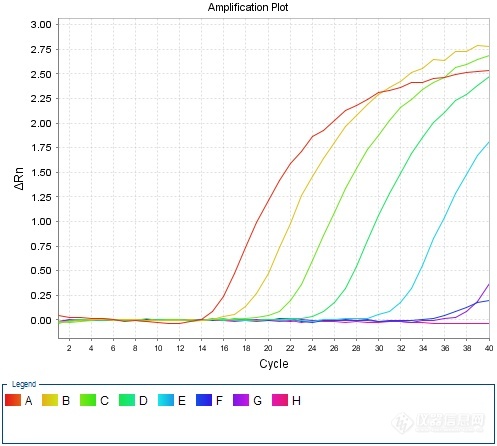
稀释倍数 | 1:10^1 | 1:10^2 | 1:10^3 | 1:10^4 |
H7基因-H7N9 | 15.43 | 18.11 | 22.66 | 27.94 |
N9基因-H7N9 | 18.76 | 22.19 | 26.32 | 31.63 |
H7基因-H7N9Re-2 | 15.52 | 18.50 | 21.29 | 31.69 |
N9基因-H7N9Re-2 | 20.28 | 23.68 | 27.24 | 35.01 |