纳米圆盘简介
1 纳米圆盘与生物膜
去垢剂在膜蛋白质研究中具有重要的作用,但是基于去垢剂的膜蛋白质提取方法存在一定缺陷。一方面,去垢剂种类诸多,筛选出最适合目标膜蛋白质增溶、稳定和结构表征的去垢剂费时费力;此外,去垢剂胶束固有的动态性质会导致去垢剂-膜蛋白质复合物不稳定,从而导致随着时间的推移膜蛋白质有聚集/变性的趋势。另一方面,膜蛋白质的结构和功能与其所处的膜环境即脂质分子是息息相关的。传统上用于提取膜蛋白质的去垢剂是通过破坏脂质双分子层,将膜蛋白周围的脂质剥离,以胶束的形式将膜蛋白质包裹于疏水核心,去垢剂分子的极性头部则暴露于水相环境,以此为膜蛋白质提供了另一种溶解环境,这极大地影响了膜蛋白质的结构和活性。
显然,去垢剂分子形成的胶束远不能模拟膜蛋白质所存在的脂质双分子层环境,因而并不是膜蛋白提取、增溶、稳定的最佳工具。近年来,膜蛋白质研究的发展方向之一是开发能够提供更好的细胞膜膜模拟效果的纯化方法,新型细胞膜膜模拟系统主要有liposomes、bicelles、amphipols和nanodiscs,其中nanodiscs即纳米圆盘为细胞膜研究提供了新的工具,并被公认为是一种最佳的膜模拟系统。纳米圆盘技术最早由Sligar等人提出,纳米圆盘的组成为两亲性膜支架蛋白(MSP)围绕圆盘状的磷脂双分子层,可稳定地分散于水相。将去垢剂增溶的膜蛋白质、磷脂分子、MSP混合,就可以将膜蛋白质自组装至MSP纳米圆盘中。MSP结合的纳米圆盘潜在优势包括纳米圆盘尺寸可调、可对MSP进行基因工程修饰、纳米圆盘中的脂质成分可控、纳米圆盘中的膜蛋白质可以确定的低聚状态存在等。但是,MSP纳米圆盘形成过程中仍需要去垢剂进行初始增溶步骤,如图1-7所示,不能避免去垢剂分子对膜蛋白质的稳定性和活性的影响。此外,MSP纳米圆盘中脂质的组成与天然脂质双分子层的组成不同,这可能会影响蛋白质的结构、活性及其调控。基于SMA的纳米圆盘克服了MSP纳米圆盘的局限性,没有去垢剂的情况下,SMA能够溶解脂质膜形成盘状纳米颗粒(图1-8),近年来在细胞膜研究领域受到越来越多的关注。
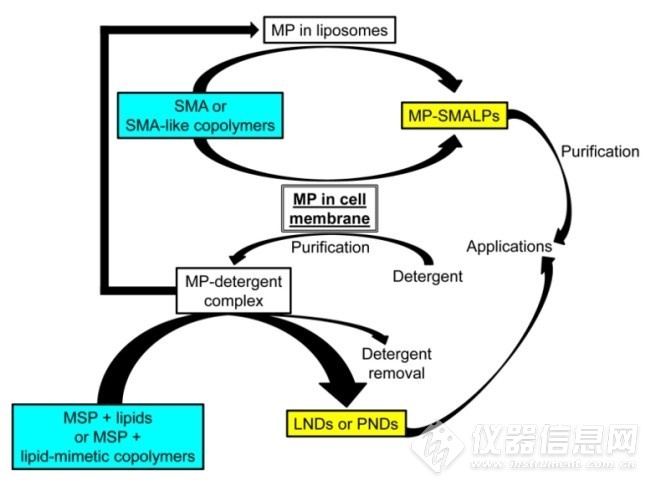
图1-7 MSP纳米圆盘和SMA纳米圆盘的形成过程
Fig. 1-7 The formation processes of MSP nanodiscs and SMA nanodiscs
1.2.2 SMA结合的纳米圆盘
早在2001年,Tonge等人就证明了既含有疏水单元苯乙烯又含有亲水单元马来酸的SMA可以增溶脂质分子,并在2006年利用SMA将脂质双分子层转化成稳定的纳米圆盘形状的双层膜,获得专利。2009年,SMA首次被报道用于提取跨膜蛋白质,在脂质双分子层中加入SMA后,SMA与细胞膜结合,将其溶解为天然的纳米圆盘,又称为苯乙烯-马来酸脂质颗粒(SMALPs),SMA包围在圆盘侧面,膜蛋白质则被包裹于圆盘之中,如图1-8所示。与去垢剂和MSP纳米圆盘相比,SMALPs的优势在于不需要去垢剂就可以直接从细胞膜上提取膜蛋白质,同时保留膜蛋白质周围的天然脂质环境。自2009年开始,关于利用SMALPs技术提取纯化膜蛋白质的文献数目迅速增加,(图1-9)。这些文献研究了多种重要的膜蛋白质,如G蛋白偶联受体、离子通道、ABC转运蛋白等,处于SMALPs中的膜蛋白质具有良好的稳定性和活性且显著优于去垢剂胶束中的膜蛋白质。此外,这些文献表明SMA对于单跨膜螺旋蛋白、多跨膜螺旋蛋白,甚至大型多亚基跨膜蛋白都具有良好的提取效果。
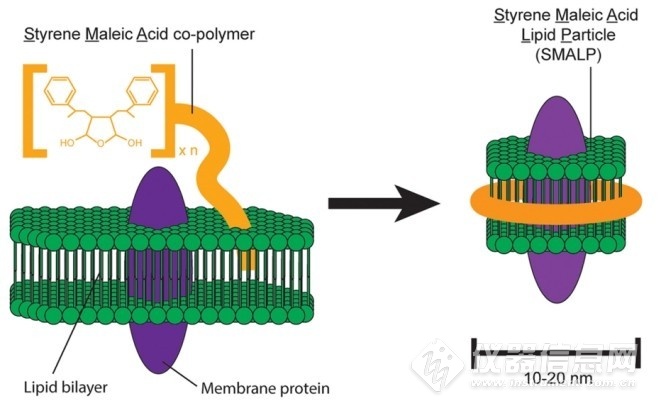
图1-8 SMALPs示意图[59]
Fig. 1-8 Schematic diagram of SMALPs[59]

图1-9 利用SMALPs技术纯化膜蛋白质的文献数目
Fig. 1-9 Numbers of literatures describing membrane proteins purified by SMALPs technology
SMA可同时实现膜蛋白质和膜脂的提取,很多研究也对SMALPs中的脂质分子进行了定性定量分析。Teo等采用SMA对大肠杆菌的ZipA、FtsA和PgpB三种膜蛋白质进行提取纯化,并采用反相HPLC-MS/MS分别对三种膜蛋白质的SMALPs中的磷脂进行分离分析。结果表明,SMA本身不会优先从细胞膜中提取特定的磷脂。在ZipA和PgpB的SMALPs中,磷脂分子种类类似且单不饱和PE和PG含量较高;在FtsA的SMALPs中,磷脂分子种类与ZipA和PgpB差异较大,具有更长碳链的PE和PG含量更高。Ayub等人采用SMA对酵母细胞膜上的CD81蛋白进行增溶和纯化,并采用“鸟枪法”对酵母细胞膜总脂质提取物、空SMALPs(不含CD81)中脂质和含CD81的SMALPs中脂质进行测定。结果表明,前两者所含磷脂分子种类差异不大,含CD81的SMALPs中磷脂分子种类变化明显,表现为带正电荷的PE和PC减少,带负电荷的PI相对增多。
1.2.3 SMA与磷脂双分子层
近年来,关于SMALPs自组装机制的研究也得到开展。简单来说,在疏水效应驱动下,SMA吸附到磷脂双分子层,苯乙烯基团插入到磷脂双分子层中,与酰基链紧密结合,在临界浓度下,带电的马来酸基团使膜失稳,导致膜破裂并形成被SMA聚合物带环绕的纳米圆盘。对于SMA与其它两亲性聚合物的区别,Scheidelaar等从苯环和羧基的性质进行了详细阐述:刚性苯环基团的存在,使SMA从溶液游离状态转化成围绕纳米圆盘的另一种状态,熵变小,这是有利的;羧基的偶极矩与膜的偶极势之间有良好的相互作用。SMA的这些特性使其对磷脂双分子层具有高增溶性能,可以增溶各种不同头部基团、不同酰基链、不同构型的脂质分子。特别是苯乙烯与马来酸摩尔比在2:1到3:1之间的SMA,其疏水性和极性达到最佳平衡,对磷脂双分子层增溶效果最佳[71]。
1.3 SMA及其衍生物
1.3.1 SMA的性质与制备
SMA是苯乙烯-马来酸酐共聚物(SMAnh)的水解形式,SMAnh是被广泛研究的聚合物之一,由Alfey和Lavin在1945年首次制备。由于苯乙烯和马来酸酐存在极性差异,且苯环为给电子体,马来酸酐为吸电子体,在一定反应条件下两者竞聚率相近,聚合后可形成具有独特交替结构的聚合物链,经水解后,赋予SMA两亲性聚合物的性质。SMA不仅化学性质独特,还具有良好的生物相容性,可用作很多药物的载体,如坦螺旋霉素、两性霉素B等。
用于膜蛋白质和膜脂研究时,SMAnh的制备方式通常有两种,即利用传统自由基聚合或可控/“活性”自由基聚合。传统自由基聚合因其慢引发、快增长、易终止的特点而导致聚合反应过程、聚合度、聚合物的结构和分子量分布难以控制。可控/“活性”自由基聚合技术的出现使得对聚合物进行分子设计和可控聚合成为可能,特别是可逆加成-断裂链转移(RAFT)聚合已发展成为合成复杂聚合物结构的最通用和最强大的聚合技术之一。RAFT聚合中的关键试剂-链转移试剂(CTA),在聚合过程中可以形成无聚合活性的休眠种,与活性自由基链相比,对体系中其它自由基的竞争力相当,使得整个反应体系始终存在自由基的可逆链转移,很大程度上抑制了双基终止,并实现了对聚合过程的调控。
Craig等采用RAFT聚合法制备了三组具有低、中、高分子量的SMAnh,每组分别设置了不同的苯乙烯、马来酸酐摩尔比(2:1-4:1),经体积排阻色谱法分析,证明了所得聚合物的分散度指数(PDI)在1.25-1.35之间,且所有聚合物的实际分子量与理论值相近,说明聚合过程得到了很好的控制。将SMAnh进行水解,用于磷脂分子增溶,结果发现形成SMALPs的大小与SMA分子量无关,而与两个单体的比例有关。苯乙烯、马来酸酐摩尔比为2:1、3:1、4:1时,形成的纳米圆盘尺寸分别约为28 nm、10 nm、32 nm。因此,利用RAFT聚合方法可以控制SMA结构,通过扩大纳米圆盘的尺寸可为提取更多的膜脂和体积更大的膜蛋白质提供可能性。
Smith等在蒙特卡罗模拟的基础上,通过RAFT聚合法合成了六组16种具有不同苯乙烯/马来酸酐比例和不同单体/CTA比例的聚合物,经凝胶渗透色谱、核磁共振等技术表征,证实了RAFT聚合可以控制聚合物链中单体的含量、组成、分布情况。作者进一步比较了上述聚合物在磷脂增溶和SMALPs形成方面的性能差异,筛选出了聚合物D,与商业SMA2000相比,得到的纳米圆盘分散性更小,而较低的样品分散性可能有利于结构生物学研究。
1.3.2 SMA衍生物的性质与制备
SMALPs已逐渐发展成为细胞膜组成研究的可靠工具,但其应用价值受到pH值和二价金属离子的限制。在酸性条件下,SMA中的羧基易发生质子化使共聚物疏水性增强而极易从溶液中沉淀析出,这不利于提取在酸性环境中发挥最佳功能的膜蛋白质;此外,在毫摩尔浓度的镁或钙离子存在下,SMA中的羧基可与金属离子螯合而产生沉淀,使SMA无法用于钙/镁离子依赖性膜蛋白质的研究[82-83]。为了拓宽SMALPs技术的适用范围,利用SMAnh中酸酐基团的高反应活性和衍生能力,可进一步通过酯化、酰胺化等反应进行后修饰制备SMA衍生物,如图1-10所示。后修饰基团的引入可改变SMA的特性,增强了聚合物的pH值和金属离子耐受范围,如SMI在pH值为2.5-10范围内,二价金属离子浓度高达200 mM时,仍可发挥膜蛋白质及膜脂提取功能,形成的纳米圆盘显示出超强稳定性。上述SMA衍生物为后续更广泛的膜蛋白质和膜脂研究提供了更多的选择。

图1-10 SMA衍生物
Fig. 1-10 SMA derivatives
1.4 SMALPs的扩展
二异丁烯-马来酸共聚物(DIBMA)在增溶磷脂,稳定膜蛋白质的性能上与SMA相当。同SMALPs一样,DIBMA以DIBMA脂质颗粒(DIBMALPs)的形式同时提取膜脂和膜蛋白质。SMA中苯基的存在使得提取的膜蛋白质不能直接进行紫外或圆二色谱等光谱学表征,而DIBMA可弥补这一缺陷。Gulamhussein等比较了SMA与DIB-MA两种聚合物对不同表达系统的具有不同形状和不同大小的膜蛋白质在增溶效率、提取纯度和稳定性能方面的差异,如图1-11所示。DIBMA对某些膜蛋白质的增溶效率并没有优于SMA,所提取膜蛋白质的纯度也不如SMA,这是由于DIBMALPs的尺寸较SMALPs大,提取出来的杂质随之增多。较大尺寸的DIBMALPs能包容更多的膜脂,膜脂的有序度因为空间的增大而下降,这可能不利于膜蛋白质结构和功能的稳定,但也可能为蛋白质构象变化和动力学研究提供更好的环境。

图1-11 比较SMALPs与DIBMALPs
Tribet等开发了一类新型两亲性聚合物(APols),其结构特征为低分子量聚丙烯酸的羧基被辛胺和异丙胺随机酯化。APols这一命名是为了将这类两亲性聚合物与化学或工业等其它领域的两亲性聚合物区分,其中被应用和研究最为广泛的是A8-35。A8-35中有25%的羧基被辛胺随机酯化,40%的羧基被异丙胺随机酯化,剩下35%的游离羧基,使其具有温和的表面活性。另外,与去垢剂分子相比,聚合物链具有一定粘度,与膜蛋白质接触位点更多,能使膜蛋白质在更长时间和更高温度下保持稳定状态。A8-35主要缺点在于其临界缔合浓度较低,不能像SMA那样直接溶解细胞膜,提取膜蛋白质。基于此,Marconnet等作出假设,用环烷烃替代A8-35中线性的烷基侧链,期望环烷烃能发挥SMA中苯环的作用,可以自发地吸附到磷脂双分子层上,这是实现生物膜增溶、膜蛋白质提取的第一步。结合SMA独特的膜增溶性能和A8-35优异的膜蛋白稳定性能,Marconnet等制备了聚丙烯酸衍生物CyclAPols。A8-35和CyclAPols结构如图1-12。经过一系列膜蛋白质提取实验,结果表明,所制备的CyclAPols可用于直接提取膜蛋白质和膜脂,提取速度甚至比SMA更快。例如,对于膜蛋白质YidC,CyclAPols可在1小时左右达到最大提取率,而SMA用时超过1小时。此外,CyclAPols对膜蛋白质的稳定性优于SMA。例如,对于HsBR膜蛋白质,50℃加热处理6小时,在CyclAPols中可保留80-85%的原始构象,而在SMA中约保留20%。
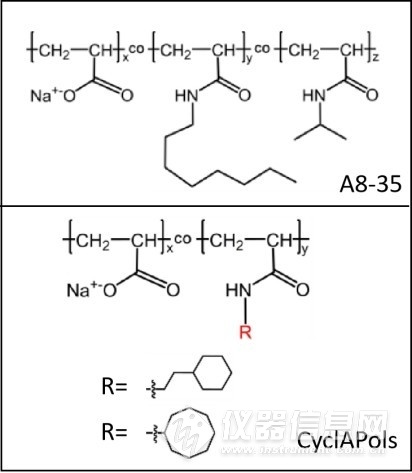
图1-12 A8-35和CyclAPols结构[92]
Fig. 1-12 Structures of A8-35 and CyclAPols[92]
Yasuhara等[97]首次报道了聚甲基丙烯酸酯两亲性共聚物,如图1-13所示,甲基丙烯酸丁酯可提供非极性侧链,而甲基丙烯酰氧乙基三甲基氯化铵可提供带正电荷的极性侧链。动态光散射、电镜、核磁共振测试证实了制备的聚合物可以有效溶解磷脂双分子层形成纳米圆盘结构。此外,与SMA相比,聚甲基丙烯酸酯衍生物中不含苯环和酰胺键,可将提取的膜蛋白质直接进行荧光、圆二色谱表征,这些表征可用于研究淀粉样蛋白质聚集的动力学和淀粉样蛋白质聚集过程中的结构变化。因此,该聚合物被进一步用于研究人胰岛淀粉样多肽(hIAPP),而hIAPP产生淀粉样聚集变性与2型糖尿病中胰岛细胞的死亡息息相关。

图1-13 两亲性甲基丙烯酸酯共聚物[96]
Fig. 1-13 Amphiphilic methacrylate copolymers[96]








