
方案摘要
方案下载| 应用领域 | 生物产业 |
| 检测样本 | 其他 |
| 检测项目 | |
| 参考标准 | / |
本实验方案利用微滴/微球制备仪,以含有螯合物Ca-EDTA和海藻酸钠的溶液为水相1,以含有螯合物Zn-EDDA和海藻酸钠的溶液为水相2,以Drop-Surf微滴生成油为油相制备高单分散的海藻酸钠凝胶微球(CV小于5%)。
实验目的:
本实验方案利用微滴/微球制备仪,以含有螯合物Ca-EDTA和海藻酸钠的溶液为水相1,以含有螯合物Zn-EDDA和海藻酸钠的溶液为水相2,以Drop-Surf微滴生成油为油相制备高单分散的海藻酸钠凝胶微球(CV<5%)。
引言:
水凝胶是一类重要的软性材料,被广泛应用于药物研究、药物递送、组织工程和食品科学等领域。在众多制备水凝胶的天然高分材料中,海藻酸盐作为一种天然多糖,由于其低毒性、温和的离子交联条件、良好的生物相容性和生物可降解性等优点,在生物医学领域得到极大的关注[1]。
目前,现有技术报道了微米大小的海藻酸盐凝胶珠作为3D细胞培养的生物支架模拟细胞生长的基质环境,被广泛应用于活细胞的封装、培养和监测[2]。Uyen N.T.T.等人发现微米级的海藻酸盐凝胶微球既可以控制药物的释放速度,又能将药物递送到特定的治疗靶点,且药物释放后的海藻酸盐可直接被降解通过代谢排出体内[3]。通常情况下,海藻酸盐水溶液在封装过程中与Ca2+、Ba2+、Cu2+、Cd2+和Sr2+等二价阳离子进行离子交联以制备海藻酸盐凝胶。如将海藻酸钠滴入过量的氯化钙水溶液中,并通过搅拌或超声制备海藻酸盐微凝胶珠[4]。然而,这种方法生产的微凝胶存在粒径单分散性差和形状不规则等缺点。因此,生产单分散性良好和结构均匀的凝胶珠仍存在不少问题。
采用液滴微流控技术可以生产形状精确可控和粒径均一的海藻酸盐凝胶。通常,海藻酸钠溶液在液滴微流控芯片中乳化并分散在油相中,并与Ca2+进行交联。而这种快速的交联反应可能导致液滴生成粒径不均和微流控芯片的堵塞。因此,采用液滴微流控制备时需将液滴生成与凝胶化反应分开。现有技术中公开了通过将CaCO3纳米颗粒分散于海藻酸盐水溶液中,然后将生成后的液滴暴露在酸性条件下,导致CaCO3的溶解释放Ca2+,并使其与海藻酸盐交联凝胶化[5]。然而,由于CaCO3呈颗粒状,pH降低导致Ca2+的释放分布不均,进而使得离子交联均匀性较差。此外,纳米颗粒的团聚也会导致微流控芯片流道的堵塞。
为此,Utech等通过用螯合剂乙二胺四乙酸(EDTA)螯合Ca2+形成Ca-EDTA,使其稳定的分散在海藻酸盐溶液中。然后,将经微流控芯片制备微液滴的油水混合物通入酸性的油相中,Ca2+由H+与EDTA的结合而被释放,并与海藻酸盐交联形成凝胶珠[6]。虽然这种方法可以制备结构均匀的离子交联海藻酸盐凝胶珠,但该工艺凝胶固化所需的pH(pH<5)较低。这很有可能会严重影响细胞的存活,不利于细胞和组织生长。
基于以上存在的问题,FluidicLab微滴制备平台通过借助配体与离子结合能力的不同,实现凝胶离子Ca2+有序可控的释放,以达到海藻酸钠微球凝胶固化的目的[7,8]。其原理示意图下图所示,将含有螯合物Ca-EDTA和海藻酸钠的溶液作为水相1,含有螯合物Zn-EDDA和海藻酸钠的溶液作为水相2;当两种水相混合后,因螯合剂与金属离子的结合能力存在差异,Zn2+会与EDTA结合从而导致Ca2+的释放,而被释放的Ca2+与海藻酸钠反应实现凝胶固化。通过上述方式结合FluidicLab微滴制备平台制备的海藻酸钠凝胶微球是在中性、低离子浓度的温和条件下进行的,制备反微球粒径均一性高,反应速度快,凝胶固化时间短,大大减少对健康细胞的伤害。
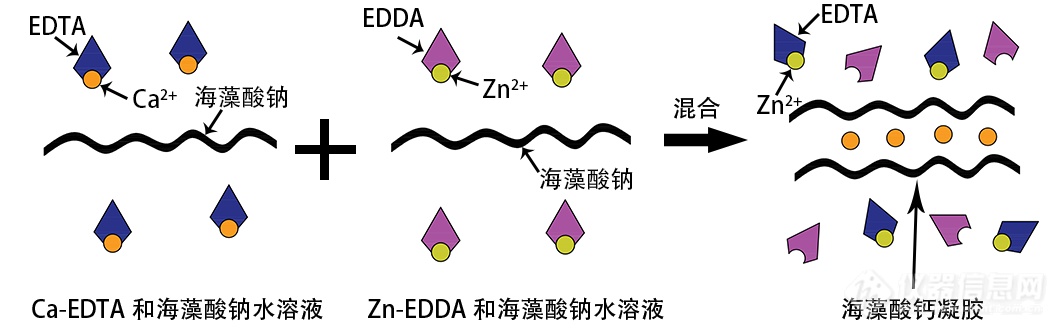
实验材料:
试剂 | 微滴生成油(Drop-Surf,FluidicLab) |
破乳剂(Drop-Surf,FluidicLab) | |
海藻酸钠(FluidicLab) | |
无水氯化钙(Macklin, C805228-100 g) | |
EDTA溶液(Macklin, 0.5 M, pH 7.4, E885215-1L) | |
乙二胺-N, N′-二乙酸(EDDA, Macklin, E838453-5 G) | |
无水醋酸锌(Macklin, E820824-25 G) | |
氢氧化钠(Macklin, S817971-500 G) | |
PBS缓冲液粉末(Macklin, P854529-10EA) | |
耗材 | 50 mL离心管(Falcon 50 mL REF 352098)若干 |
15 mL离心管(Falcon 15 mL REF 352097)若干 | |
1.5/2 mL离心管若干 | |
内/外径0.25 /1.6 mm PEEK管及所需接头 | |
0.22 μm针式过滤器(PTFE材质)和注射器若干 | |
芯片夹具 | PDMS-SCE-100/50/30 μm芯片(FluidicLab) |
PDMS标准芯片夹具 | |
设备 | Fluidiclab微滴/微球制备仪(三通道) |
辅助设备 | 电脑(Win10 以上系统) |
普通光学显微镜(用于测微球粒径) | |
梅特勒托利多pH计 |
实验步骤:
1. 试剂配制:
① 2 M CaCl2 溶液配制:
取2.2197 g的无水CaCl2 (MCaCl2=110.984 g/moL)加入超纯水振荡溶解,最终定容至10 mL备用。
② 2 % (wt%)海藻酸钠溶液配制:
取0.2 g的海藻酸钠固体粉末加入超纯水超声振荡,60 ℃加热辅助溶解,最终定容至10 mL备用。
③ 2 M NaOH溶液配制
取1.6 g的NaOH(MNaOH=176.17 g/moL)加入超纯水振荡溶解,最终定容至20 mL备用。
④ 80 mM Ca-EDTA溶液(pH=6.7)
取400 μL配制的2 M CaCl2与1.6 mL 的0.5 M EDTA振荡均匀,加入5 mL超纯水振荡均匀,然后滴加2M NaOH调整pH至6.7左右,最终加入超纯水定容至10 mL。
【注】下表加入体积供参考,实际加入量以pH值变化为准。
序号 | 依次加入2 M NaOH体积(μL) | pH测量值 |
1 | 0 | 3.92 |
2 | 200 | 4.38 |
3 | 150 | 5.97 |
4 | 5 | 6.21 |
5 | 3 | 6.38 |
6 | 2 | 6.51 |
7 | 1 | 6.58 |
8 | 0.5 | 6.63 |
9 | 0.5 | 6.67 |
总体积 | 362 | / |
⑤ 80 mM Zn-EDDA溶液(pH=6.7)
取0.1465 g的无水Zn(CH3CHO2)2 (MZn(CH3CHO2)2=183.48 g/moL)与0.1416 g的乙二胺-N, N′-二乙酸(EDDA,MEDDA=176.17 g/moL),加入5 mL超纯水超声振荡溶解,然后滴加2M NaOH调整pH至6.7左右,最终加入超纯水定容至10 mL。
【注】下表加入体积供参考,实际加入量以pH值变化为准。
序号 | 依次加入2 M NaOH体积(μL) | pH测量值 |
1 | 0 | 3.96 |
2 | 500 | 5.01 |
3 | 200 | 5.71 |
4 | 40 | 6.06 |
5 | 20 | 6.44 |
6 | 3 | 6.53 |
7 | 2 | 6.62 |
8 | 1 | 6.65 |
9 | 0.5 | 6.68 |
总体积 | 766.5 | / |
⑥ 水相1配制(0.6%海藻酸钠, 40 mM Ca-EDTA)
取等体积80 mM Ca-EDTA溶液与1.2%海藻酸钠溶液振荡均匀得到分散相1,用0.22 μm针式过滤器过滤备用。
⑦ 水相2配制(0.6%海藻酸钠, 40 mM Zn-EDDA)
取等体积80 mM Zn-EDDA溶液与1.2%海藻酸钠溶液振荡均匀得到分散相2,用0.22 μm针式过滤器过滤备用。
2. 海藻酸钠微球制备:
1. 微滴/微球制备仪的安装连接
微滴/微球制备仪安装连接参考《微滴/微球制备仪使用手册V.1.0》中“2. 微滴/微球制备仪的安装连接”的部分;其连接如下(步骤③-⑦连接效果如下图所示):

① 用气管依次连接“空气压缩机”--“气源处理装置”--“微滴/微球制备仪”;
② 将微滴/微球制备仪分别与电源、电脑的连接;
③ 用气管分别将A0(压力输出通道一)和A1(油相15 mL储液池),B0(压力输出通道二)和B1(水相1的2 mL储液池)连接,C0(压力输出通道三)和C1(水相2的2 mL储液池);
④ 用配有1/4-28螺纹接头和卡箍的PEEK管(内/外径 0.25 mm/1.6 mm)分别将A1(油相15 mL储液池)和A2(通道一流量传感器),B1(水相1的2 mL储液池)和B2(通道二流量传感器)连接,C1(水相2的2 mL储液池)和C2(通道三流量传感器)连接;
⑤ 用配有1/4-28螺纹接头和卡箍的PEEK管(内/外径 0.25 mm/1.6 mm)分别将A2(通道一流量传感器)和A3(PDMS芯片的油相入口),B2(通道二流量传感器)和B3(PDMS芯片的水相1入口)连接,C2(通道三流量传感器)和C3(PDMS芯片的水相2入口)连接;
⑥ D为标准PDMS芯片和夹具的组合,芯片和夹具的入口通过硅胶塞密封;
⑦ 用PEEK管(内/外径 0.25 mm/1.6 mm)将芯片出口E处生成的乳液导出。
2. FluidicLabSuite软件的安装和设备的添加:
FluidicLabSuite软件的安装参考《微滴/微球制备仪使用手册V.1.0》中“3.1 FluidicLabSuite软件的安装”的部分(相机和流量传感器仅需添加一次);
3. 海藻酸钠微滴的制备和固化:
具体操作步骤如下(参考视频“微流控应用:微滴制备仪制备海藻酸钠微球”):
① 分别在15 mL油相储液池(通道一),2 mL水相1储液池(通道二)和2 mL水相2储液池(通道三)中依次加入5 mL微滴生成油,2 mL 水相1(0.6%海藻酸钠, 40 mM Ca-EDTA)和2 mL水相2(0.6%海藻酸钠, 40 mM Zn-EDDA);
② 打开空气压缩机和气源处理装置开关;
③ 在乳液出口端放置离心管接收微滴稳定前的废液;
④ 在电脑端设置通道一压力(油相,如250 mbar)、通道二压力(水相1,如350 mbar)和通道三压力(水相2,如350 mbar)排出管路和芯片中的空气;
⑤ 待管路和芯片中填充满液体后(空气被完全排出),将整个系统由压力控制切换到流速控制,并设置通道一(油相),通道二(水相1)和通道三(水相2)流速分别为20,5和5 μL/min;
⑥ 调整反馈值(Feedback)快速达到设定流速,并实现流速的稳定输出;
⑦ 用疏水培养皿接收一滴乳液,并在普通光学显微镜下观察其微滴的均匀性;
⑧ 待微滴生成均匀后,即可开始接收1.5 mL离心管中;
⑨ 一段时间后停止收集,密封于离心管中,静置10 min固化。
4. 海藻酸钠微球的破乳清洗:
具体操作步骤如下(参考视频“微流控应用:微滴制备仪制备海藻酸钠微球”):
① 取出1.5 mL离心管底部微滴生成油;
② 按V球:V破=1:2 加入破乳剂,振荡破乳;
③ 1000 rpm离心处理30 s,并取出底部破乳剂;
④ 重复上述②和③操作;
⑤ 最终将得到海藻酸钠微球分散于配制的PBS缓冲液中。
5. 微滴/微球制备仪清洗:
微滴生成仪每次使用完必须清洗管路、流量传感器和芯片。具体操作详见“微滴/微球制备仪操作指导卡”。
结果与讨论:
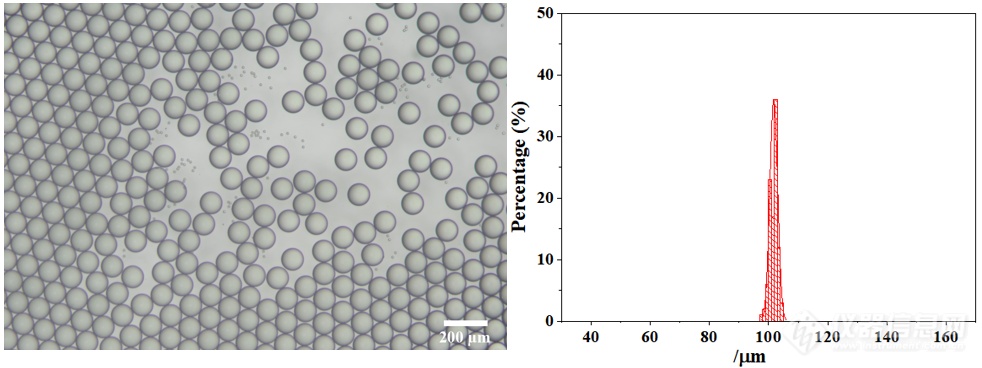
刚接收的微滴平均粒径为101.74 μm,具有极高的单分散性(变异系数:CV=1.30%)。其显微镜图和粒径分布如下图所示:
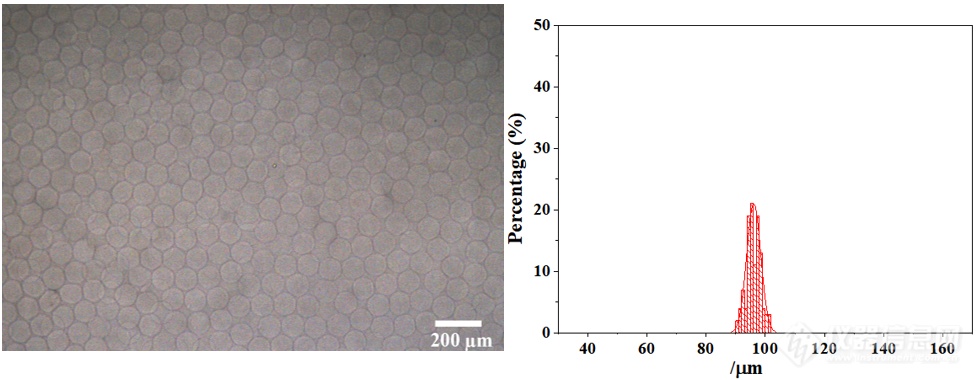
微滴交联固化分散于PBS中的海藻酸钠微球平均粒径为96.08 μm,具有极高的单分散性(变异系数:CV=2.52%)。其显微镜图和粒径分布如下图所示:
此外,我们也采用了不同类型的芯片制备了1%海藻酸钠微球,其中水相1中Ca-EDTA和水相2中的Zn-EDDA浓度都为40 mM。具体参数如下表所示:
芯片类型 | 油相 | 水相1 | 水相2 | 微滴粒径 | CV(%) | 微球粒径 | CV(%) | |||
流速 | 压力 | 流速 | 压力 | 流速 | 压力 | |||||
PDMS-SCE-100 | 10 | 85 | 1.5 | 366 | 1.5 | 366 | 101.68 | 1.69 | 107.24 | 1.61 |
10 | 114 | 4.5 | 855 | 4.5 | 859 | 112.39 | 1.99 | 110.54 | 2.03 | |
20 | 166 | 5 | 959 | 5 | 944 | 100.60 | 1.81 | 103.16 | 1.76 | |
20 | 176 | 6.5 | 1110 | 6.5 | 1081 | 106.57 | 1.72 | 107.24 | 1.71 | |
PDMS-SCE-50 | 4 | 174 | 1 | 1145 | 1 | 1157 | 53.83 | 2.66 | 58.39 | 4.10 |
4 | 251 | 2 | 1727 | 2 | 1658 | 60.07 | 2.49 | 65.94 | 3.37 | |
8 | 309 | 2 | 1700 | 2 | 1663 | 51.28 | 2.62 | 55.81 | 3.99 | |
PDMS-SCE-30 | 5 | / | 2 | / | 2 | / | 33.72 | 2.81 | 34.42 | 3.46 |
参考文献:
[1] Ching S. H., et al. Alginate gel particles–a review of production techniques and physical properties, Crit. Rev. Food Sci., 57, 1133-1152 (2015).
[2] Andersen T., et al. 3D cell culture in alginate hydrogels, Microarrays, 4, 133-161 (2015).
[3] Uyen N.T.T.,et al. Fabrication of alginate microspheres for drug delivery: a review,Int. J. Biol. Macromol., 153, 1035-1046 (2020).
[4] Rajaonarivony M., et al. Development of a New Drug Carrier Made from Alginate,J. Pharm. Sci-US, 82, 912-917 (1993).
[5] Zhang H., et al. Exploring microfluidic routes to microgels of biological polymers, Macromol. Rapid Comm.,28, 527-538 (2007).
[6] Utech S., et al. Microfluidic generation of monodisperse, structurally homogeneous alginate microgels for cell encapsulation and 3D cell culture,Adv. Heal. Mater., 4, 1628-1633 (2015).
[7] Håti A. G., et al. Versatile, cell and chip friendly method to gel alginate in microfluidic devices, Lab Chip, 16, 3718(2016).
[8] Bassett D. C., et al. Competitive ligand exchange of crosslinking ions for ionotropic hydrogel formation, J.Mater. Chem. B, 4, 6175(2016).


实验方案:微流控混合方式制备盐酸多柔比星脂质体(Doxorubicin-Liposome)
实验方案:微滴/微球制备仪制备透明质酸(HAMA)微球
文献导读 之 mRNA-LNP 在体(in vivo)改造CAR-T细胞 在体(in vivo)改造的CAR-T细胞治疗心脏损伤
FluidicLab自动微球/微液滴制备仪-液滴微流控系统
FluidicLab 微流控智能LNP脂质纳米颗粒合成仪
FluidicLab微流控多通道精密压力泵
FluidicLab脂质纳米颗粒(LNP)科研级制备系统-微流控
FluidicLab玻璃/PDMS标准微流控芯片夹具
FluidicLab微流控精密压力控制器Light版
FluidicLab多通道高精密微流控压力泵/压力控制器
FluidicLab单细胞包裹/Janus微球生成微流控芯片PDMS材质
FluidicLab微流体流量传感器-热差式流量计-微流控
FluidicLab血脑屏障器官芯片
FluidicLab微流控电动旋转选通阀/切换阀
FluidicLab层流流动腔流通池flow cell
Fluidiclab数字型压力传感器/模拟型压力传感器
FluidicLab 微流控芯片|定制加工|微球液滴制备生成
FluidicLab压力传感器数据采集卡

关注

拨打电话

留言咨询