JPA综述:新冠病毒核酸检测最新进展和展望
导读:浙江大学蔡圣老师团队近日在JPA杂志发表一篇综述,系统阐述了新型冠状病毒核酸检测的最新进展以及展望。
文章译自浙江大学蔡圣老师团队发表于Journal of Pharmaceutical Analysis(JPA)期刊的一篇综述。原标题为:《Recent advances and perspectives of nucleic acid detection for coronavirus》
新型冠状病毒(SARS-CoV-2)引起的肺炎暴发对全球公共卫生构成了巨大威胁。因此建立快速的标准诊断测试以检测传染病(COVID-19),防止继发性传播尤为重要。聚合酶链反应(PCR)被视为具有高灵敏度和特异性的病毒和细菌感染分子诊断的金标准。等温核酸扩增因为其在恒温条件下无需热循环仪即可快速操作的基本优势,被认为是一种非常有前途的候选方法。这篇综述总结了目前可用于冠状病毒核酸的检测方法,有助于研究人员和临床医生开发更好的技术,以及时有效地检测冠状病毒感染。
1 基于PCR的方法
PCR是一种酶学方法,可通过分离包含基因片段的两条DNA链,用引物标记其位置,并使用DNA聚合酶在每个片段旁边组装一个拷贝并连续复制这些拷贝来产生基因的多个拷贝,该技术被广泛用于扩增微量生物材料。由于它的高灵敏度和高序列特异性,基于PCR的方法已成为用于检测冠状病毒常规和可靠的技术。通常操作是,通过逆转录将冠状病毒RNA转移到cDNA中,然后,进行PCR扩增,最后通过特定的检测方法或仪器检测PCR产物。在这些中,凝胶可视化和测序是PCR技术之后用于检测冠状病毒方法,然而,由于其过程耗时且成本较高,这些方法在临床样品中并不常用。
实时逆转录PCR(RT-PCR)技术目前被冠状病毒检测所青睐,因为它具有特异性强,简便进行定量分析的优势。此外,在早期,实时RT-PCR比常规RT-PCR测定法能够诊断出更多感染者。因此,实时RT-PCR测定法仍然是一个主要的方法被应用于检测各种冠状病毒的检测。
尽管RT-PCR已经在本次战“疫”中大显身手,但科学界依然投入大量精力来改进实时RT-PCR技术。因为RT-PCR方法容易受到污染,并且样品处理和PCR后数据分析耗时。因此,van Elden等描述了基于TaqMan的实时RT-PCR,可以在常规诊断设置中轻松实现HCoV的检测。此外,为了进一步提高灵敏度,Yip等人使用2个TaqMan探针代替1个探针设计了SARS-CoV的实时定量RT-PCR分析。使用双TaqMan探针进行定量的这种简单修饰方法在需要超敏性的领域具有广泛的应用,SARS-CoV检测限为每个反应1个拷贝RNA。
在临床检测中,缺乏安全和稳定的外部阳性对照(EPC)可能成为冠状病毒诊断中的严重问题,该问题已引起了广泛关注。Yu等开发了一种实时RT-PCR分析,其中装甲RNA被用作EPC来检测SARS-CoV,检测极限为10拷贝/μL。同时,冠状病毒的快速突变性质凸显了对准确检测遗传多样性冠状病毒的需求。因此,为了提高精确检测冠状病毒的能力并降低由基因组序列变异引起的假阴性结果的风险,研究人员建立了多重实时RT-PCR方法,对冠状病毒的多靶点检测具有良好的敏感性。Hadjinicolaou等使用耐错配的分子信标开发了实时RT-PCR测定法,以区分致病菌株和非致病菌株。该测定法包含四个信标,除了内部阳性对照外,还靶向四个基因。它已使用临床样品进行了验证,该样品具有目标检测能力和特异性,每个反应的检测极限为5个拷贝。
2 基于核酸等温扩增的方法
2.1 基于常规的LAMP方法
LAMP是高效的新型等温核酸扩增方法。它通常用于DNA和RNA的扩增,由于其指数扩增特性,且分别由4种不同的引物同时鉴定的6个不同的靶序列而显示出很高的灵敏度和高特异性。另一方面,LAMP技术测定快速且不需要昂贵的试剂或仪器,因此,LAMP检测的应用可能有助于降低检测冠状病毒的成本。目前,很多企业已经开发了基于LAMP的冠状病毒检测方法并将其应用于临床诊断。
凝胶电泳通常用于分析扩增产物以进行终点检测。潘等人报告了一种用于SARS诊断的简单LAMP检测方法,并证明了使用该技术检测SARS-CoV的可行性。选择SARS-CoV的ORF1b区域用于SARS诊断,并在6个引物的存在下通过LAMP反应进行扩增,然后通过凝胶电泳对扩增产物进行分析。LAMP分析中SARS-CoV的检测率和灵敏度与常规基于PCR的方法相似。Pyrc等成功地将LAMP用于琼脂糖凝胶电泳检测HCoV-NL63,在细胞培养物和临床标本中具有良好的灵敏度和特异性。值得注意的是,检测极限是每个反应1个RNA拷贝。可以检测到焦磷酸镁或荧光染料的沉淀。通过监测焦磷酸盐或荧光的浊度,可以使该方法实时进行,从而有效地解决了终点检测的局限性。
Shirato等人以这种方式开发了一种有用的RT-LAMP测定法,用于诊断和监测人类MERS-CoV的流行病学。该技术能够检测到3.4份MERS-CoV RNA,并且具有高度特异性,与其他呼吸道病毒无交叉反应。Thai等开发了一种单步单管加速实时定量RT-LAMP测定法,该测定法通过在光度计中实时测量浊度进行监控,以早期和快速诊断SARS-CoV。在临床样品中,发现该检测方法的灵敏度比常规RT-PCR高100倍,检出限为0.01个噬菌斑形成单位(PFU)。
2.2 基于特定序列的LAMP方法
然而,如果这些方法依赖于非特异性信号转导方案,例如荧光染料插入任何双链DNA扩增子中,或者由于聚合过程中焦磷酸盐的释放而导致溶液浑浊,则不能排除由引物二聚体或非引物反应产生的意外信号的可能性。一种用于监视LAMP和其他等温扩增反应的序列特定且可靠的方法,可以轻松地将真实信号与非特异性噪声区分开来,解决此问题。
Shirato等通过使用淬灭探针(QProbe)监测信号改进了RT-LAMP测定,在检测MERS-CoV方面与标准实时RT-PCR测定具有相同的性能。此外,黄等建立了一种将RT-LAMP和垂直流可视化条带(RT-LAMP-VF)结合使用检测MERS-CoV的核酸可视化技术。如图1A 所示,等温扩增中涉及的两个环引物(LF和LB)分别用异硫氰酸荧光素(FITC)和生物素标记。扩增后,用生物素标记的扩增子可以结合与链霉亲和素缀合的胶体金颗粒,形成复合物,随后被包被在条带文本行上的抗FITC抗体捕获(图1 B),从而呈现出肉眼可见的彩色线。在这种情况下,MERS-CoV RNA的检出限为10拷贝/μL。
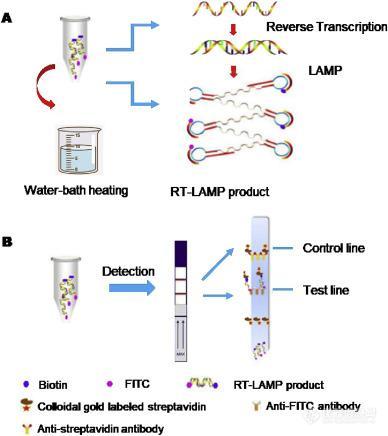
图1. RT-LAMP-VF分析的示意图。(A)用于RT-LAMP的扩增反应和(B)在可视化条上检测。
埃灵顿小组的科学家做了很多工作,既可以提高LAMP检测的特异性,又可以使读数更简单、更可靠。他们用称为单步链置换(OSD)的介导链交换反应代替了通常用于实时荧光监测的嵌入染料,并将其用于LAMP扩增子的实时序列特异性验证。所得检测结果可在30-50分钟内检测出感染细胞培养上清液中的0.02-0.2 PFU(5-50 PFU / mL)的MERS-CoV,并且不会与常见的人类呼吸道病原体发生交叉反应还开发了其他链交换信号转导,以使LAMP反应易于使用。如图2所示,Du等通过将LAMP与热稳定的转化酶结合,可以直接将MERS冠状病毒模板转导为葡萄糖信号,通过商业血糖仪轻松读取信号,可检测20–100拷贝/μL。人绒毛膜促性腺激素(hCG)也被用作信号进行分析。hCG与DNA寡核苷酸位点特异性结合,从而在基于LAMP的病毒测定中允许通过链交换将信号转导到hCG的捕获(信号关闭)和释放(信号打开)中。当人血清和唾液中仅有20拷贝病毒模板时,通过该方法也能准确检测到。
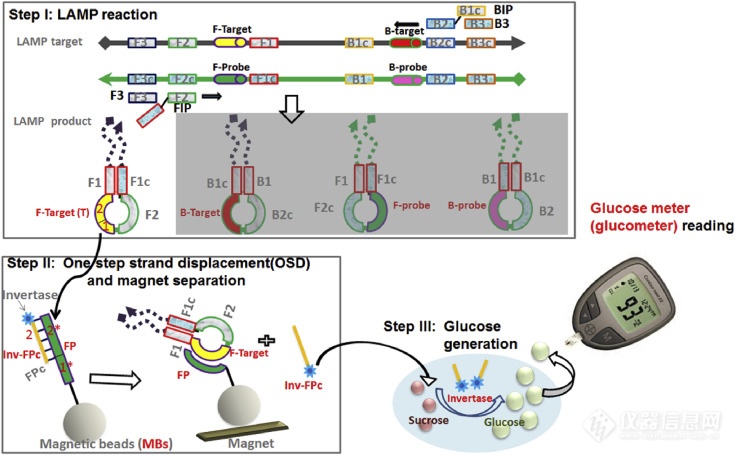
图2 使等温扩增适应血糖仪的方案。
同时,LAMP在65°C左右显示最佳性能,这限制了其应用。蔡等开发了一种LAMP版本,该版本使用了硫代磷酸酯化引物(PS-LAMP),能够在生长辅酶的末端更有效地形成和延伸发夹,从而在较低的温度下工作。研究表明,在40°C下用PS-LAMP检测扩增子的灵敏度和选择性与65°C下的常规LAMP反应相当。
2.3 基于滚环扩增放大的方法
滚环扩增(RCA)在核酸检测中已经获得了相当大的关注。在等温条件下,RCA能够在90分钟内将每个圆的信号放大109倍。有学者在液相和固相中都建立了通过RCA检测SARS-CoV的有效方法,并在少量临床呼吸道标本上提供了初步结果。RCA的主要优点是,它可以在恒温条件下用最少的试剂进行操作,并且避免了假阳性结果的产生,而这在基于PCR的测定中经常遇到。
3 基于微阵列的方法
微阵列法是一种快速且高通量的检测方法。在这种方法中,冠状病毒RNA将首先通过逆转录产生用特定探针标记的cDNA。然后将这些标记的cDNA加载到每个孔中,并与固定在微阵列上的固相寡核苷酸杂交,然后进行一系列洗涤步骤以去除游离DNA。最后,可以通过检测特定探针来检测冠状病毒RNA。由于其快速、高通量的优越性,微阵列分析已广泛用于冠状病毒的检测。
Shi等根据TOR2的序列设计了一个60 mer的寡核苷酸微阵列,并将其成功地用于临床样品中SARS冠状病毒的检测。但是,考虑到SARS-CoV的快速突变,Guo等开发了一种微阵列,可在样本检测中以100%的准确度检测SARS-CoV的尖峰(S)基因中的24个单核苷酸多态性(SNP)突变。Luna等设计了一种无荧光的低成本,低密度寡核苷酸阵列,用于检测整个冠状病毒属,其灵敏度与各个实时RT-PCR的灵敏度相同,Hardick等(2002)评估了一种基于微阵列芯片的新型,便携式和近POC诊断平台,即移动分析平台(MAP),它在识别病毒和可接受的检测限方面具有良好的性能。
4 新开发的方法
相关酶的Cas13 RNA靶向CRISPR最近已适于核酸[快速和便携式传感。Zhang的研究小组证明,Cas13可以被编程为靶向并破坏多种哺乳动物单链RNA病毒的基因组(图3)。他们开发了一个名为SHERLOCK(特定的高灵敏度酶报告分子解锁)的平台,该平台将等温预扩增与Cas13结合使用,以检测RNA或DNA的单分子。它可以检测登革热或Zika病毒单链RNA以及患者液体活检样品中的突变。网站(https://broad.io/sherlockprotocol)上报道了他们最近关于COVID-19的协议,题为“使用CRISPR诊断程序检测COVID-19的协议”,该协议可能为有兴趣进一步研究的研究人员提供一些参考点该诊断系统突出了其作为核酸的可复用,便携式,快速和定量检测平台的潜力。
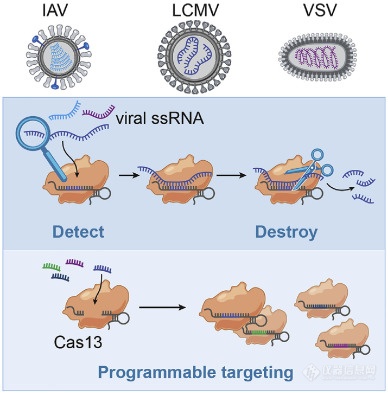
图3 使用Cas13检测RNA病毒的方案。
总结与展望
当前,COVID-19的诊断主要依赖于冠状病毒RNA的检测。选择适当的检测方法非常重要。但是,上述每种方法都有其独特的优点和不可避免的缺点。PCR以高灵敏度和特异性广泛用于病毒鉴定,但其分析需要各种专业设备和受过专业培训的分析人员,而这只能由完善的实验室来完成。LAMP是一种超灵敏的核酸扩增方法,通常可以在大约一个小时内检测少量的DNA或RNA模板,但是高温的要求仍然限制了其适用性。至于微阵列,高成本不可避免地限制了它在冠状病毒检测中的进一步应用。
迄今为止,科学家们已经做出了很大的努力来改善冠状病毒的检测,并且已经开发了各种改进的或新的方法。在实际应用中,通常将几种方法结合起来,以尽量避免使用单一方法的弊端。简而言之,随着新技术和方法的飞速发展,我们相信未来将开发出更加出色和高效的检测方法,这将为科学家/临床医生提供更多选择。同时,只有根据特定目的平衡各种检测方法的优缺点,才能获得最经济,最优化的选择。
作者蔡圣:现任浙江大学药学院副教授,硕士生导师。主要从事药物分析新方法新技术研究,包括功能纳米材料、核酸适配体技术在蛋白及药物检测中的应用;核酸扩增方法在药物和药物效应分子检测和成像中的应用。
关于JPA:JPA于2011年创刊,是一本药物分析研究领域的英文专业期刊,由教育部主管、西安交通大学主办,与Elsevier合作出版,西安交通大学药物分析研究所贺浪冲教授担任主编。
来源于:仪器信息网
热门评论
最新资讯
新闻专题
更多推荐













