新增11项 盘点获得医疗器械注册证的质谱试剂盒产品(附更新表)
进入 #临床质谱技术与应用阅读更多话题内容
导读:自2017年9月以来,进口试剂产品并无更多更新信息,反之,国产试剂产品在近两年不断进行升级,通过CFDA认证批准的产品由2017年的5项增加至16项。
仪器信息网讯 近年来,随着精准医疗的不断发展,作为精准诊疗的高新技术平台,质谱技术在临床中的应用也越来越深入和广泛。虽然同国外相比,中国在临床质谱应用方面起步较晚,但得益于国内对高端医疗技术需求的不断增强,质谱作为检验领域的后起之秀,在近些年得到了行业上下游生产厂商及医院、检验机构等的极大关注。由于国内临床市场对质谱的需求急剧增加,国内外各大质谱厂商将其产品向国家药品监督管理局(NMPA,原CFDA)进行申报,其中一些质谱检测仪器、相关试剂产品已经获得NMPA认证并取得相关医疗器械证件。
仪器信息网编辑在此前统计过截止2017年的相关信息,为方便大家更全面的了解近两年的变化及更新情况,仪器信息网现对截止2020年3月获NMPA批准且在有效期内的可应用于临床检测的质谱产品进行了汇总,其中包括相关质谱仪器及试剂产品,并分为上下文整理。(点击详情了解质谱仪器篇内容)
截止2020年3月,通过CFDA医疗器械注册且尚在有效期内的质谱相关试剂盒产品共20项,其中进口试剂产品4项,国产试剂产品16项。其中,自2017年9月以来,进口试剂产品并无更多更新信息,反之,国产试剂产品在近两年不断进行升级,通过CFDA认证批准的产品由2017年的5项增加至16项。以下为这些试剂产品详细的CFDA医疗器械注册信息。

2017年9月-2020年3月期间,获得CFDA医疗器械认证批准的进口质谱试剂产品由5项减少至4项,国产质谱试剂产品由5项增加至16项,其中1项为认证更新。(图片顺序按批准日期先后)
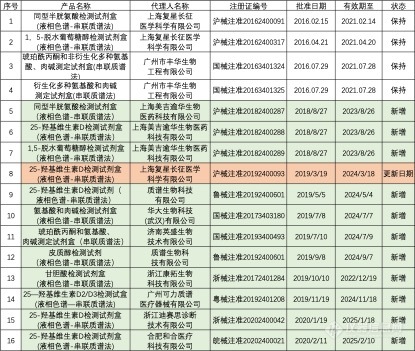
详细的质谱产品信息如下:
获得CFDA医疗器械认证批准的进口质谱试剂产品:
1. 多种氨基酸和肉碱测定试剂包(串联质谱法)
注册证编号:国械注进20163401510
注册人名称:华莱克有限公司
代理人名称:珀金埃尔默企业管理(上海)有限公司
型号、规格:流动相溶剂:473 mL/瓶×3瓶;萃取液237 mL/瓶×1瓶;复溶溶液237 mL/瓶×1瓶;3.0 N盐酸正丁醇110 mL/瓶×1瓶。
批准日期:2016.04.19
有效期至:2021.04.18
主要组成成分:含流动相溶剂、萃取液、复溶溶液、3.0N 盐酸正丁醇。
预期用途:本产品与多种氨基酸和肉碱测定试剂盒(串联质谱法)配合使用,用于测量采集到滤纸片上的新生儿足跟穿刺干血样中的氨基酸、游离肉碱以及酰基肉碱的浓度。
产品储存条件及有效期:2~30°C 避热避光条件下保存,有效期 15个月。
2. 多种氨基酸和肉碱测定试剂盒(串联质谱法)
注册证编号:国械注进20163401511
注册人名称:华莱克有限公司
代理人名称:珀金埃尔默企业管理(上海)有限公司
型号、规格:1920人份试剂/盒
批准日期:2016.04.19
有效期至:2021.04.18
主要组成成分:含氨基酸内标准品、酰基肉碱内标准品、干血斑质控品、V 型底耐热微孔板、V 型截底透明微孔板 、铝箔片微孔板封套、粘性微孔板封套、热封膜、微孔板条形码标签、与批次匹配的质量控制证书。
预期用途:本试剂盒用于测量采集到滤纸片上的新生儿足跟穿刺干血样中的氨基酸、游离肉碱以及酰基肉碱的浓度。
产品储存条件及有效期:2~8°C条件下储存,有效期为12 个月。
3. 非衍生化多种氨基酸、肉碱和琥珀酰丙酮测定试剂盒(串联质谱法)
注册证编号:国械注进20173400071
注册人名称:华莱克有限公司
代理人名称:珀金埃尔默医学诊断产品(上海)有限公司
型号、规格:960人份/盒
结构及组成:含氨基酸内标准品、酰基肉碱内标准品、干血斑质控品、V型底耐热微孔板、V型截底透明微孔板、铝箔制微孔板封套、粘性微孔板封套、微孔板条形码标签、特定批号的质量控制证书。
适用范围:本试剂盒用于测量和评估采集到滤纸片上的新生儿干血样中的氨基酸、琥珀酰丙酮、游离肉碱以及酰基肉碱的浓度。
批准日期:2017-01-11
有效期至:2022-01-10
4.琥珀酰丙酮样本前处理液(串联质谱法)
注册证编号:国械注进20183402044
注册人名称:华莱克有限公司
代理人名称:珀金埃尔默医学诊断产品(上海)有限公司
型号、规格:1 小瓶,2.8 mL。
结构及组成:琥珀酰丙酮样本前处理液: 为稀释的含水联氨溶液。
适用范围:本试剂用于体外测量与评估滤纸干血斑样本(DBS)中琥珀酰丙酮浓度试验中的样本处理。
批准日期:2018-05-28
有效期至:2023-05-27
获得CFDA医疗器械认证批准的国产质谱试剂产品:
1. 同型半胱氨酸检测试剂盒(液相色谱-串联质谱法)
注册证编号:沪械注准20182400287
注册人名称:上海美吉逾华生物医药科技有限公司
管理类别:第二类
型号、规格:100人份/盒
主要组成成分:校准品1、2、3:DL-同型半胱氨酸;质控品:DL-同型半胱氨酸;内标液:DL-高胱氨酸-D8;还原剂:1,4-二硫苏糖醇;沉淀剂:三氯醋酸;稀释液:甲醇水溶液。
适用范围:供医疗机构用于对人血清或血浆中总同型半胱氨酸(Hcy)浓度的体外定量检测,作辅助诊断用。
产品储存条件及有效期:1.储存条件:2~8℃避光、密封保存。2.有效期:在2~8℃避光、密封的储存条件下,自试剂盒生产之日起有效期为12个月。试剂盒中各组分开瓶后,可分3次使用,稳定14天,但每次使用后需立即盖紧瓶盖,并置于-20℃保存。
批准日期:2018-08-27
有效期至:2023-08-26
2. 25-羟基维生素D检测试剂盒(液相色谱-串联质谱法)
注册证编号:沪械注准20182400288
注册人名称:上海美吉逾华生物医药科技有限公司
管理类别:第二类
型号、规格:96人份/盒
主要组成成分:校准品1、2、3、4:25(OH)VD2、25(OH)VD3及小牛血清;质控品:25(OH)VD2、25(OH)VD3及小牛血清;内标:25(OH)VD2-d6、25(OH)VD3-d6;稀释液:小牛血清;A液:甲酸、甲醇;B液:甲酸、甲醇;pH调节剂:氢氧化钠。
预期用途:供医疗机构用于对人血清样本中25-羟基维生素D2和25-羟基维生素D3浓度的体外定量检测,作辅助诊断用。
产品储存条件及有效期:⒈在-18℃以下避光、密封的储存条件下,试剂盒自生产之日起有效期为12个月。⒉试剂盒开瓶使用后,在-18℃以下避光、密封的条件下可稳定14天。
批准日期:2018-08-27
有效期至:2023-08-26
3. 1,5-脱水葡萄糖醇检测试剂盒(液相色谱-串联质谱法)
注册证编号:沪械注准20182400289
注册人名称:上海美吉逾华生物医药科技有限公司
管理类别:第二类
型号、规格:100人份/盒
主要组成成分:校准品1、2、3:1,5-脱水葡萄糖醇;质控品:1,5-脱水葡萄糖醇;沉淀剂(含内标):13C6-1,5-脱水葡萄糖醇;稀释液:乙腈;pH调节剂:氨水。
适用范围 :供医疗机构对人血清或血浆样本中1,5-脱水葡萄糖醇浓度的体外定量检测,作辅助诊断用。
产品储存条件及有效期:1..储存条件:2~8℃避光、密封保存。2.在2~8℃避光、密封的储存条件下,试剂盒自生产之日起有效期为12个月。3.试剂盒中各组分开瓶后,可分3次使用,稳定14天,但每次使用后需立即盖紧瓶盖,并置于2~8℃保存。
批准日期:2018-08-27
有效期至:2023-08-26
4. 25-羟基维生素D检测试剂盒(液相色谱-串联质谱法)
注册证编号:沪械注准20192400093
注册人名称:上海复星长征医学科学有限公司
管理类别:第二类
型号、规格:100人份/盒
结构及组成:A液:甲酸、甲醇;B液:甲酸、甲醇;pH调节剂:氢氧化钠;校准品1、2、3、4:25(OH)VD2、25(OH)VD3及小牛血清;质控品1、2:25(OH)VD2、25(OH)VD3及小牛血清;内标:25(OH)VD2-d6、25(OH)VD3-d6;稀释液:小牛血清。
适用范围:供医疗机构用于对人血清样本中25-羟基维生素D2和25-羟基维生素D3浓度的体外定量检测,作辅助诊断用。
批准日期:2019-03-19
有效期至:2024-03-18
5. 2.25-羟基维生素D检测试剂(液相色谱-串联质谱法)
注册证编号:鲁械注准20192400601
注册人名称:质谱生物科技有限公司
型号、规格:96人份/盒
管理类别:第二类
主要组成成分:1瓶低水平质控品:含低水平25-羟基维生素D2、25-羟基维生素D3牛血清白蛋白-磷酸盐缓冲液冻干品;1瓶高水平质控品:含高水平25-羟基维生素D2、25-羟基维生素D3牛血清白蛋白-磷酸盐缓冲液冻干品;校准品1-5各1瓶:含不同浓度的25-羟基维生素D2和25-羟基维生素D3牛血清白蛋白-磷酸盐缓冲液冻干品;1瓶内标品:含d6-25-羟基维生素D2和d6-25-羟基维生素D3的无色固体。
适用范围:用于体外定量检测人血清样本中25-羟基维生素D的含量。
批准日期:2019-05-05
有效期至:2024-05-04
6. 氨基酸和肉碱检测试剂盒(液相色谱-串联质谱法) 更新
注册证编号:国械注准20173403180
注册人名称:华大生物科技(武汉)有限公司
型号、规格:96人份/盒
管理类别:第三类
主要组成成分:流动相缓冲盐:碳酸氢铵(固体纯品);质控品(1-2):甘胆酸;内标:氘代甘胆酸,甲醇;对照品:甘胆酸 ;96孔预处理板;96孔接收板;96孔硅胶盖板;96孔铝箔封板胶。
预期用途:该产品用于定量检测新生儿滤纸干血片样本中8种氨基酸和16种肉碱(具体分析物见附页),检测结果可以辅助临床医生诊断新生儿是否患遗传性代谢病。
备注:本产品用于定量检测新生儿滤纸干血片样本中8种氨基酸和16种肉碱,检测结果可以辅助临床医生诊断新生儿是否患遗传性代谢病。2019年6月21日同意更正注册证备注内容,2017年5月5日核发的中华人民共和国医疗器械注册证予以废止。
产品储存条件及有效期:试剂盒在2℃~8℃条件下避光、密封储存,自试剂盒生产之日起有效期为12个月。
批准日期:2019-07-08
有效期至:2024-07-07
7. 琥珀酰丙酮和氨基酸、肉碱测定试剂盒(串联质谱法)
注册证编号:国械注准20193400493
注册人名称:济南英盛生物技术有限公司
管理类别:第三类
型号、规格:192人份/盒、480人份/盒、1920人份/盒。
主要组成成分:萃取液、流动相、琥珀酰丙酮样本处理液、氨基酸稳定同位素标准品、肉碱稳定同位素标准品、低质控干血斑、高质控干血斑、V-型底96孔微孔板、U-型底96孔微孔板、铝箔封膜、粘性封膜。
适用范围:本试剂盒用于检测新生儿干血斑中氨基酸、游离肉碱、酰基肉碱、琥珀酰丙酮的含量。
批准日期:2019-07-10
有效期至:2024-07-09
8.皮质醇检测试剂(液相色谱-串联质谱法)
注册证编号:鲁械注准20192400601
注册人名称:质谱生物科技有限公司
型号、规格:96人份/盒
管理类别:第二类
主要组成成分:1瓶高水平质控品:含高水平皮质醇的牛血清白蛋白-磷酸盐缓冲液冻干品;1瓶低水平质控品:含低水平皮质醇的牛血清白蛋白-磷酸盐缓冲液冻干品;校准品1-5各1瓶:含不同浓度皮质醇的牛血清白蛋白-磷酸盐缓冲液冻干品;1瓶内标品:含d4-皮质醇的无色固体。
适用范围:用于体外定量检测人血清样本中皮质醇的含量。
批准日期:2019-09-08
有效期至:2024-09-07
9.甘胆酸检测试剂盒(液相色谱-串联质谱法)
注册证编号:浙械注准20172401284
注册人名称:浙江康拓生物科技有限公司
型号、规格:96人份/盒
管理类别:第二类
主要组成成分:流动相缓冲盐:碳酸氢铵(固体纯品);质控品(1-2):甘胆酸;内标:氘代甘胆酸,甲醇;对照品:甘胆酸 ;96孔预处理板;96孔接收板;96孔硅胶盖板;96孔铝箔封板胶。
预期用途:用于体外定量测定人血清中甘胆酸的含量。
产品储存条件及有效期:2~8℃避光干燥密闭保存,12个月
批准日期:2019-10-10
有效期至:2022-12-19
10. 25―羟基维生素D2/D3检测试剂盒(液相色谱―串联质谱法)
注册证编号:粤械注准20192401208
注册人名称:广州可力质谱医疗器械有限公司
型号、规格:96人份/盒、480人份/盒
管理类别:第二类
主要组成成分:25-羟基维生素D2/D3校准品J1、J2、J3、25-羟基维生素D2/D3内标准品溶液、96深孔板与96深孔板盖垫。
适用范围:本产品用于对人血清样本中25-羟基维生素D2、25-羟基维生素D3浓度的定量检测。其检测结果与临床表现和其他实验室数据相结合,用于辅助临床医师评估维生素D状态。
产品储存条件及有效期:1.未开封的试剂盒在-25℃~-18℃的条件下密封保存,有效期12个月。2.试剂盒开瓶使用后,在-25℃~-18℃条件下可保存60天。
批准日期:2019-11-19
有效期至:2024-11-18
11. 25-羟基维生素D检测试剂盒(液相色谱-串联质谱法)
注册证编号:浙械注准20202400042
注册人名称:浙江迪赛思诊断技术有限公司
管理类别:第二类
型号、规格:96人份/盒
主要组成成分:VD-内标液、VD-蛋白沉淀剂、VD-系统适用性溶液、VD-校准品1-5、VD-质控品1、VD-质控品2、赋值证书。
预期用途:该试剂盒供医疗机构用于人血清样本中25-羟基维生素D浓度的体外定量检测。
产品储存条件及有效期:该试剂盒2℃~8℃条件下密封储存,有效期6个月。
批准日期:2020-01-19
有效期至:2025-01-18
12. 25-羟基维生素D检测试剂盒(液相色谱-串联质谱法)
注册证编号:皖械注准20202400021
注册人名称:合肥和合医疗科技有限公司
管理类别:第二类
型号、规格:96人份/盒
主要组成成分:校准品1、2、3、4、5、6 C1、C2、C3、C4、C5、C6 液体 0.5ml×6瓶 含有25-OH-VD3和25-OH-VD2的小牛血清溶液质控品水平1质控品水平2 Q7、Q8 液体 1ml × 2瓶 含有25-OH-VD3和25-OH-VD2的小牛血清溶液内标准品 N9 液体 1.5ml × 1瓶 含有同位素标记的25-OH-VD3 和25-OH-VD2的有机溶剂A液 A10 液体 5ml × 1瓶 含有甲醇、甲酸的溶液B液 B11 液体 8ml × 1瓶 含有甲醇、甲酸、乙酸铵的溶液提取液 T12 液体 20 ml × 1瓶 含有无水乙醇的正己烷溶液复溶液 F13 液体 12ml × 1瓶 含有甲醇、甲酸的水溶液
预期用途:供医疗机构用于对人血清样本中25-羟基维生素D2和25-羟基维生素D3浓度的体外定量检测,作辅助诊断用。
产品储存条件及有效期:本试剂盒在低于-18℃ 条件下,避光、密闭储存,有效期为6个月。试剂盒开瓶后,在2-8℃可稳定7天,在低于-18℃条件下,避光储存,有效期为1个月。质控品和校准品仅可冻融2次。
批准日期:2020-02-11
有效期至:2025-02-10
来源于:仪器信息网
热门评论
最新资讯
新闻专题
更多推荐

















