基于超高效液相色谱-质谱法的肽段分析中非特异性吸附评估及通用型最小化策略
导读:开发多肽的生物分析方法是极具挑战的,除了所需的低检出限外,多肽的非特异性吸附性质,使其极易在接触到的材料表面发生吸附,进而导致分析全流程中待测物的丢失或干扰,给定性和定量分析引入巨大风险。
近年来,蛋白质组学技术在肽和蛋白质类新型治疗药物的蓬勃发展以及临床新型大分子生物标志物的深入发掘中被日益广泛应用。应用方式的迭代对生物大分子的分析技术提出了更高的要求。
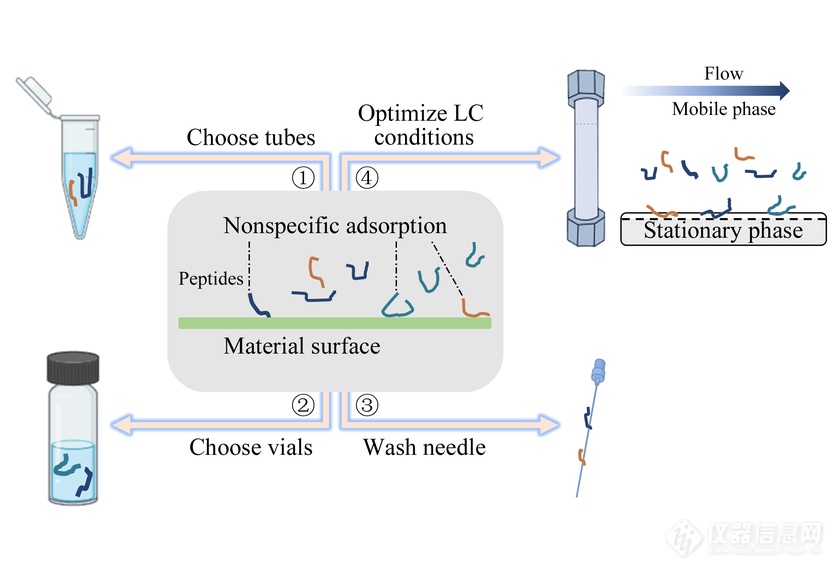
基于蛋白质特征肽段检测的自下而上的蛋白质组学技术(bottom up proteomics)是现有研究中具有较高灵敏度与分辨率的蛋白质定性定量方法。开发多肽的生物分析方法是极具挑战的,除了所需的低检出限外,多肽的非特异性吸附性质,使其极易在接触到的材料表面发生吸附,进而导致分析全流程中待测物的丢失或干扰,给定性和定量分析引入巨大风险。
例如在蛋白组学研究的质谱数据库搜索中,即使系统中微量肽段的损失或残留亦可能导致假阳性或假阴性结果。而在高灵敏度的多肽定量方法的开发中,肽段的非特异吸附对定量分析的线性、准确度和精密度均有负面影响。低浓度肽段溶液的吸附性质会更加明显,表现形式为标准曲线的非线性,最终导致定量限的不必要升高以及方法的重复性差。
已有一些研究在分子水平上解释这种吸附行为,然而目前对其潜在的机制和相互作用仍然知之甚少。Eeltink等基于分子动力学模拟,提出了一种三相分子机制解释肽段从溶液吸附到强相互作用不带电固定相上的原理。Kristensen等研究了样品容器对阳离子多肽吸附的影响,当1 μmoL/L肽溶液在硼硅酸盐或聚丙烯瓶中存储1 h后,肽段的回收率仅有10%~20%。也有研究通过在溶剂中添加有机试剂、酸/碱性溶液、表面活性剂、吸附竞争剂或调整流动相组成等方法减少这类吸附。这些研究论文大多对一组特定的多肽和/或表面材料进行研究,但均未给出可用来预测多肽吸附特性的规律,也未给出通用的解决吸附的方法。
本研究选择牛血清白蛋白(BSA)作为模型蛋白质,以其酶解后的肽段作为包含亲水性和疏水性多肽的“典型”多肽组样本。首先通过超高效液相色谱-高分辨质谱(UPLC-HRMS)的测定,分析常见多肽理化参数与上述多肽组的非特异吸附程度的关联性。然后基于超高效液相色谱-三重四极杆质谱(UPLC-QQQ-MS/MS)建立对强吸附肽段吸附程度的评估方法,从样品制备至分析测定建立全过程试验设计,考察不同材质的制备、储存耗材对肽段吸附的影响,以及考察不同色谱条件对肽段残留的影响,最终提出多肽全流程分析中减少非特异性吸附的通用型策略。
01样品制备方法
取10 mg BSA溶于10 mL水中,制得1 mg/mL蛋白储备液,进一步以水稀释为100 μg/mL的工作液。取200 μL上述工作液于蛋白质低吸附离心管中;加入65 μL 500 mmol/L碳酸氢铵和60 μL 50 mmol/L二硫苏糖醇,于60 ℃水浴加热60 min对蛋白质进行还原;放冷至室温后加入120 μL 50 mmol/L碘代乙酰胺,于暗处反应30 min进行烷基化;加入100 μg/mL的胰蛋白酶5 μL,于37 ℃水浴中酶解8 h,加入甲酸20 μL终止反应,12000 g离心15 min后,取200 μL上清置于蛋白质低吸附的进样瓶中作为混合肽段溶液待测。
02超高效液相色谱-高分辨质谱方法参数
色谱条件:色谱柱采用Waters Acquity Premier Peptide CSH C18(100 mm×2.1 mm, 1.7 μm);柱温为40 ℃;流速为0.25 mL/min;流动相A、B两相分别为0.1%甲酸水溶液和0.1%甲酸乙腈溶液。洗脱梯度为0~1 min, 1%B; 1~13 min, 1%B~40%B; 13~13.1 min, 40%B~90%B; 13.1~16 min, 90%B; 16~16.1 min, 90%B~1%B; 16.1~20 min, 1%B。进样器温度10 ℃;进样量5 μL。
质谱条件:毛细管电压3 kV,锥孔电压30 V,离子源温度120 ℃,脱溶剂气温度450 ℃,锥孔气流速25 L/h,脱溶剂气流速800 L/h。电喷雾电离(ESI)源、正离子模式下测定,MSE模式采集,扫描范围m/z 50~2000;数据采集时使用亮氨酸脑啡肽校正液进行实时质量校正,以保证采集质量数的准确性与重复性。采集后的数据使用Unifi软件处理。
03相对残留量的测定和肽段分级策略
将上述混合肽段溶液经上述条件采集、Unifi软件分析后,可得BSA酶解后肽段组的实际肽段组成和每个肽段的响应值Area(供试品溶液)。
在进样上述供试品溶液后连续进样3针空白溶剂,以3针空白溶剂中检测到的对应肽段响应之和Area(Blank 1+Blank 2+Blank 3)计为该肽段的残留总量,该肽段的相对残留量为肽段的残留总量与肽段响应值的比值。
基于肽段的响应与相对残留量,可将BSA酶解后的肽段组分为如下四类:Class Ⅰ,响应高且无残留的肽段;Class Ⅱ,响应高但有残留的肽段;Class Ⅲ、Class Ⅳ分别为响应低,无吸附和有吸附的肽段。响应的高低以是否大于中位数计,有无残留以Area(Blank 1+Blank 2+Blank 3)是否有检出判断。
04超高效液相色谱-三重四极杆质谱方法参数
色谱条件:色谱柱采用Waters ACQUITY UPLC BEH C8(100 mm×2.1 mm, 1.7 μm);柱温30 ℃;流速0.4 mL/min;流动相A、B两相分别为0.2%甲酸水溶液和0.2%甲酸乙腈溶液。洗脱梯度为0~2 min, 2%B; 2~5 min, 2%B~60%B; 5~5.1 min, 60%B~90%B; 5.1~8 min, 90%B; 8~8.1 min, 90%B~2%B; 8.1~11 min, 2%B。进样器温度10 ℃;进样量5 μL。洗针液为90%乙腈水溶液(含0.2%甲酸)。
质谱条件:离子化电压5500 V;气帘气压力0.14 MPa;离子源温度500 ℃;喷雾气、辅助加热气压力0.38 MPa。ESI源正离子模式下测定,多反应监测(MRM)模式采集,12条Class Ⅱ类肽段的离子对、碰撞能量(CE)、去簇电压(DP)值经Skyline软件协助优化后结果如原文表1所示。
文章信息
色谱, 2022, 40(7): 616-624DOI: 10.3724/SP.J.1123.2021.12012
张莹1,2, 杨静1,2, 马跃新1,2, 曹玲2*, 黄青2*
1.南京中医药大学药学院, 江苏 南京 210023
2.江苏省食品药品监督检验研究院, 国家药品监督管理局化学药杂质谱研究重点实验室, 江苏 南京 210019
来源于:色谱期刊
热门评论
最新资讯
新闻专题
更多推荐