湖北大学首篇!3 所高校齐发 Nature
导读:近日,浙江大学、湖北大学和中国科学技术大学分别在国际顶级学术期刊Nature 刊发研究成果。其中,湖北大学首次以通讯单位发Nature。
近日,浙江大学、湖北大学和中国科学技术大学分别在国际顶级学术期刊Nature 刊发研究成果。其中,湖北大学首次以通讯单位发Nature。
浙江大学 & 湖北大学
生长素是最重要的植物激素,主要合成部位是芽、幼嫩的叶和发育中的种子,通过极性运输分配到植物各处组织,调控生长发育——低浓度生长素促进生长,高浓度生长素抑制生长。生长素的极性运输对生长素的分配至关重要。那么,生长素极性运输是如何实现的呢?
近日,浙江大学医学院生物物理系长聘副教授 / 附属第四医院双聘教授郭江涛指导的浙江大学 - 湖北大学联合研究团队阐明了生长素转运蛋白 PIN 介导生长素极性运输的分子机制。这项工作于北京时间 8 月 2 日刊登在国际顶级期刊Nature上。该成果作为植物生长素极性运输研究的重大突破,解决了植物向性这一个百年科学难题中的关键一环,为人们进一步调控生长素极性运输奠定了基础。湖北大学与浙江大学为本文共同通讯单位。

研究人员利用单颗粒冷冻电镜技术,解析了拟南芥 PIN3(AtPIN3)在未结合配体(AtPIN3apo)和结合 IAA(AtPIN3IAA)两种状态的高分辨率结构。通过结构解析发现 AtPIN3 以二聚体形式存在,每个亚基包含 10 个跨膜螺旋(TM1 – 10),TM1 – 5 和 TM6 – 10 组成反向重复结构(图 2a)。AtPIN3apo 与 AtPIN3IAA 结构类似,且均为向内开放状态。AtPIN3 单体由支架结构域(scaffold domain)和转运结构域(transport domain)组成。在 AtPIN3IAA 结构中,IAA 结合在支架结构域和转运结构域之间的内向开放口袋中(图 2b),与多个保守的氨基酸发生氢键和疏水相互作用(图 2c)。
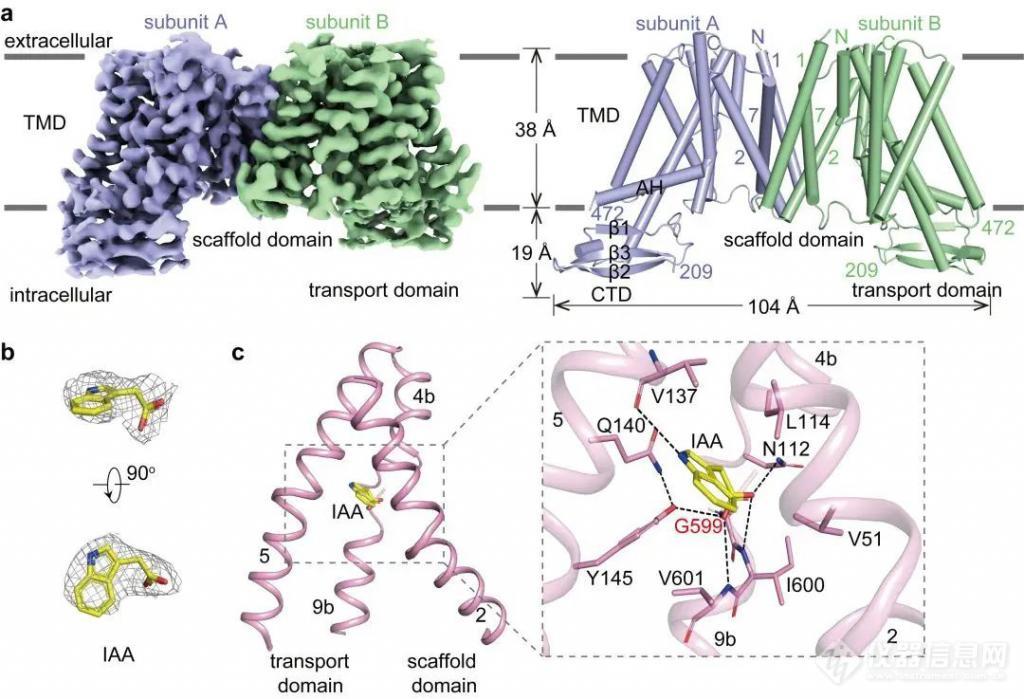
图 2. AtPIN3IAA 结构。
a. AtPIN3IAA 的密度图和结构图。
b. IAA 的密度图。
c. AtPIN3IAA 结构中 IAA 的结合位点。
该研究解析了 3 个 AtPIN3 高分辨率电镜结构,明确了底物 IAA 和抑制剂 NPA 与 AtPIN3 的结合模式。这项工作不仅阐明了人们长久以来期待的 PIN 介导生长素转运的分子机制,而且将有助于进行作物改良,指导新型 PIN 抑制剂的开发。这些抑制剂既可作为生长素极性运输机理研究的工具,也可作为农业除草剂,具有广泛的应用前景。
该工作是由浙江大学、湖北大学和天津大学的多个实验室联合完成。浙江大学医学院郭江涛组博士后苏楠楠、杨帆组博士生竺爱琴和湖北大学生命科学学院吴姗组博士生陶鑫为论文的共同第一作者,郭江涛、吴姗和杨帆为共同通讯作者。参与这项工作的还有浙江大学生命科学学院郑绍建教授和丁忠杰研究员、浙江大学冷冻电镜中心常圣海老师、浙江大学农业与生物技术学院郭逸蓉老师和张素芬老师、天津大学生命科学学院叶升教授和湖北大学生命科学学院马立新教授。
中国科学技术大学
8 月 2 日,中国科学技术大学生命科学与医学部孙林峰教授团队在Nature 杂志上发表了题为 "Structural insights into auxin recognition and efflux byArabidopsisPIN1" 的研究论文,报道了植物中生长素极性转运蛋白 PIN1 单独的(apoform),与底物生长素结合的(IAA-bound),以及与抑制剂 NPA(N-1-naphthylphthalamic acid,又名抑草生)结合的(NPA-bound)三个高分辨率结构,并结合功能实验阐释了 PIN1 蛋白的工作机制,为理解植物生长素运输调控、以及针对 PIN 蛋白的农业用除草剂和植物生长调节剂的设计开发提供了重要基础。

该研究揭开了植物经典 PIN 家族蛋白的结构面纱,系统阐释了 PIN1 识别底物生长素 IAA 以及被 NPA 抑制的分子机制,为我们深入理解植物生长素极性运输过程提供了重要帮助,也为基于靶向该家族蛋白的小分子抑制剂设计奠定了基础,对于指导农业应用具有重要意义。
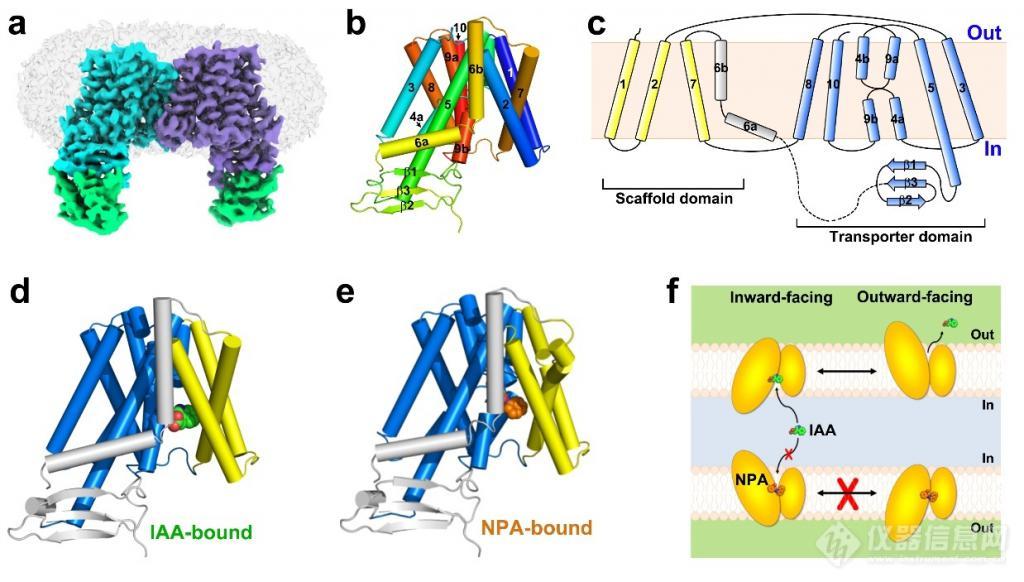
图 1. 拟南芥 PIN1 蛋白三种状态下的结构和转运机制示意图。
中国科学技术大学生命科学与医学部杨智森、夏婧,以及中科院分子细胞科学卓越创新中心洪晶晶为该论文共同第一作者,中国科学技术大学生命科学与医学部刘欣副研究员、孙林峰教授为共同通讯作者,中科院分子细胞科学卓越创新中心李典范研究员、奥地利科学技术研究院 Ji í Friml 教授、中国科学技术大学生命科学与医学部谭树堂教授及中科大冷冻电镜中心高永翔博士均参与了该项研究工作。
该工作得到了中国科学院战略性先导科技专项基金(B 类)、国家自然科学基金、安徽省自然科学基金、中央高校基础科研业务费专项资金及中国科学技术大学统筹推进世界一流大学和一流学科建设专项资金等项目的资助,以及教育部无膜细胞器与细胞动力学重点实验室、合肥微尺度物质科学国家研究中心、生物医学与健康安徽省实验室的大力支持。冷冻电镜数据收集工作在中科大冷冻电镜中心和生物物理所生物成像中心完成。
新闻来源:浙江大学、湖北大学、中国科学技术大学
来源于:美辑科研
热门评论
最新资讯
新闻专题
更多推荐