高灵敏Top-down蛋白组学方法捕获单个肌肉细胞的proteoforms异质
导读:作者在此对单个肌细胞进行了高灵敏的Top-down蛋白质组学分析,探究单细胞层面的结构和功能异质性,以期建立细胞类型和proteoforms间的直接关联。
大家好,本周为大家分享一篇发表在PNAS上的文章:High sensitivity top–down proteomics captures single muscle cell heterogeneity in large proteoforms [1],文章的通讯作者是威斯康星大学麦迪逊分校的葛瑛教授。
单细胞研究表明,即使是具有相同形态和遗传的细胞,其生理功能特性可能也存在较大差异。近年来,基于质谱的单细胞蛋白组学策略逐渐发展成研究细胞异质性的重要技术,但也面临着细胞的蛋白质含量有限和动态范围宽,以及存在proteoforms高度复杂等挑战。
得益于肽段易分离、电离和碎裂的特性,目前几乎所有基于质谱的单细胞蛋白组学分析都采用“Bottom-up”的研究思路,但会丢失蛋白质序列变异和翻译后修饰(PTMs)等信息。“Top-down”的蛋白组学通过分析完整蛋白质来避免这些信息的丢失,尽管质谱信噪比会随着分子量的增加而呈指数衰减,其灵敏度也不如“Bottom-up”,但它非常适合用于proteoforms的鉴定,是解析细胞异质性层面的理想方法。因此,作者在此对单个肌细胞进行了高灵敏的Top-down蛋白质组学分析,探究单细胞层面的结构和功能异质性,以期建立细胞类型和proteoforms间的直接关联。
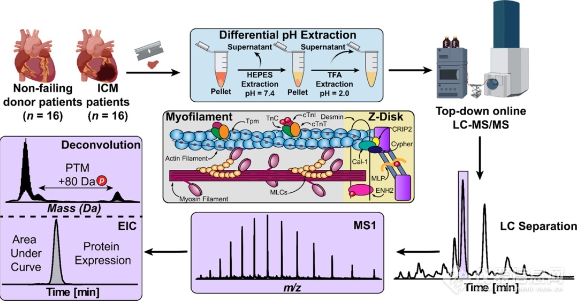
在本工作中,作者分别以大鼠股外侧肌(VL)、足底肌(PLN)和比目鱼肌(SOL)的单个肌细胞(SMFs)为研究对象,使用优化过的裂解和冻融方法来保证蛋白的高提取率,最大程度减少吸附性蛋白质的损失,最后基于微流多通道纳电喷雾源(MnESI)对完整蛋白进行LC-MS/MS分析。
其中,VL和SOL组织分别主要由快缩肌细胞和慢缩肌细胞构成,PLN组织则包含这两类肌细胞,平均最大收缩速度测定结果显示VL和PLN中的SMFs收缩速度存在更大的异质性,如图1B所示。Top-down结果也表明在VL和PLN中主要包含快缩型骨骼肌钙蛋白复合物(fsTnT、fsTnI和fsTnC)、α-原肌球蛋白(α-Tpm)和快缩型骨骼肌球蛋白轻链(MLC-1F、MLC-2F和MLC-3F),而在SOL中则检测到慢缩型骨骼肌钙蛋白复合物(ssTnT、ssTnI和ssTnC)、β-原肌球蛋白(β-Tpm)和慢缩型骨骼肌球蛋白轻链(MLC-1S、MLC-1V和MLC-2S),这表明不同类型SMFs独特的功能特征与其proteoform异质性相关(图1C-1D)。值得注意的是,这里能够准确鉴定到分子量>30 kDa的proteoforms,比如α-sActin(42 kDa)和MyHC亚型(223 kDa),说明Top-down方法可以实现对单个肌细胞水平的完整肌节proteoforms的检测。
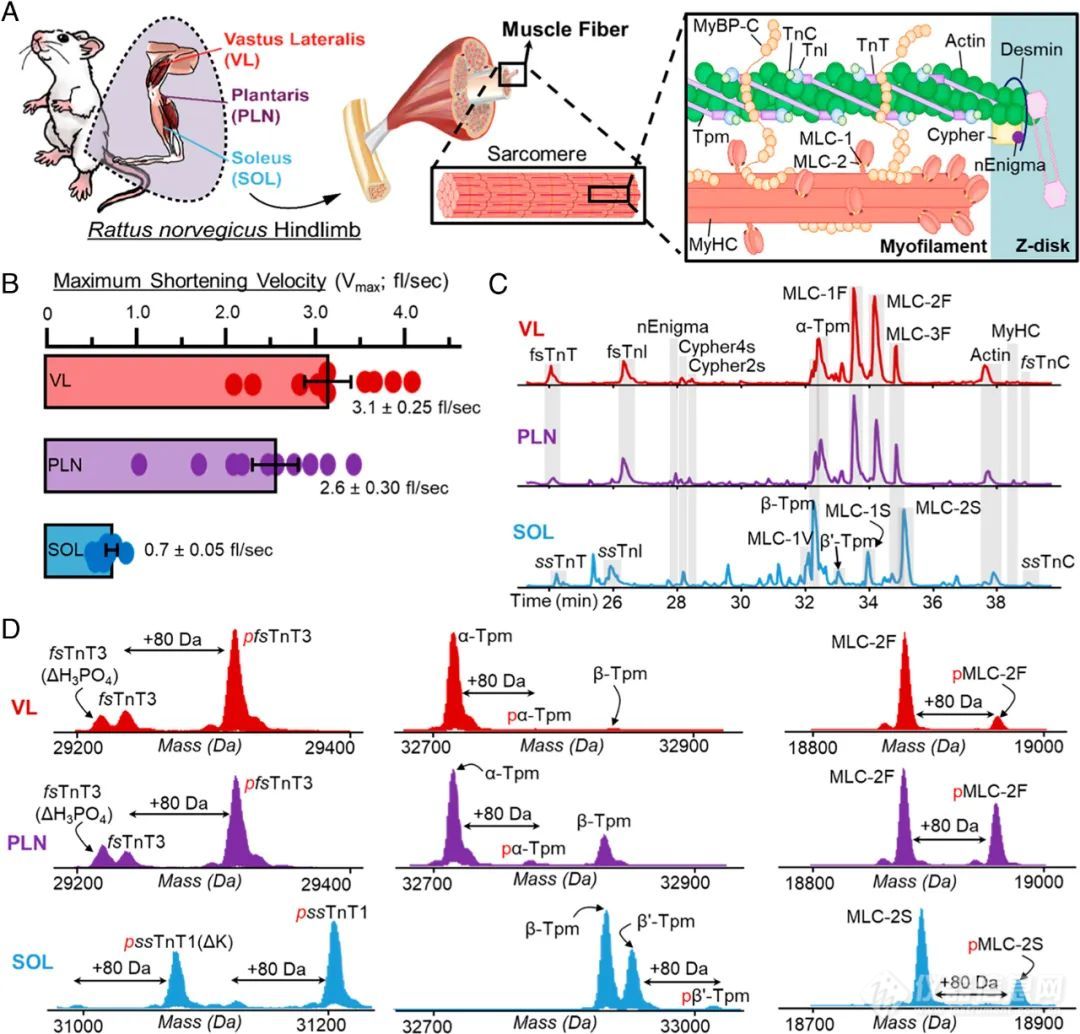
图1.(A)大鼠骨骼肌结构示意图;(B)3种肌肉组织(VL、PLN和SOL)中SMFs收缩速度的测量(n = 10);(C)VL、PLN和SOL组织SMFs中的主要肌节proteoforms(n=6);(D)代表性的去卷积质谱图,红色p表示单磷酸化,“△H3PO4”表示pfsTnT3丢失磷酸盐,“-k”表示ssTnT1或pssTnT1赖氨酸残基的丢失。
肌球蛋白重链(Myosin heavy chain,MyHC)是一种为肌肉收缩和力产生提供能量的分子马达蛋白,具有多种分子量约为223 kDa的蛋白亚型。它们有超过80%的序列同源性,因而很难通过“Bottom-up”的策略去检测和定量。MyHC1、MyHC2、MyHC4和MyHC7是大鼠骨骼肌中主要存在的四种MyHC亚型,其中MyHC7和MyHC4分别是SOL和VL组织中的主要亚型,而PLN组织中主要含有MyHC1、MyHC2和MyHC4,此处检测结果与之相符,如图2所示。
与SOL和VL相比,PLN来源的SMFs在最大收缩速度上存在更大差异也印证了一个事实,即多种MyHC亚型在PLN组织中表达,这有助于依据MyHC亚型的表达对SMFs类型进行区分。此外,MyHC亚型在各样本中的质量偏差不超过2 Da,表明该检测方法在单个肌细胞水平上具有高灵敏性。
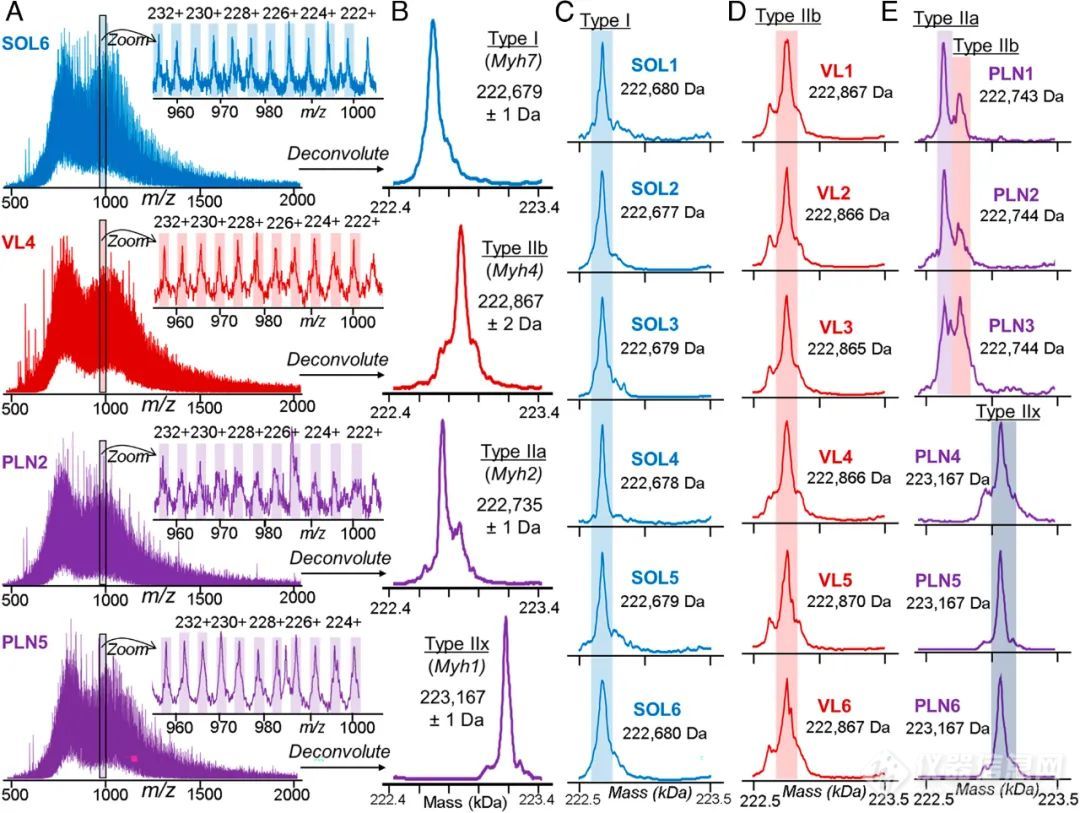
图2. MyHC亚型的检测(A-B)VL、PLN和SOL组织中MyHC的电荷肽分布和去卷积谱图;(C-E)VL、PLN和SOL组织中对应的MyHC亚型(n=6)。
除了蛋白亚型的鉴定,作者也利用Top-down蛋白组学技术实现对蛋白质PTMs的鉴定,例如对fsTnT的检测,如图3所示。快缩型骨骼肌钙蛋白复合物(fsTnT)具有高度序列同源性,它的表达丰度较低,通过传统Bottom-up策略检测是非常具有挑战性的。如图3A所示,在VL和PLN组织中检测到了fsTnT3的几种高丰度proteoforms,包括单磷酸化的fsTnT3(pfsTnT3)、fsTnT3和丢失磷酸盐的pfsTnT3(△H3PO4)。fsTnT3在VL和PLN两组中的表达水平和总磷酸化水平都相似(图3C-图3D)。
需要注意的是,进一步放大谱图时可以观察到几种低丰度和肌细胞特异性fsTnT的存在,比如在两组中都检测到的fsTnT4,其总磷酸化在PLN组织中具有更大的表达差异,如图3B所示。此外,Top-down方法也可对两种分子量相差26 Da的Tpm亚型(β-Tpm和β’-Tpm)进行区分。这些结果充分表明Top-down蛋白组学技术适合用于单个肌肉细胞亚型和PTMs的研究。
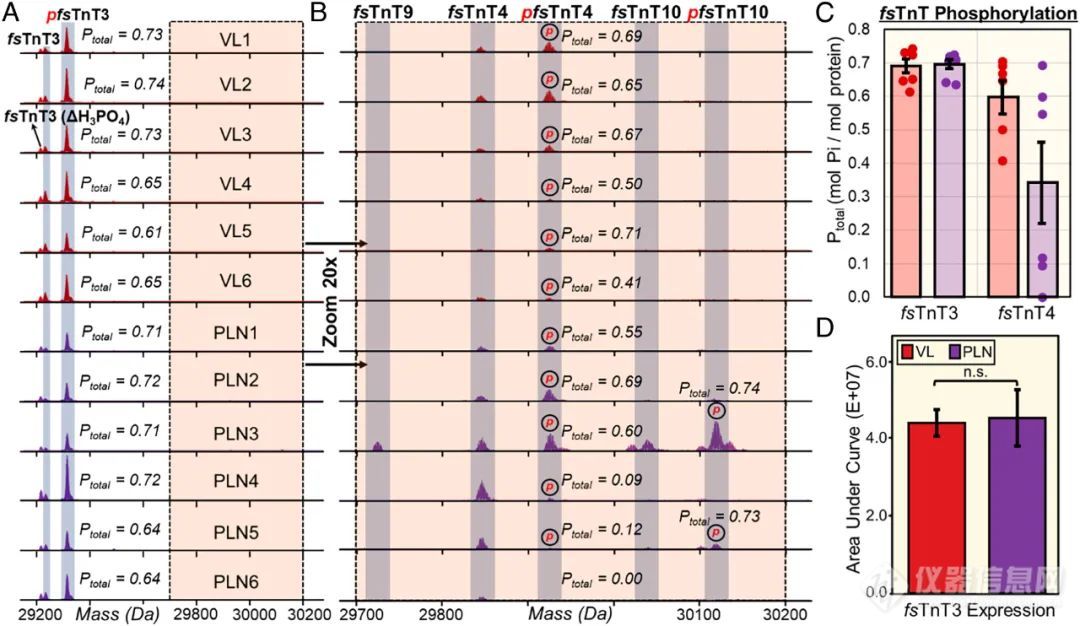
图3.磷酸化fsTnT的检测(A)fsTnT3在VL(红色)和PLN(紫色)中的去卷积谱图,红色p表示单磷酸化,“△H3PO4”表示pfsTnT3丢失磷酸盐;(B)A图中29700-30200 Da区域的放大图;(C)fsTnT3和fsTnT4的总磷酸化表达(n=6);(D)fsTnT3的表达(n=3),p<0.05表示两组具有统计学差异,“n.s”表示两组无统计学差异。
作者也发现一些蛋白亚型在不同类型SMFs中呈现出显著的proteoform异质性。例如,MLC-2亚型,它可以分为MLC-2F(快缩型)和MLC-2S(慢缩型),两者序列相似,但具有不同的生理功能,可以通过在线LC-MS/MS将其分离(图4D)。其中,MLC-2F和pMLC-2F在VL和PLN中检测到,而MLC-2S和pMLC-2S在SOL中检测到(图4A-4C),但MLC-2亚型在PLN和SOL组中的总磷酸化水平具有更大的表达差异(图4E)。这些表达差异在对全骨骼肌样品的Top-down组学分析中常被平均化,表明Top-down方法有助于SMFs水平上的肌节proteoforms异质性的研究。
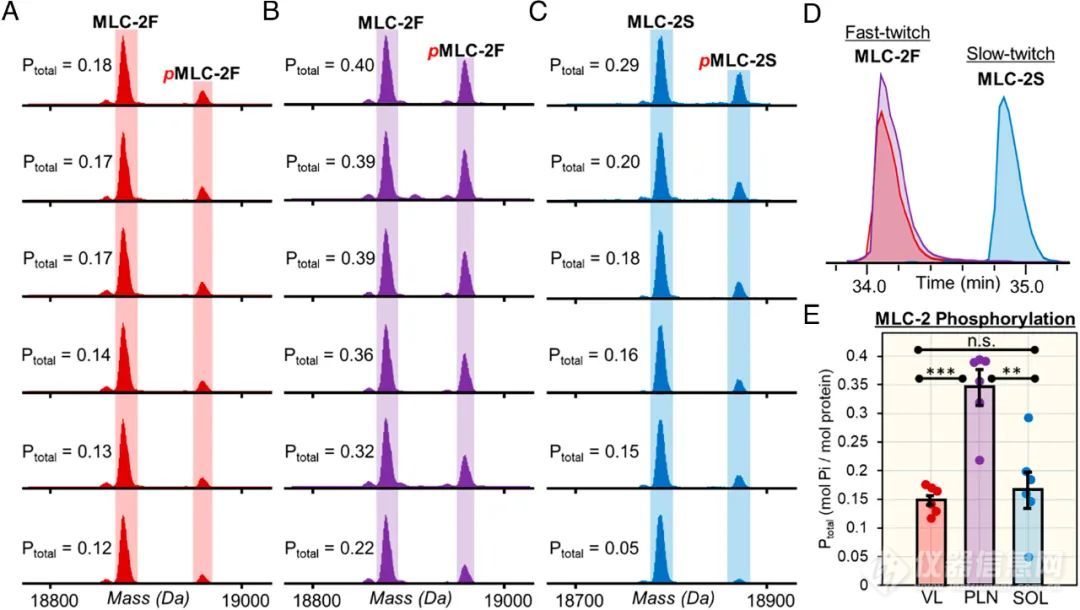
图4.磷酸化MLC-2亚型的检测(A-C)MLC-2F和MLC-2C在VL、PLN和SOL组中的EIC谱图;(D)MLC-2F在三组中的去卷积谱图;(E)MLC-2F和MLC-2C在三组中的总磷酸化表达(n=6),p<0.05表示两组具有统计学差异,“n.s”表示两组无统计学差异。
最后,作者以MLC-1亚型序列比对为例,展示了Top-down蛋白组学技术在单细胞proteoform鉴定和表征上的分析能力。SOL组织来源的SMFs有两种MLC-1亚型:MLC-1S和MLC-1V,而PLN和VL来源的SMFs只有MLC-1F这一亚型,LC-MS/MS分析可将这三种具有高度同源性的亚型分离开(图5A-5B)。MLC-1亚型一级谱图具有高质量准确性和清晰的同位素分布,如图5C-5E所示,它们的二级碎裂产生一些特异性的b/y离子,可以很好地表征一些亚型和PTMs(如N末端修饰、乙酰化和二甲基化)。
此外,作者也对一些重要的肌节蛋白进行了表征,例如TnT、TnI、Tpm和Z盘蛋白(>30 kDa)。尽管它们的二级碎裂率不高(5.8%-25.2%),但可以产生一些覆盖全长序列的b/y离子,进而实现较大proteoforms的鉴定,表明Top-down蛋白组学方法是表征SMFs蛋白的有利手段。
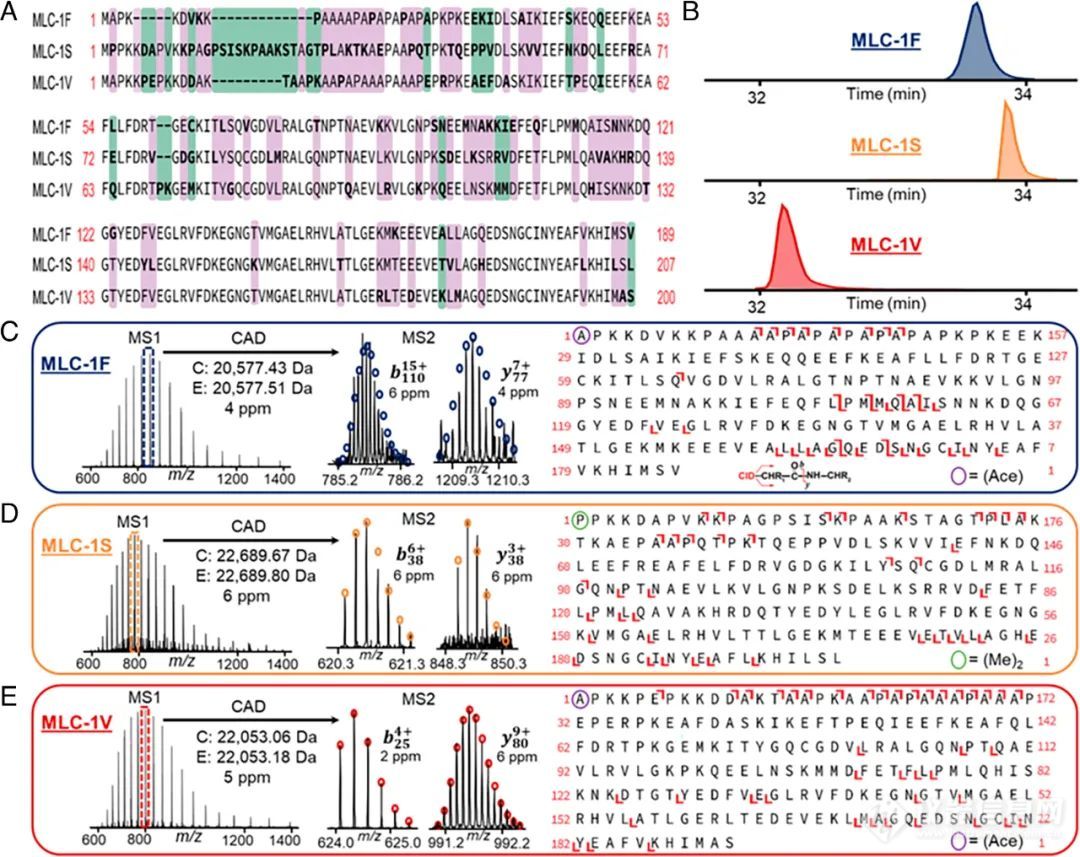
图5.MLC-1亚型的表征(A)MLC-1F、MLC-1S和MLC-1V的序列比对,紫色表示亚型间至少共享一个残基,绿色表示亚型间没有共享残基,无颜色表示亚型间序列同源;(B)MLC-1亚型代表性的EIC谱图;(C-E)MLC-1亚型的CAD碎裂,“Ace”表示Nα-乙酰化,“(Me)2”表示Nα-二甲基化。
总的来说,作者开发了一种Top-down的蛋白质组学策略,其结合了一锅法样品制备和高灵敏的毛细管LC-MS/MS分析,可用于在功能和蛋白质组上具有显著异质性的SMFs的proteoform分离和表征。不同类型SMFs的异质性在肌节proteoforms中得以反映,在其中鉴定到的MyHC亚型(>220 kDa)可以用于单细胞水平上的肌细胞分类。更为重要的是,本研究表明Top-down组学方法对于复杂肌节体系PTMs和亚型表征方面的独特优势,强调了其在关联单细胞表型异质性和功能多样性间的应用潜力,希望可以将该方法拓展到其它有高灵敏需求的场景。
撰稿:陈昌明
编辑:李惠琳
文章引用:High sensitivity top-down proteomics captures single muscle cell heterogeneity in large proteoforms
李惠琳课题组网址www.x-mol.com/groups/li_huilin
参考文献
Melby, J. A., Brown, K. A., Gregorich, Z. R., et al. High sensitivity top-down proteomics captures single muscle cell heterogeneity in large proteoforms. PNAS., 2023, 120(19), e2222081120. DOI https://doi.org/10.1073/pnas.2222081120
来源于:仪器信息网
热门评论
最新资讯
新闻专题
更多推荐