仪器表征,科学家开发新型纳米药物,用于治疗动脉粥样硬化!
导读:靶向肽修饰的黑磷纳米治疗剂(BPNSs@PEG-S2P/R)通过有效清除ROS、抑制炎症,显著减少斑块面积,增强抗动脉粥样硬化效果,展现为治疗动脉粥样硬化的创新策略。
【科学背景】
动脉粥样硬化是一种以动脉斑块逐渐沉积为特征的疾病,最终可能导致严重的动脉血栓事件。因此,抗炎策略在临床治疗中显现出巨大的潜力。近来,Canakinumab抗炎血栓结果研究(CANTOS)临床试验对约10,000名心肌梗死后患者进行了研究,结果显示,使用Canakinumab(一种中和促炎性IL-1β细胞因子的单克隆抗体)的治疗显著减少了心血管事件的发生。然而,这一疗法也增加了致命感染的风险,主要是因为中性粒细胞减少,宿主防御能力受到削弱。另一个临床试验,心血管炎症减少试验(CIRT),则表明低剂量甲氨蝶呤的系统治疗未能有效减少促炎细胞因子的表达或心血管事件。这些结果提示,若能将治疗药物有效地递送至动脉壁病变区域,将可能显著提高疗效并减少副作用。
此外,病灶巨噬细胞中过量的活性氧(ROS)是促进动脉粥样硬化进展的另一个关键因素。ROS过量产生会增加氧化应激,导致细胞凋亡并激活炎症反应。由于炎症在动脉粥样硬化过程中引起ROS的过量生成,因此尽管具有挑战性,但同时解决炎症和抑制病灶ROS生成的治疗策略对于动脉粥样硬化的管理具有重要意义。虽然一些纳米治疗剂在临床前研究中显示出双重治疗功能,但其在疾病部位的低积累、复杂的合成路线和潜在的毒性问题仍然是临床转化的障碍。因此,迫切需要合成具有抗氧化和抗炎功能并且能在疾病部位高效积累的生物相容性纳米材料。
为此,科学家们将研究目光投向了二维(2D)黑磷纳米片(BPNSs)。由于其独特的物理化学特性和优异的生物相容性,BPNSs在纳米医学领域得到了广泛研究。最近的一项临床前研究表明,BPNSs可以有效清除过量的ROS,改善急性肾损伤。
基于这一发现,四川大学华西医院宋相容课题组和哈佛大学医学院的陶伟、Wei Chen合作开发了具有良好生物相容性和高病灶巨噬细胞积累能力的靶向BPNS纳米治疗剂。与传统的纳米载体递送药物策略不同,作者采用了一种创新的“纳米药物递送药物”方法,用于治疗动脉粥样硬化。具体而言,作者利用BPNSs的药物携带能力,将解决炎症的脂质介质Resolvin D1(RvD1)加载其中。RvD1负载的BPNSs不仅能够清除周围的ROS,且在病灶巨噬细胞中选择性地释放RvD1,从而在载脂蛋白E缺乏(Apoe−/−)小鼠的动脉粥样硬化模型中增强抗动脉粥样硬化效果。

【科学亮点】
(1)实验首次开发了靶向肽修饰的黑磷纳米治疗剂(BPNSs@PEG-S2P/R),旨在解决动脉粥样硬化治疗中的挑战。
(2)实验通过将2D PEGylated BPNSs结合S2P靶向肽和抗炎药物RvD1,成功实现了以下几点结果:
• BPNSs@PEG-S2P/R能有效积聚于动脉粥样硬化斑块的病灶巨噬细胞,并在S2P肽的协助下渗透斑块。
• 药物RvD1在ROS响应性释放的方式下,被有效递送至病灶巨噬细胞,展现出显著的抗炎效果。
• BPNSs@PEG-S2P/R不仅能同时清除ROS,还能抑制病灶巨噬细胞中ROS诱导的炎症反应。
• 在Apoe−/−小鼠模型中,BPNSs@PEG-S2P/R显著减少了斑块面积,并提高了斑块的稳定性。
• 在动脉粥样硬化斑块中,BPNSs@PEG-S2P/R能有效抑制巨噬细胞负担、炎症反应和氧化应激。
• 长期治疗后,BPNSs@PEG-S2P/R未引起小鼠免疫或毒性不良反应。
【科学图文】
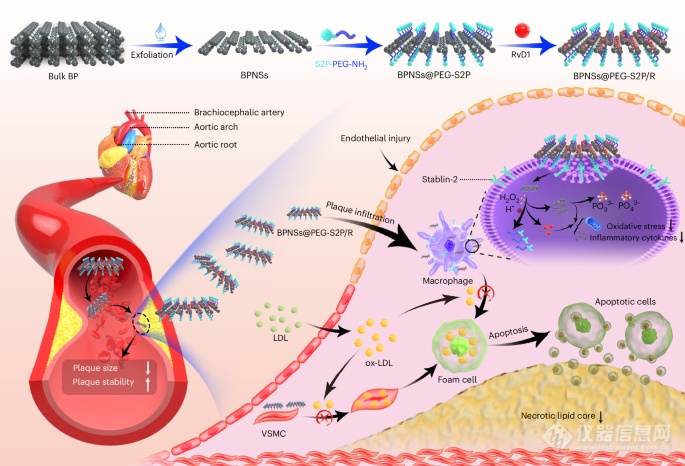
图1:BPNSs@PEG-S2P/R的合成策略和抗动脉粥样硬化机制示意图。
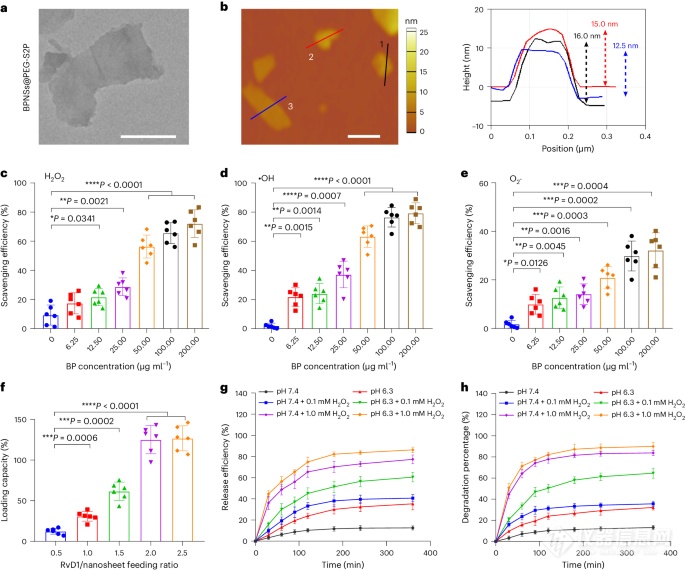
图2:BPNSs@PEG-S2P/R的表征及RvD1负载和释放研究。
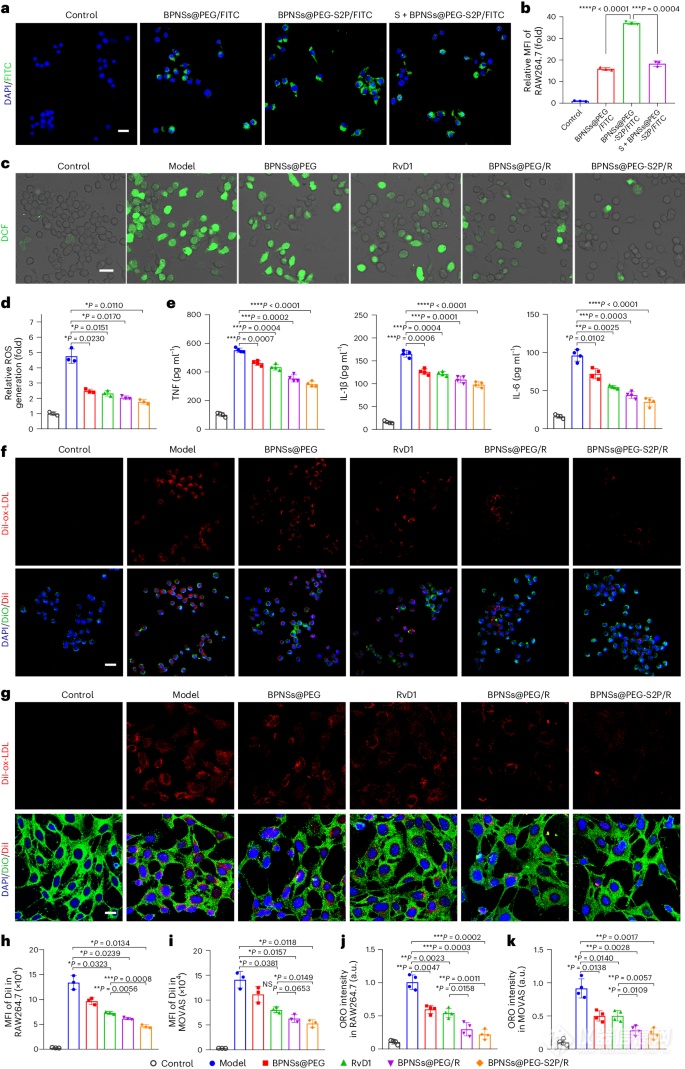
图3:BPNSs@PEG-S2P/R处理后细胞摄取、ROS清除能力、抗炎效果、氧化低密度脂蛋白摄取和泡沫细胞形成的体外分析。
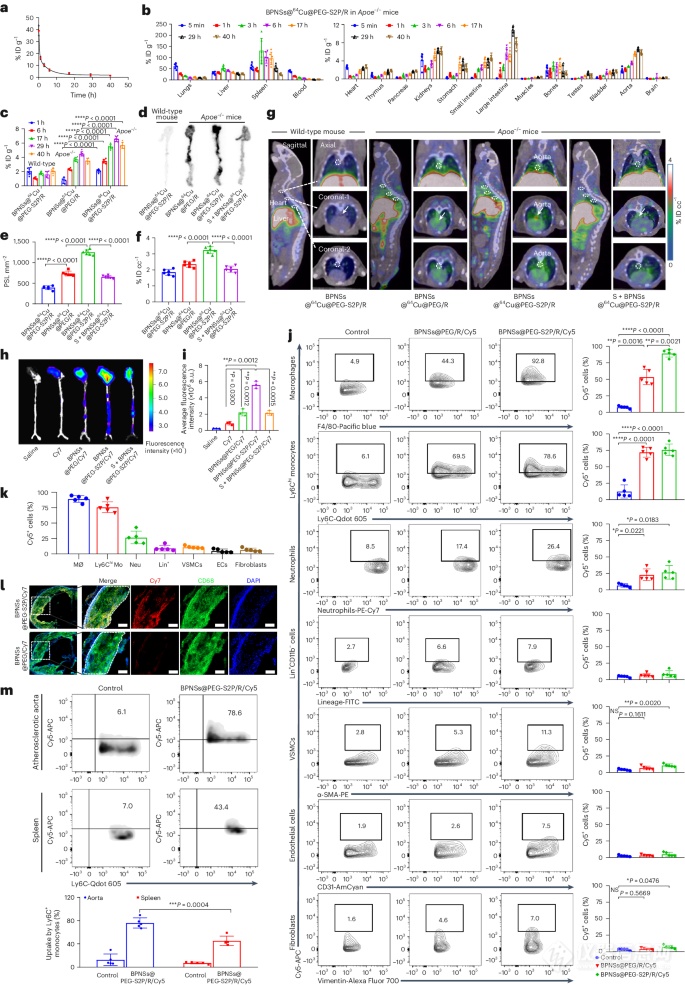
图4:BPNSs@PEG-S2P/R的药代动力学和生物分布。
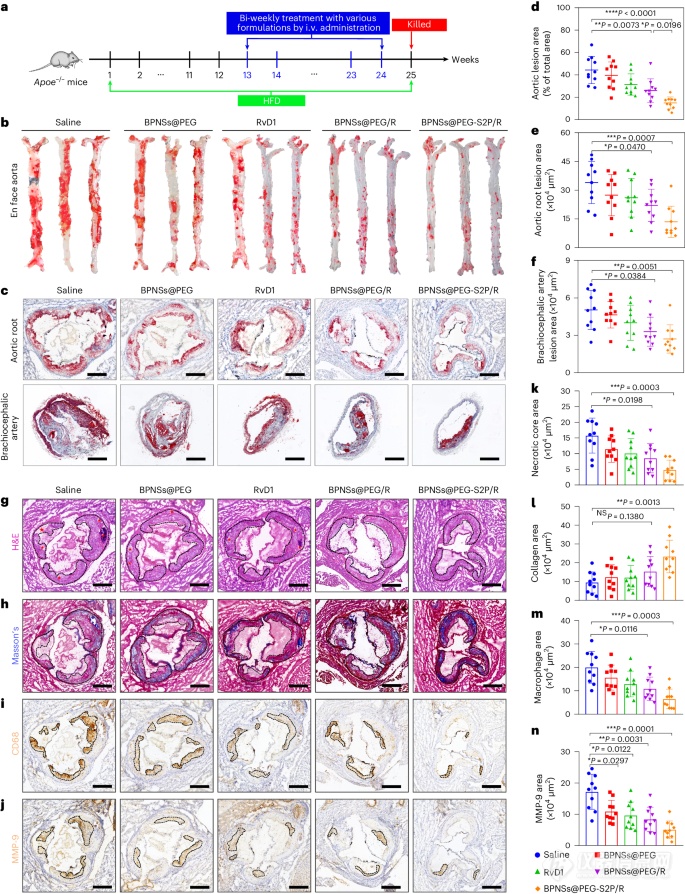
图5:通过量化病变面积和评估斑块稳定性特征,评估BPNSs@PEG-S2P/R在Apoe−/−小鼠中的抗动脉粥样硬化效果。
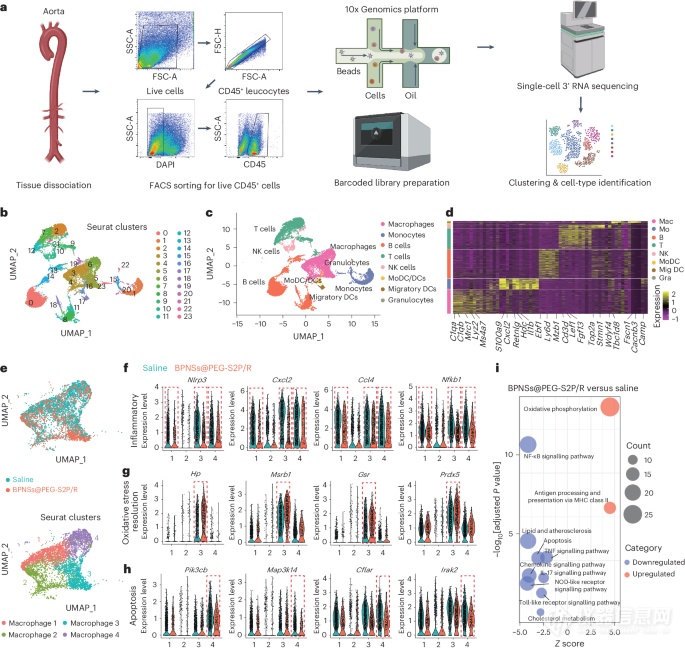
图6:单细胞转录组学揭示了BPNSs@PEG-S2P/R治疗调控主动脉病灶巨噬细胞的基因和关键分子通路。
【科学结论】
本研究深入探索了动脉粥样硬化的复杂病理机制,突出了慢性炎症和ROS过量生成在疾病发展中的关键作用。通过利用二维黑磷纳米片(BPNSs)的独特特性,如优异的生物相容性和强大的ROS清除能力,本文创新性地设计了靶向肽修饰的纳米治疗剂,实现了双重治疗功能:有效清除ROS并解决斑块中的炎症。这一“纳米药物递送药物”的策略不仅有效提高了治疗效果,还显著减少了对机体的不良影响。
研究结果不仅在动物模型中验证了其显著的疗效和安全性,而且通过单细胞水平的分析揭示了治疗机制的深层次调控,为未来开发治疗动脉粥样硬化及其他炎症性疾病的新型纳米药物提供了重要的价值。这些成果不仅有望促进相关领域的进一步研究和临床应用,还为纳米技术在个体化医疗和精准治疗中的广泛应用提供了有力支持,为解决复杂疾病治疗中的关键挑战开辟了新的道路。
原文详情:He, Z., Chen, W., Hu, K. et al. Resolvin D1 delivery to lesional macrophages using antioxidative black phosphorus nanosheets for atherosclerosis treatment. Nat. Nanotechnol. (2024). https://doi.org/10.1038/s41565-024-01687-1
来源于:仪器信息网
热门评论
最新资讯
新闻专题
更多推荐