高精度MINFLUX显微镜最新突破!
导读:德国科学家使用改进MINFLUX技术实现1纳米级别生物分子距离精确测量,揭示细胞内分子构型,推动生物领域研究。
【研究背景】
MINFLUX是一种精确测量分子纳米尺度距离的光学技术,因其能够应用于蛋白质相互作用、分子结构解析等领域而备受关注。与传统的FRET(弗雷斯特共振能量转移)显微镜相比,MINFLUX技术具有更高的空间分辨率,能够直接测量1至10纳米范围内的分子距离,甚至在分子倾斜时可以达到亚纳米的精度。然而,传统光学技术在测量如此小尺度的分子结构时往往存在分辨率不足等问题,因此对研究分子结构和相互作用带来了巨大的挑战。
近日,来自德国马克斯·普朗克多学科科学研究所Steffen J. Sahl以及 Stefan W. Hell教授联合通过改进MINFLUX光学方法,实现了精确测量蛋白质、肽链等生物分子中1纳米及以下的距离。利用带有已知单纳米级间隔的多脯氨酸标尺,作者成功展示了对这些荧光团的超高分辨率测量。
此外,他们还将这一方法应用于人类细胞中的蛋白质内部和蛋白质间的距离测量,成功揭示了某些传统方法无法检测到的超短距离。通过这项技术,团队不仅能够研究蛋白质-蛋白质相互作用,还能探索细胞内复杂的分子构型,推动了生物分子领域的前沿研究。
【仪器解读】
本文通过MINFLUX荧光纳米显微术的原理,具体来说,利用了其在纳米尺度下的超高分辨率光学测量能力,进而首次研发了一种能够直接、线性地测量分子内1纳米及以下距离的精密仪器。该仪器成功表征了蛋白质及其亚基之间的纳米级距离,发现了许多传统光学方法难以探测的短距离分子间距,最终揭示了生物大分子内部及其相互作用的精确构型。
本文针对生物大分子内部距离测量的长期挑战,通过MINFLUX方法的优化和应用,得到了从1到10纳米精度范围内的直接距离测量,进而挖掘了多种蛋白质之间和蛋白质内部的关键结构信息。研究人员利用这种创新的光学技术,不仅在多肽和蛋白质中验证了已知的短距离间隔,还首次揭示了免疫球蛋白亚基的特定取向,并在人体细胞中观测到了组氨酸激酶PAS结构域二聚体的特定构型。
在此基础上,通过该表征手段,进一步深入研究了细胞内蛋白质-蛋白质相互作用,特别是这些相互作用在细胞功能中的角色。MINFLUX的应用拓展了现有光学显微技术的极限,为更精确地探测生物大分子的近距离相互作用提供了强有力的工具,从而为理解细胞内复杂的分子动态提供了新途径。 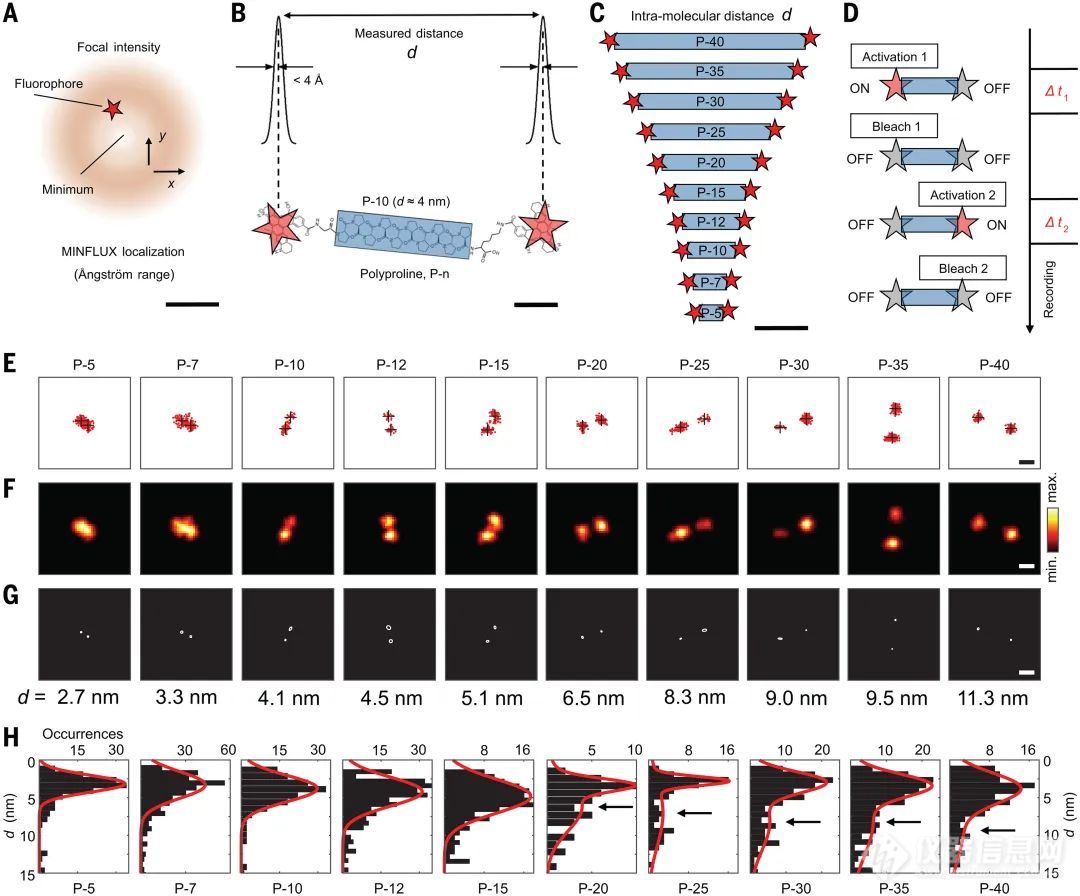
基于直接光学测量位置的埃级精确分子内距离测量,适用于FRET范围及更远
参考文献:https://www.science.org/doi/10.1126/science.adj7368
来源于:仪器信息网
热门评论
最新资讯
新闻专题