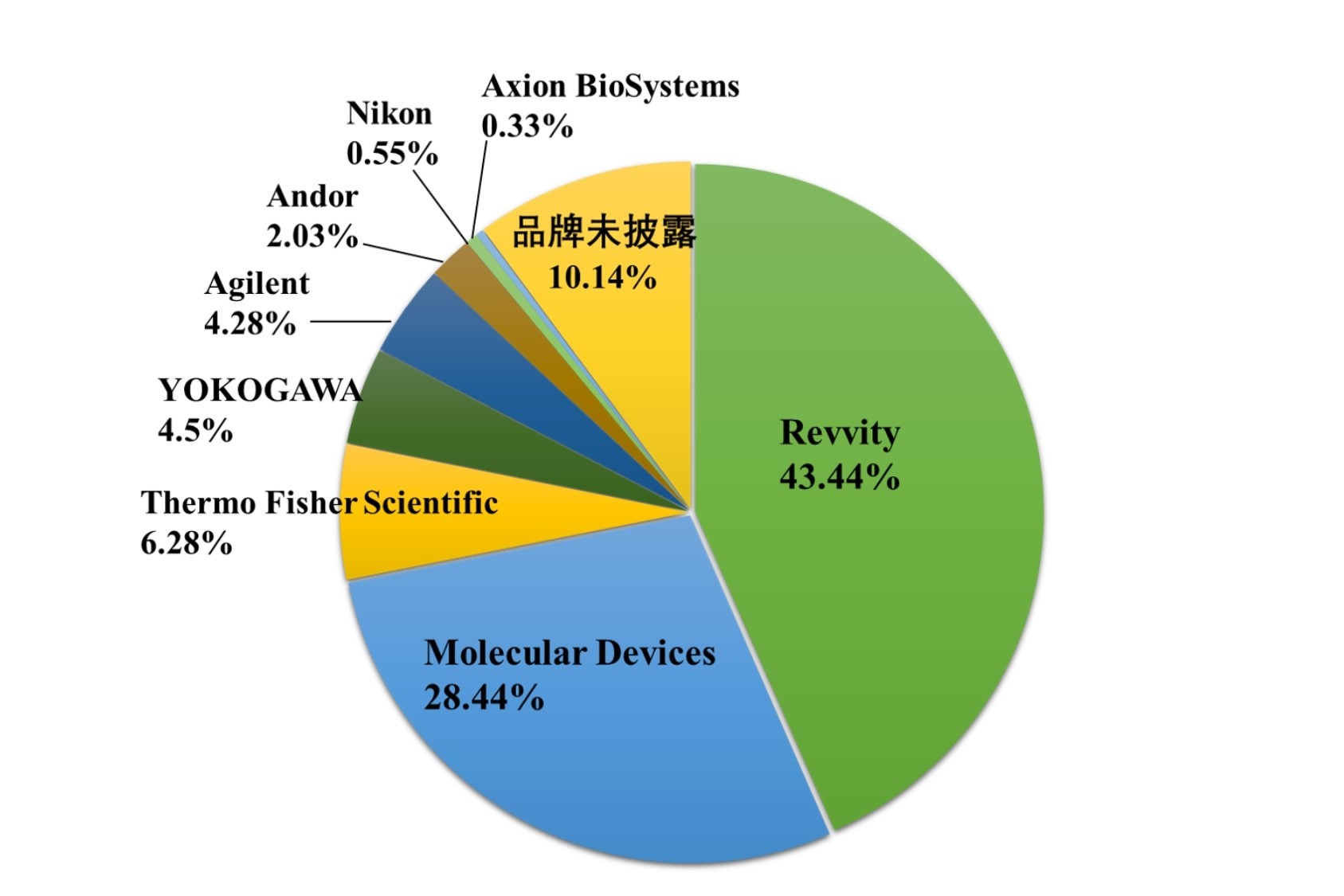
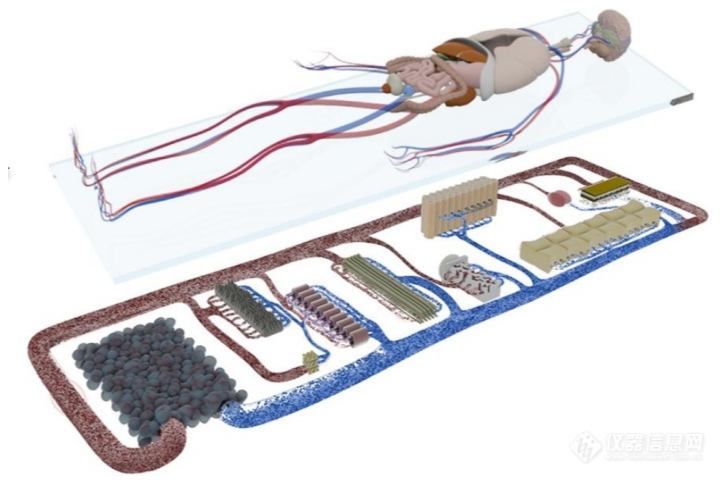
类器官新风向|CDE认可,类器官/器官芯片可作为非临床研究数据来源
进入 #“高内涵成像技术”驿站阅读更多话题内容
导读:《模型引导的罕见病药物研发技术指导原则(征求意见稿)》中明确指出可以将类器官、器官芯片用于罕见病新药研发时的定量药理学的数据来源。
2024年10月10日,国家药品监督管理局药品审评中心(CDE)发布了关于《模型引导的罕见病药物研发技术指导原则(征求意见稿)》的通知,旨在指导在罕见病药物研发过程中科学合理设计定量药理学研究以及有效应用定量药理学方法,提高罕见病药物研发效率。其中,明确指出可以将类器官、器官芯片用于罕见病新药研发时的定量药理学的数据来源。

定量药理学研究在罕见病药物研发中发挥关键作用,其整合并使用所有可用数据,在非常有限的所有可用数据中探索疾病和药物作用的内在规律,评估新药的临床获益和风险,并基于新药的临床获益风险比进行研发决策和监管决策,减少罕见病药物研发的不确定性,加大研发成功率。
《模型引导的罕见病药物研发技术指导原则(征求意见稿)》中指出,定量药理学研究的非临床研究数据包括但不限于基因、分子、细胞、类器官、器官芯片、动物研究数据等。

据悉,国家药品监督管理局药品审评中心(CDE)已多次将类器官等新型体外评价技术纳入药物临床前评价指南。
2021年1月,中国国家科技部下发的《关于对“十四五”国家重点研发计划6个重点专项2021年度项目申报指南征求意见的通知》中,把“基于类器官的恶性肿瘤疾病模型”列为“十四五”国家重点研发计划中首批启动重点专项任务。

2021年11月,国家药品监督管理局药品审评中心(CDE)发布的《基因治疗产品非临床研究与评价技术指导原则(试行)》、《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》通告中,首次将类器官列入基因治疗及针对基因修饰细胞治疗产品的指导原则中。

《基因治疗产品非临床研究与评价技术指导原则(试行)》

《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》
2022年2月,国家科技部发布关于对国家重点研发计划的《“干细胞研究与器官修复”重点专项2022 年度项目申报指南 (征求意见稿)》中,突出强调类器官疾病模型在肿瘤研究中的巨大价值。
2023年10月,国家药品监督管理局药品审评中心(CDE)发布《人源干细胞产品非临床研究技术指导原则(征求意见稿)》的通知,明确将类器官等新技术纳入人源干细胞产品非临床研究评价模型。

2024年6月,国家药品监督管理局药品审评中心(CDE)发布《肿瘤治疗性疫苗非临床研究技术指导原则(征求意见稿)》的通知,表明若采用动物种属进行非临床研究不可行时,可考虑采用替代产品在其相关动物种属中开展试验;也可同时考虑采用类器官等新技术、新方法进行探索性非临床研究。

随着监管政策的不断完善,诸如CDE等权威药物审评机构对类器官及类器官芯片等新兴技术的支持态度日益明确。可以预见,未来将会有更多基于类器官模型的药物评估数据用于临床申报。
相关附件:
1. 《模型引导的罕见病药物研发技术指导原则(征求意见稿)》.pdf
《模型引导的罕见病药物研发技术指导原则(征求意见稿)》.pdf
2. “十四五”国家重点研发计划“干细胞研究与器官修复”重点专项2021年度项目申报指南(征求意见稿).pdf
“十四五”国家重点研发计划“干细胞研究与器官修复”重点专项2021年度项目申报指南(征求意见稿).pdf
3. 《基因治疗产品非临床研究与评价技术指导原则(试行)》《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》.pdf
《基因治疗产品非临床研究与评价技术指导原则(试行)》《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》.pdf
4. “干细胞研究与器官修复”重点专项2022 年度项目申报指南 (征求意见稿).pdf
“干细胞研究与器官修复”重点专项2022 年度项目申报指南 (征求意见稿).pdf
来源于:仪器信息网
热门评论
最新资讯
新闻专题