科学家利用冷冻电子显微镜揭示过敏反应关键机制!
导读:研究揭示了IgE介导的FcεRI激活的分子机制,发现IgE结合后FcεRI从二聚体转变为单体,进而激活肥大细胞,为开发抑制过敏反应的新疗法提供理论基础。
【研究背景】
过敏性疾病是一类由免疫系统对通常无害物质(过敏原)产生过度反应引起的疾病,因其广泛影响着人们的生活和健康而应用于医学研究和治疗等领域。与传统的免疫反应机制相比,IgE介导的过敏反应具有极高的敏感性和反应强度,能够迅速引发肥大细胞和嗜碱性粒细胞的活化。然而,IgE如何通过高亲和力受体FcεRI调节这些细胞的功能,一直是免疫学领域的难题。因此,阐明IgE介导的FcεRI激活的分子机制,成为理解过敏反应和开发治疗策略的关键挑战。
近日,来自西湖大学施一公和宿强课题组在过敏机制研究中取得了新进展。该团队首次揭示了IgE介导的FcεRI激活的分子机制,利用冷冻电镜技术解析了人类FcεRI的三维结构,发现其在IgE结合之前主要以二聚体形式存在。通过深入分析二聚体界面和胆固醇类分子的稳定作用,他们成功揭示了IgE结合后FcεRI从二聚体转变为单体的过程,并进一步证实了这一转变对肥大细胞激活的关键作用。利用这一发现,研究团队显著提高了对过敏反应机制的理解,获取了在分子水平干预过敏反应的新靶点。这项研究为开发抑制过敏反应的新疗法提供了重要的理论基础。

【仪器解读】
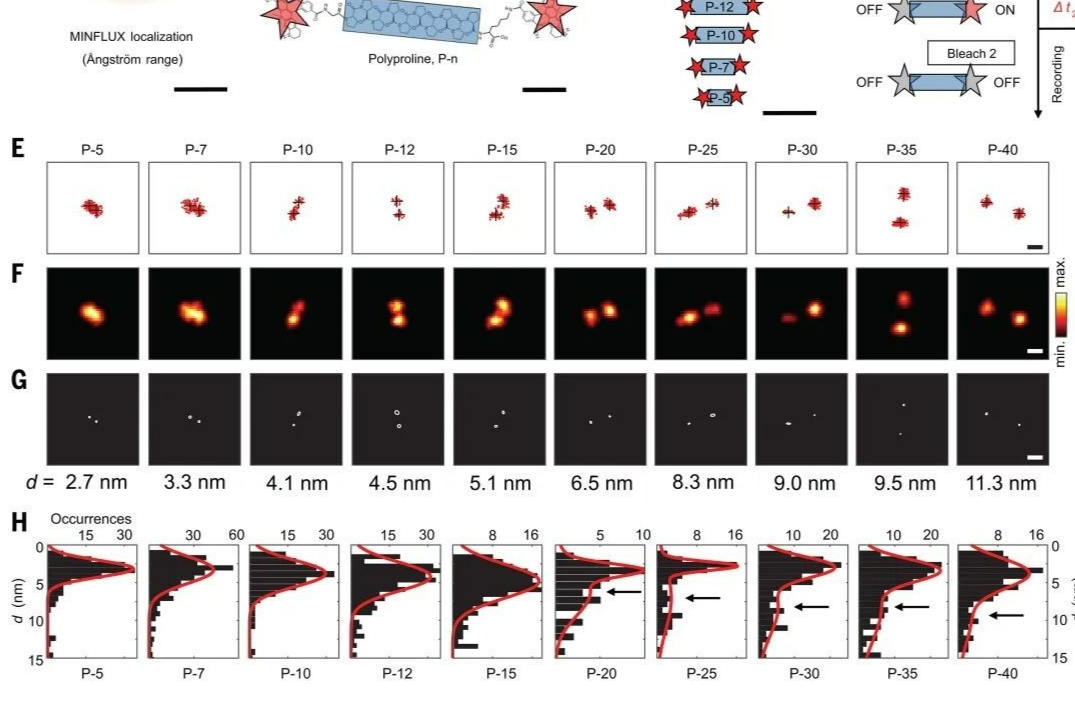
本文通过冷冻电镜(cryo-EM)和质谱分析等先进表征手段,揭示了IgE介导的FcεRI激活的分子机制。具体而言,研究团队首先利用冷冻电镜解析了FcεRI的结构,确定其在IgE结合前以同源二聚体形式存在于人类肥大细胞膜上。FcεRI的结构特征显示出每个二聚体由一个α亚基、一个β亚基和两个γ亚基构成,α亚基的跨膜螺旋与γ亚基和β亚基的跨膜螺旋层叠排列,形成稳定的二聚体结构。这一发现为理解FcεRI的功能提供了重要的分子基础。
针对IgE结合后FcεRI的功能变化,研究者们进一步通过电子密度图分析发现,嵌入在FcεRI跨膜结构域的类胆固醇分子可能在稳定二聚体状态中起重要作用。这一微观机制的揭示帮助我们理解了FcεRI在过敏反应中的角色,以及如何通过调控其结构来影响肥大细胞的活化。
此外,研究团队还使用了荧光寿命成像-弗斯特共振能量转移(FLIM-FRET)和超速离心分析,确认了IgE结合后FcεRI由二聚体转变为单体的过程。每个FcεRI单体结合一个IgE分子,这一转变被发现能够激活与肥大细胞存活、分化和迁移相关的基因(如Egr1、Egr3和Ccl2)的转录。通过比较不同FcεRI变异体的细胞实验,研究者们进一步证实了这种二聚体到单体的转变对IgE介导的肥大细胞激活至关重要。
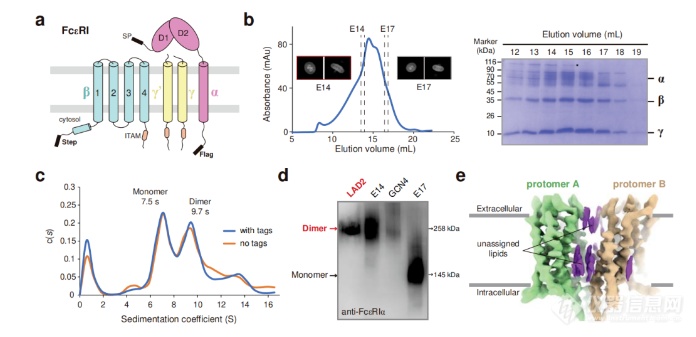
人类FcεRI的生化和冷冻电镜分析
原文详情:Chen, M., Su, Q. & Shi, Y. Molecular mechanism of IgE-mediated FcεRI activation. Nature (2024). https://doi.org/10.1038/s41586-024-08229-8
来源于:仪器信息网
热门评论
最新资讯
新闻专题