推荐厂家
暂无
暂无
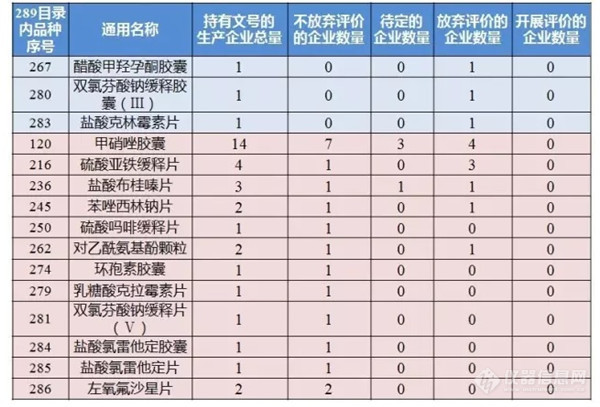




[align=left][font=宋体][color=black]仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价, 就是仿制药需在质量与药效上达到与原研药一致的水平。对已经批准上市的仿制药进行一致性评价,这是补历史的课。因为过去批准上市的药品没有与原研药一致性评价的强制性要求,有些药品在疗效上与原研药存在一些差距。历史上,美国、日本等国家也都经历了同样的过程,日本用了十几年的时间推进仿制药一致性评价工作。[/color][/font][/align][align=left][font=宋体][color=black]开展仿制药一致性评价,可以使仿制药在质量和疗效上与原研药一致 ,在临床上可替代原研药,这不仅可以节约医疗费用,同时也可提升我国的仿制药质量和制药行业的整体发展水平,保证公众用药安全有效。仿制药一致性评价在我国是补课,也是创新,做到与原研药质量疗效一致,离创制新药也就不远了 。[/color][/font][/align][align=left][font=宋体][color=black]自2016年3月我国正式启动仿制药一致性评价工作以来,截至2021年1月底,已有1973个品规通过一致性评价。越来越多的仿制药通过了一致性评价,加上“仿制药一致性评价”的LOGO,并纳入国家药品集中采购名单,降低了医疗费用,提升了药品质量,充分体现了医疗、医保、医药“三医联动”的成果。[/color][/font][/align][align=left][font=宋体][color=black]谱尼测试集团拥有UPLC-QTOF、UPLC、[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS、GC-MS/MS、GC、HPLC等众多精密设备,致力于仿制药一致性评价研究,同时携固定医疗战略伙伴竭诚为广大药企解决各类仿制药一致评价的需求。[/color][/font][/align]
听到关于药物一致性评价研究,那么什么是药物一致性评价?这个具体怎么做的呢?
这两年制药界里声音最亮的可能就是仿制药质量一致性评价了,从2014年01月29日CFDA发布《国家食品药品监督管理总局公开征求仿制药质量一致性评价有关指导原则等意见》起,仿制药质量一致性评价就开始被CFDA划重点了。 直到2015年11月18日CFDA又发布《关于开展仿制药质量和疗效一致性评价的意见(征求意见稿)》意见的公告(2015年 第231号),仿制药一致性评价终于被提上日程了,这个征求意见稿一出,令多少的企业和人惺惺相惜,不得而知,但毋庸置疑的是,肯定会砍掉很多企业,拉出“明确评价对象和时限”说明: "对2007年10月1日前批准的国家基本药物目录(2012年版)中化学药品仿制药口服固体制剂,应在2018年底之前完成一致性评价,届时没有通过评价的,注销药品批准文号。 对2007年以前批准上市的其他仿制药品和2007年以后批准上市的仿制药品,自首家品种通过一致性评价后,其他生产企业的相同品种在3年内仍未通过评价的,注销药品批准文号。" 单就这两点,对制药企业就有足够的杀伤力。不管别人怎么看待这个 仿制药质量一致性评价,我个人是举双手赞成的,因为我觉得,这才是对老百姓负责的态度。一直以来,就有个疑问:为什么进口药效果那么好而国产同样的药品就不那么好了,借用CDE审评人员的观点来理解一下仿制药:[color=#333333] 仿制药(又称Generic Drug)是指与原研药(或称商品名药)在剂量、安全性和效力(strength)、质量、作用(performance)以及适应症(intended use)上相同的一种仿制品,又称通用名药、非专利药等。仿制研发的目标是实现临床应用上仿制药与原研药的“可替代性”。[/color][color=#333333] 按照美国FDA的观点,能够获得批准的仿制药必须满足以下条件:和被仿制产品含有相同的活性成分,其中非活性成分可以不同;和被仿制产品的适应症、剂型、规格、给药途径一致;生物等效;质量符合相同的要求;生产的GMP标准和被仿制产品同样严格。[/color][color=#333333] 质量,最关键的元素,不管你怎么仿,但前提是保证质量可靠。怎么保证质量可靠,接下来CFDA给答案了:BE研究,即生物等效性评价研究,单这一项研究不知又要拖垮多少制药企业,BE研究是需要大量money的,不是开个反应釜那么回事。[/color][color=#333333] “合理选用研究方法。原则上企业应采用体内生物等效性试验的方法进行评价,允许企业采取体外溶出度试验的方法进行评价。”虽然可以通过体外溶出试验的方法进行评价,但是并不是所有的仿制药都可以的,BCS分类,4类,对于一类和三类的,高溶高渗和高溶低渗的仿制药是可以豁免生物等效性研究的,但对于其他的药物还是得老老实实地进行BE研究。[/color][color=#333333] 对于通过[color=#333333]体外溶出度试验的方法进行评价的仿制药,仿制制剂和参比制剂的质量对比研究就尤为重要了,特别是溶出曲线相似性评价,举个例子,吃A药10分钟见效,但是吃仿A药30分钟还不见效,那仿药就有问题了,说明你吃了这个药并未很快崩解分布入血,如果病人是心脏病或者高血压的话,吃了这样的仿A药,很可能后果很严重。也许,这个例子那么点儿极端,但如此更能体现出质量一致性研究的重要性。[/color][/color][color=#333333][color=#333333] 总之,对于仿制药质量一致性评价,个人觉得每个制药人都应该去践行,制药人心中都要有杆秤,良心的天平。[/color][/color][color=#333333][/color]

 留言咨询
留言咨询

 400-801-3998
400-801-3998
 留言咨询
留言咨询

 留言咨询
留言咨询


