推荐厂家
暂无
暂无
磷酸化的Ser、Tyr和Thr修饰的多肽:我们国肽生物提供单磷酸化和多磷酸化多肽服务,目前我们已经能够提供四个磷酸化位点修饰的多肽。[img=,434,186]https://ng1.17img.cn/bbsfiles/images/2019/04/201904191649355554_2764_3531468_3.jpg!w434x186.jpg[/img][img=,486,498]https://ng1.17img.cn/bbsfiles/images/2019/04/201904191649358877_2957_3531468_3.jpg!w486x498.jpg[/img]我们主要提供:多肽定制、磷酸肽、生物素标记肽、荧光标记肽、同位素标记肽、人工胰岛素、药物肽、多肽合成、目录肽、偶联蛋白、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:17718122172;17718122684;17730030476;17718122397
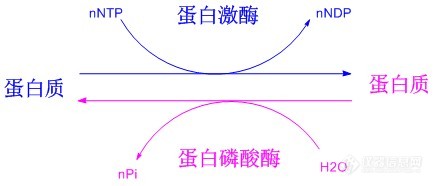
生命活动与蛋白质的动态变化密切相关, 很多情况下某些蛋白质是通过各种翻译后修饰来完成或改变其功能。在数量众多的蛋白质翻译后修饰中,蛋白质磷酸化修饰无疑是最重要的一类,它是指通过蛋白激酶(Protein kinase,PK)介导的酶促反应把磷酸基团从一个化合物转移到另一个化合物上的过程(Figure 1所示),是生物体内存在的一种普遍的调节方式。现今发现的所有人类蛋白质中超过30%可被磷酸化修饰,这一修饰在细胞信号的传递过程中占有极其重要的地位,与生命活动的许多过程都密切相关,对此的研究已经成为蛋白质科学的热点之一。 http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918444_small.jpg磷酸化多肽(主要指肽链中的酪氨酸、丝氨酸和苏氨酸残基的侧链羟基被磷酸化生成酸式磷酸酯的修饰多肽)是研究蛋白质磷酸化过程的必不可少的工具,它可作为磷酸酶模型底物,或作为可产生抗磷酸化蛋白抗体的抗原,也可以在确定磷酸化蛋白的物理参数时作为参考化合物等。因此磷酸化多肽的合成在过去的几年中吸引了相当大的兴趣,目前已确定了较为成熟的合成路线,使磷酸化多肽的合成趋于常规。目前磷酸化多肽的合成主要有两个策略:后磷酸化法(Global phosphorylation)和单体法(Building block approach),如Figure 2所示。前者是在多肽序列合成结束后再在固相载体上对丝氨酸、苏氨酸或酪氨酸的侧链羟基进行磷酸化,可以在同一次合成中同时得到带有和不带有磷酸化位点的多肽;而后者则将适当保护的磷酸化氨基酸直接引入到多肽序列中,操作较前者更为简单,现已成为磷酸化多肽合成的首选策略。在采用单体法构建磷酸化多肽时,目前广泛采用的原料为侧链单苄基保护的氨基酸:Fmoc-AA(PO(OBzl)OH)-OH (AA = Ser, Thr or Tyr)。这类保护的磷酸化位点由于侧链磷酸化基团的离子化而产生较大的位阻效应,并且磷酸化位点的引入往往能促进肽链二级结构的形成,故而磷酸化位点及其后的氨基酸的引入会比较困难。这些问题在合成含有多个磷酸化位点的多肽时将会变得尤为严重,往往会使最终产物的组成非常复杂,难以进行纯化,甚至直接导致合成的失败。http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918477_small.jpg一般来讲,增加投料量和延长反应时间都能促使连接反应趋于完全,但增加投料量无疑会提高合成成本,对于较昂贵的带有保护的磷酸化氨基酸更是这样,而延长反应时间则可能增加其它副反应发生的风险,故而在合成磷酸化多肽时,需要对氨基酸投料量、反应方法以及反应时长等进行优化调整以期达到更理想、更经济的合成效果。我们有针对性地对磷酸化多肽合成条件进行了探索和调整,采用最终的优化条件成功合成了含有多达六个磷酸化丝氨酸残基的多肽:FAM-Ahx-X(pS)XX(pS)X(pS)X(pS)XX(pS)X(pS)-NH2(客户肽,详细序列未给出;其氨基端标记FAM以进行荧光检测),经过RP-HPLC纯化后最终纯品的纯度高达95%(见Figure 3)。http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918493_small.jpg参考文献:1. P. Cohen, “The Role of Protein Phosphorylation in Neural and Hormonal Control of Cellular Activity”, Nature, 1982, 296 (5858): 613-620.2. From: http://en.wikipedia.org/wiki/Protein_kinase.3. L. A. Pinna, A. Donella-Deana, “Phosphorylated Synthetic Peptides as Tools for Studying Protein Phosphatases”, Biochim. Biophys. Acta., 1994, 1222 (3): 415-431.4. W. C. Chan, P. D. White, “Fmoc Solid Phase Peptide Synthesis-A Practical Approach” (2000), Oxford University Press.
磷酸化蛋白质及多肽相关研究的技术进展 摘要磷酸化修饰是一种重要的蛋白质化学修饰,对蛋白质功能的完成或改变起到重要作用。该领域的研究存在很多技术难点,对该领域研究形成了挑战。近年来相关技术有了很多突破,磷酸化研究也取得了很多新的成就。文章将从磷酸化蛋白的检出、磷酸化蛋白质和肽段的富集、生物质谱技术的改进以及磷酸化蛋白和多肽的定量与比较几个方面介绍该研究领域的技术进展。关键词磷酸化蛋白磷酸化肽生物质谱定量分析生命活动与蛋白质的动态变化密切 摘要 磷酸化修饰是一种重要的蛋白质化学修饰, 对蛋白质功能的完成或改变起到重要作用。该领域的研究存在很多技术难点, 对该领域研究形成了挑战。近年来相关技术有了很多突破, 磷酸化研究也取得了很多新的成就。文章将从磷酸化蛋白的检出、磷酸化蛋白质和肽段的富集、生物质谱技术的改进以及磷酸化蛋白和多肽的定量与比较几个方面介绍该研究领域的技术进展。 关键词 磷酸化蛋白 磷酸化肽 生物质谱 定量分析




 400-860-5168转0230
400-860-5168转0230
 留言咨询
留言咨询

 400-611-9236
400-611-9236
 留言咨询
留言咨询

 400-886-5615
400-886-5615
 留言咨询
留言咨询


