推荐厂家
暂无
暂无



 400-860-5168转6039
400-860-5168转6039
 留言咨询
留言咨询

 400-860-5168转4645
400-860-5168转4645
 留言咨询
留言咨询

 400-860-5168转4645
400-860-5168转4645
 留言咨询
留言咨询


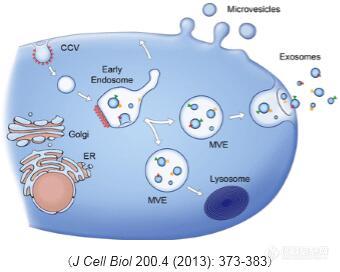
微生物细胞大小的测定和显微镜直接计数 目的 1.1 学习接目测微计的校正方法, 了解血球计数板的构造和计数原理 1.2 学习使用显微镜测微尺测定微生物细胞大小, 掌握用血球计数板测定微生物细胞总数 的方法。 2 原理 微生物细胞的大小是微生物分类鉴定的重要依据之一。微生物个体微小,必须借助于显微镜才能观察,要测量微生物细胞大小,也必须借助于特殊的测微计在显微镜下进行测量。 显微测微计由镜台测微计和目镜测微计两部分组成。后者可直接用于测量细胞大小。它是一块圆形玻片(图7—1),其中央有精确等分到度,测量时将其放在接目镜中的隔板上。由于目镜测微计所测量的是微生物细胞经过显微镜放大之后所成像的大小,刻度实际代表的长度随使用的目镜和物镜放大倍数及镜筒的长度而改变,所以,使用前须先用镜台测微计进行标定,求出某一放大率下,目镜测微计每一小格所代表的长度,然后用目镜测微计直接测被测对象的大小。镜台测微计是一块中央有精确刻玻片(图7—1),刻度的总长为lmm,等分为100小格,每小格长10um,专用于对目镜测微计进行标定的。 3 材料 3.1 器械 显微镜、目镜测微尺、镜台测微尺,载玻片、盖玻片、血球计算板、擦镜纸、吸水纸、玻片架、肾形盘、洗瓶、接种环、酒精灯、火柴、滴管。 3.2 菌种 培养48h的啤酒酵母斜面菌体和菌悬液。 3.3 革兰氏染液 4流程 4.1 置目测微计→置台测微计→标定目测微计→测菌体大小→记录结果→用毕擦拭干净 4.2 检查计数板→稀释样品→加样→计数→计算→清洗 5 步骤 5.1 微生物菌体大小的测定 5.1.1 目镜测微尺的校正 5.1.1.1 更换目镜镜头 更换目镜测微尺镜头(标记为PF);或者取下目镜上部或下部的透镜,在光圈的位置上安上目镜测微尺,刻度朝下,再装上透镜,制成一个目镜测微尺的镜头。 5.1.1.2 某一倍率下标定目镜刻度 将镜台测微尺置于载物台上,使刻度面朝上,先用低倍镜对准焦距、看清镜台测微尺的刻度后,转动目镜,使目镜测微尺与镜台测微尺的刻度平行,移动推动器使两尺重叠,并使二尺的左边的某一刻度相重合,向右寻找另外二尺相重合的刻度。记录两重叠刻度间的目镜测微尺的格数和镜台测微尺的格数(图7-1C)。 5.1.1.3 计算该倍率下目镜刻度 目镜测微尺每格长度=镜台测微尺格数/目镜测微尺格数xl0um 5.1.1.4 标定并计算其他放大倍率下的目镜刻度 以同样方法分别在不同倍率的物镜下测定目镜测微尺每格代表的实际长度。如此测定后的测微尺的长度,仅适用于测定时使用的显微镜以及该目镜与物镜的放大倍率。 5.1.2 菌体大小的测定 5.1.2.1 将啤酒酵母制成水浸片。 5.1.2.2 大小换算 将标本先在低倍镜下找到目的物,然后在高倍镜下用目镜测微尺测定每个菌体长度和宽度所占的刻度,即可换算成菌体的长和宽。 5.1.2.3 求平均值 一般测量微生物细胞的大小,用同一放大倍数在同一标本上任意测定l0一20个菌体后,求出其平均值即可代表该菌的大小。 5.2 用血球计数板测定微生物细胞的数量 5.2.1 检查血球计数板 取血球计数板一块,先用显微镜检查计数板的计数室,看其是否沾有杂质或干涸着的菌体,若有污物则通过擦洗、冲洗,使其清洁。镜检清洗后的计数板,直至计数室无污物时才可使用。 5.2.2 稀释样品 将培养后的酵母培养液振荡振摇混匀,然后作一定倍数的稀释。稀释度选择以小方格中的分布的菌体清晰可数为宜。一般以每小格内含4~5个菌体的稀释度为宜。 5.2.3 加样 取出一块干净盖玻片盖在计数板中央。用滴管取1滴菌稀释悬液注入盖玻片边缘,让菌液自行渗入,若菌液太多可用吸水纸吸去。静置5—10分钟。 5.2.4 镜检 待细胞不动后进行镜检计数。先用低倍镜找到计数室方格后,再用高倍镜测数。一般应取上下及中央五个中格的总菌数。计数时若遇到位于线上的菌体,一般只计数格上方(下方)及右方(左方)线上的菌体。每个样品重复3次。 5.2.5 计算 取以上计数的平均值,按下列公式计算出每毫升菌液中的含菌量。 菌体细胞数(cfu/mL)=小格内平均菌体细胞数%26#215 400%26#215 104%26#215 稀释倍数 5.2.6 清洗 计数板用毕后先用95%的形酒精轻轻擦洗,再用蒸馏水淋洗,然后吸干,最后用擦镜纸揩干净。若计数的样品是病原微生物,则须先浸泡在5%石炭酸溶被中进行消毒,然后再行清洗。清洗后放回原位,切勿用硬物洗刷。 图7-2 血细胞计数板 6 结果 6.1计算出目镜测微尺在低、高倍镜下的刻度值。 6.2 记录菌体大小的测定结果。 6.3 计算样品中酵母菌浓度。 7 思考 7.1 为什么随着显微镜放大倍数的改变,目镜测微计每格相对的长度也会改变?能找出这种变化的规律吗? 7.2 根据测量结果,为什么同种酵母菌的菌体大小不完全相同? 7.3 能否用血球计数板在油镜下进行计数?为什么? 7.4 根据自己体会,说明血球计数板计数的误差主要来自那些方面?如何减少误差? 8 附录 目镜测数尺有两种:一是特制的目镜镜头,镜片上刻有50等分或100等分的刻度,使用时直接安装在显微镜上,取代没有刻度的目镜镜头;另一种是一块直径大约17.5 mm的圆玻璃片,其中央刻有50等分或100等分的刻度(图7-1A),使用时将该玻璃片安装在原来的目镜镜头上即可。由于不同的显微镜放大倍数不同,既使同一显微镜在不同的目镜、物镜组合下其放大倍数也不同,故目镜测微尺每格实际表示的长度随显微镜放大倍数不同而异。也就是说,目镜测微尺上的刻度只代表相对的长度。因此在使用前须用镜台测微尺校正,以确定在一定放大倍数下目镜测微尺的每格长度。 血球计数板是一块特别的厚玻片,玻片中央分剖成两个平面,上面各刻有9区,中央一区为计数室,供计数用(图7-2A),此区的长和宽各为1mm。中央平面两侧有小沟,小沟外有两条突起的平台,平台比中央平面高0.1mm,因此计数室体积为0.1mm3,容积为10-4ml。通常计数室分为25个大格,每大格又分为16个小格,每小格容积为4%26#215 10-6ml,即lml菌液容积相当于400万个小格体积。因此只要将细胞悬液注人计算室,计算出一定数量小格的平均菌数即可算出每毫升的细胞数。
[align=center][size=24px]流式细胞仪监测适配体与靶细胞的结合[/size][/align][align=center]肖书棋 18122884967[/align][align=center][/align]本次说明是基于核酸适配体能与靶标进行特异性结合的原理,利用流式细胞仪监测适配体与靶细胞的结合状况,还能比较不同适配体与靶细胞之间的结合强度的比较;本次所使用的流式分析仪是BD FACSAria III。[font='times new roman'][size=16px]1.原理介绍:[/size][/font][font='times new roman'][size=16px]1.1核酸适配体:[/size][/font]核酸适配体(Aptamer,Apt):是一段寡核苷酸序列(ssDNA或RNA),是利用指数富集的系统进化技术(the Systematic Evolution of Ligands by Exponential Enrichment,SELEX)在多样寡核苷酸序列的文库中,进行体外筛选得到。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026239049_1528_5413603_3.jpeg[/img][/align][align=center][size=13px]Aptamer结合靶标原理[/size][size=13px]图[/size][/align]如图所示,在合适的缓冲液环境下,单链寡核苷酸序列具有弯曲以及折叠成特定的三级空间结构的能力,该结构可以与靶分子特异性结合,SELEX技术就是应用该原理来进行选择的。将信息量巨大且随机的的寡核苷酸文库与靶标孵育,经过多轮的优胜劣汰和PCR扩增,最后得到能与靶标高亲和力性结合的寡核苷酸序列,即核酸适配体(Aptamer)。由于核酸适配体具有靶向特异性的特点,因此应用广泛;那么如何监测适配体靶向细胞亲和力的方法,就需要用到流式细胞术进行表征。[font='times new roman'][size=16px]1.2流式细胞仪原理:[/size][/font]流式细胞术能够快速检测细胞或者生物颗粒的特征,其检测灵敏,能够定性或者定量分析颗粒的参数,还具有细胞分选的功能,功能强大,分析参数多,实用性较强。流式细胞仪(flow cytometer,FCM)的设计应用了光学、细胞化学、电子学等技术,拥有较强大的细胞及微粒分析功能,在临床医学、免疫学、微生物学等等研究领域发挥着巨大的作用。流式分析可以检测细胞表面颗粒复杂程度、核酸以及蛋白质的含量、细胞表面积或者细胞表面的抗体、细胞受体等等,在多种研究领域起到重要作用。在本研究中应用流式分析细胞荧光强度的基本步骤原理是:(1)制备成单细胞悬液:将待测细胞预处理进行荧光标记后制成单细胞悬液,通过气压将流式管中的细胞悬液通过管道压进流动室,同时喷出的鞘液将细胞包裹,形成圆形的鞘流,细胞在鞘液的包被下单行排列,依次通过流动室检测区域。(2)形成光散射:激发光源侧向垂直射向单个细胞,含有荧光的细胞形成两种光:①前向散射光(forward scatter, FSC):激光束照射细胞时,光束偏移量较小(10°以内),散射至前方,可用于检测细胞等粒子的表面信息,颗粒体积越大,信号越强。②侧向散射光(side scatter,SSC)激光束照射颗粒,产生偏移角度为直角的散射光,可反应细胞内含物的信息。(3)光信号转化成电信号:光信号导入到计算机中,依次形成电信号,再转化为数字信息。应用FlowJo软件处理数据,可以获得相应的散点图、直方图等形式,便于直观分析。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026241158_6946_5413603_3.jpeg[/img][/align][align=center][font='times new roman'][size=13px]流式分析基本原理图[/size][/font][/align][font='times new roman'][size=16px]2.分析步骤:[/size][/font][font='times new roman'][size=16px]2.1细胞预处理:[/size][/font]通过流式分析预处理,可以使细胞在特定的环境,与带有FAM荧光的适配体进行特异性结合,通过平行实验使细胞与不同的适配体文库进行标记,最终表征其荧光强度,进行亲和力的分析与比较。如表所示,流式分析条件为:[align=center][size=13px]流式细胞分析条件探寻[/size][/align][table][tr][td][align=center][size=13px][color=#000000]孵育时条件[/color][/size][/align][/td][td][size=13px][color=#000000]孵育时体积[/color][/size][/td][td=2,1][align=center][size=13px][color=#000000]孵育时浓度[/color][/size][/align][align=center][size=13px][color=#000000]细胞浓[/color][/size][size=13px][color=#000000]度 [/color][/size][size=13px][color=#000000]单链DNA浓度[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]第二次洗涤用液[/color][/size][/align][/td][/tr][tr][td][align=center][size=13px][color=#000000]4 ℃,30 min,BB,摇晃[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]500 μL[/color][/size][/align][/td][td][size=13px][color=#000000]2.5×10^6个/mL[/color][/size][/td][td][align=center][size=13px][color=#000000]125 nM[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]PBS x 2[/color][/size][/align][/td][/tr][/table]流式分析的大致步骤为:消化细胞、细胞与文库孵育、润洗重悬、上样分析。最终确定,初始的细胞悬液浓度为5×10[font='times new roman'][size=16px]6[/size][/font] 个/mL,初始文库的浓度为250 nM;孵育时体系的总体积为250 L,细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL,适配体浓度为125 nM,环境为4 ℃、30 min,震荡。最后上样的细胞悬液体积为500 L,细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL。[align=left][font='times new roman'][size=16px]2.1.1材料准备:[/size][/font][/align][align=center][size=13px] 流式分析主要仪器与试剂[/size][/align][table][tr][td][align=center]名称[/align][/td][td][align=center]规格/型号[/align][/td][td][align=center]作用[/align][/td][/tr][tr][td][align=center]流式细胞仪[/align][/td][td][align=center]FACSAria III[/align][/td][td][align=center]对细胞进行流式分析[/align][/td][/tr][tr][td][align=center]可调式混匀仪[/align][/td][td][align=center]MX-S[/align][/td][td][align=center]混悬适配体悬液[/align][/td][/tr][tr][td][align=center]震荡仪[/align][/td][td][align=center]MX-M[/align][/td][td][align=center]震荡孵育体系,防止细胞贴壁[/align][/td][/tr][tr][td][align=center]制冷恒温金属浴[/align][/td][td][align=center]HX-20L[/align][/td][td][align=center]热击适配体,使核酸变性恢复到自由的无规则卷曲状态[/align][/td][/tr][tr][td][align=center]显微镜[/align][/td][td][align=center]DMI1[/align][/td][td][align=center]观察细胞[/align][/td][/tr][tr][td][align=center]水浴氮吹仪[/align][/td][td][align=center]FY-DCY12S[/align][/td][td][align=center]加热试剂[/align][/td][/tr][tr][td][align=center]电子天平[/align][/td][td][align=center]JA2003[/align][/td][td][align=center]称量药品[/align][/td][/tr][tr][td][align=center]离心管[/align][/td][td][align=center]15 mL×10、50mL×10[/align][/td][td][align=center]分装试剂,装载需离心的细胞[/align][/td][/tr][tr][td][align=center]低吸附离心管[/align][/td][td][align=center]2 mL×20[/align][/td][td][align=center]装适配体悬液,减少适配体与细胞在管壁上的吸附[/align][/td][/tr][tr][td][align=center]一次性使用吸管[/align][/td][td][align=center]3 mL×20[/align][/td][td][align=center]方便地吸取PBS[/align][/td][/tr][tr][td][align=center]细胞刮刀[/align][/td][td][align=center]3010×1[/align][/td][td][align=center]刮下贴壁生长的细胞[/align][/td][/tr][tr][td][align=center]PBS[/align][/td][td][align=center]50 mL×2[/align][/td][td][align=center]ScienCell[/align][/td][/tr][tr][td][align=center]Cell Dissociation Solution[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]消化细胞[/align][/td][/tr][tr][td][align=center]0.25%Trypsin-EDTA[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]Gibco[/align][/td][/tr][tr][td][align=center]1×PBS缓冲液[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]润洗细胞,重悬细胞[/align][/td][/tr][tr][td][align=center]Cell Dissociation Solution[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]消化细胞[/align][/td][/tr][tr][td][align=center]0.25%Trypsin-EDTA[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]Gibco[/align][/td][/tr][tr][td][align=center]1×PBS缓冲液[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]润洗细胞,重悬细胞[/align][/td][/tr][tr][td][align=center]无酶无菌水[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]溶解适配体文库[/align][/td][/tr][tr][td][align=center]DMEM高糖培养基[/align][/td][td][align=center]50 mL[/align][/td][td][align=center]停止消化[/align][/td][/tr][tr][td][align=center]细胞[/align][/td][td][align=center]>5×10[font='times new roman'][size=16px]6[/size][/font]个[/align][/td][td][align=center]作为目的细胞进行流式表征[/align][/td][/tr][/table]①配置Binding buffer(结合缓冲液BB):配置10 g/L BSA:称量0.1g BSA,溶于10 mL Washing Buffer,过膜;取上述溶液5 mL,加入到445 mL Washing Buffer中;再加入500 L鲑精DNA,混匀。②将U盘格式化,提前打开制冰机和金属浴(95℃);③37℃水浴:将无酶消化液、ECM、PBS(1)放入37℃水浴。④4℃冰敷:向泡沫盒中加碎冰,离心管架、温度计,准备4℃孵育环境,放入PBS和BB预冷。⑤打开显微镜(酒精擦拭载物台)。⑥打开离心机:120 g,1 min,25℃。[align=left][font='times new roman'][size=16px]2.1.2[/size][/font][font='times new roman'][size=16px]计数和文库预处理[/size][/font][/align](1)细胞计数(20倍或者40倍显微镜):①采用直接计数法,在显微镜中随机选择五个点进行计数取平均值,根据视野的面积以及T75培养瓶面积计算细胞总数,推出公式:Y为总细胞数;X为视野中细胞平均数;Y=27886.12X(20倍镜下)/Y=111111.11X(40倍镜下)。为了保证流式有足够的细胞,需要保证细胞总数>5×10[font='times new roman'][size=16px]6[/size][/font]个/mL。②计算BB体积:V=Y/(2×10[font='times new roman'][size=16px]7[/size][/font])mL,用V体积的BB重悬细胞沉淀,可获得细胞浓度为5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的初始细胞悬液。(2)文库预处理:①将粉末状适配体文库进行离心:4000 r,5 min,4℃;使适配体粉末聚集在离心管底部,防止打开离心管时干粉状适配体飞出。②按照说明用一定体积的无酶无菌水溶解适配体,使适配体母液浓度在5 M。③取100 L母液,并加入900 LBB,使适配体浓度在500 nM。④再去上述液体500 L,并用BB稀释至浓度为250 nM,最终得到250 nM的适配体文库悬液。⑤95℃热击3 min,热击后放在泡沫盒中冰敷。[align=left][font='times new roman'][size=16px]2.1.3[/size][/font][font='times new roman'][size=16px]细胞处理[/size][/font][/align](1)消化:①PBS(37℃)润洗3次。②无酶消化液3 mL,消化9 min(等待期间准备好孵育用离心管;确认离心机参数为:120 rcf,1 min,25 ℃),吹打细胞使其从培养瓶表面脱落。直接转移至15mL离心管中,吹打混匀约20次(吹散细胞团,分离成单个细胞)。③显微镜观察确认细胞均从培养瓶上脱落,加入2-3 mL ECM至培养瓶中润洗,然后转移至上述离心管中,吹打终止消化。④离心:120 rcf,1 min,25℃。(等待期间各加入250 L待测文库至低吸附离心管中,注意要快速,吸取之前需要先混悬文库)。⑤离心之后小心倒出,用枪吸出剩下的ECM,加入2V L BB,重悬吸打混匀,获得5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的细胞悬液。[align=left][font='times new roman'][size=16px]2.1.4[/size][/font][font='times new roman'][size=16px]细胞与文库结合[/size][/font][/align]①孵育:分别加入250 μL上述细胞悬液至250 μL ssDNA文库中,进行孵育:4℃,30 min,打开摇床第二格。②等待期间离心机调至4℃;用密封袋装好洁净的1000 L枪头准备流式上样用;2.2.2.5 润洗重悬细胞①取出孵育好的体系,进行离心:4℃,120 g,1 min(等待期间准备好4℃ PBS)。②倒掉上清液,用枪头小心吸出管口残留的上清液,每管加500 L PBS(4℃)用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸打重悬约20次。③再次离心4℃,120 g,1 min。④第二次重悬:重复①-③步骤。⑤每管加入500 L PBS重悬,忽略实验损失,最后得到理论细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的细胞悬液。[font='times new roman'][size=16px]2.2[/size][/font][font='times new roman'][size=16px]送样分析[/size][/font]FAM荧光染色较弱,在预处理之后应尽快进行流式分析,流式分析上样程序复杂,需要正确进行开机,测样,关机的步骤,才能够得到准确的数据。[align=left](1)准备工作:[/align][align=left]准备1000 mL[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url],1000 mL 洁净枪头,流式管,质控微球。[/align][align=left]①开启液流系统:由上至下打开流式细胞仪开关;再开启计算机,打开FACSDiva软件,在“Cytometer仪器框”中确认流式细胞仪已与电脑连接,启动液流之前,确认液流系统水平,进行补充鞘液、去离子水、乙醇以及漂水,并清空废液。[/align][align=left]在“Cytometer”菜单中,点击“Fluidics Startup(启动液流系统)”,按照提示进行操作:确定气路和液路是从乙醇桶连接到了鞘液桶上:将蓝色液路管接到过滤器下方,透明气路管接到鞘液桶上;确定闭合的喷嘴是在流动检测池上。[/align][align=left]②将70 m的喷嘴放入装有超纯水的烧杯中,超声30 s,用无尘纸蘸干;抽出闭合的喷嘴;插入70 m的喷嘴(红圈朝上)。[/align][align=left]③点击“×steam”,开启液流,出现水滴状,调整使上端横线位于第二个或者第三个水滴的尾部,下端横线位于第三个或者第四个液滴的中部,调整好后关闭液流。[/align][align=left](2)做质控:[/align][align=left]①用CS&T微球,用之前一定将微球甩匀(保证取出的微球呈均匀体系)用涡旋震荡;取一支洁净的流式管加入333 L的鞘液,再加一滴微球(用之前用混悬仪混匀,正常的微球为浑浊状)。[/align][align=left]②打开液流系统,在“Cytometer”菜单下点击“CST”;展开Setup Control窗口:在Characterize菜单中中选择“Check Performence”;在Configuration流式设置中:喷嘴的大小:选择70m,点击左下角“set configuration”,再点击“OK”。[/align][align=left]③选择微球的Lot ID:与微球瓶身上编号对应:10549。[/align][align=left]④敲弹准备好的微球悬液使其混匀,进行上样,打开液流;确认激发光源没问题即可关掉页面并关掉液流。[/align][align=left](3)上样:[/align][align=left]①新建样品,并勾选FITC、SSC、FSC的H、A、W、log数据项。[/align][align=left]②作图:建立散点图,横坐标为FSC-H,纵坐标为SSC-H;再建立一个图:横坐标:FITC-H,纵坐标为:Count。[/align][align=left]③打开液流至3,选择对应样品;吹打混匀并放置样品,点击“LOAD”上样。调整FSC和SSC的电压,使散点图的中的点都集中在所圈的门中。(若散点偏右,则FSC电压过大,调整FSC电压使其变小,若散点偏上,则调整SSC使其变小。)当调整合适时点击“RECORD”记录数据。[/align][align=left]④计数完毕,调低流速,点击“unload”,选择第二个样品并重复第③步。[/align][align=left]⑤上样完毕之后,保存数据。[/align][align=left](4)关机步骤:[/align][align=left]①上一管clean液,高速冲2 min;再上一管去离子水,高速冲5 min;关闭液流,检查液路系统。[/align][align=left]②在“Cytometer”菜单中,选择“shutdown”,根据指示操作:取下70 m的喷嘴,超声清洗,安装闭合喷嘴(红色点朝上)。[/align][align=left]③把液路和气路连接到乙醇桶上,用乙醇冲洗(先拔气路再拔液路)。[/align][align=left]④装一管clean液,清洗上样针和流动池。[/align][align=left]完成上述步骤之后即可关闭界面。[/align][align=left][/align][font='times new roman'][size=16px]2.3数据处理:[/size][/font]将原始数据用Flowjo软件进行处理,得到散点图以及荧光强度直方图,接下来通过举例来说明数据如何分析:(1) 散点图分析:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026242555_5228_5413603_3.jpeg[/img][size=13px]数据处理分析散点图[/size][/align]该图为散点图,可以看出大体分为两个集团,散点图有两个集团说明体系中有两种细胞粒子,并且在该图片的左下角粒子较少,说明细胞碎片较少,在预处理时较好地保护了细胞的完整性。散点图中可以区分出整个上样的体系中主要含有两种大小的细胞颗粒,在预处理的过程中,无酶消化液的消化能力较弱,并且细胞团密度较大,细胞间黏连较多,在最后孵育结束用PBS进行重悬的时候仍然能够肉眼可见有白色细微絮状物。FSC值越大,代表颗粒的体积越大;SSC值越大,代表颗粒内部的复杂程度越高。故可初步判断,G1门中的颗粒为未消化完全的细胞团,而G2门中的颗粒为分散的单个细胞。(2) 直方图分析:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026243736_5071_5413603_3.jpeg[/img][size=13px]数据处理分析直方图[/size][/align]图中为G2门选中的样品的荧光强度,该图中有两个峰,横坐标10[font='times new roman'][size=16px]2[/size][/font]附近所产生的荧光峰可以判定是残留的细胞碎片,可视为背景值,横坐标10[font='times new roman'][size=16px]4[/size][/font]~10[font='times new roman'][size=16px]5[/size][/font]附近的峰代表四个适配体分别与细胞结合所产生的荧光强度,SYL3C-Aptamer结合偏移量最大,荧光较强,且高荧光事件次数较多,说明SYL3C-Aptamer与单个细胞的结合能力最强,并且G2门中的颗粒大多数为消化完全的单个细胞,呈现出较好的特异性。总之,该组结果对比体现出,单个细胞靶点较多,适配体与单个细胞结合能力较高,通过荧光强度波峰的偏移所反映的适配体与细胞特异性结合能力的大小依次为SYL3C-Aptamer>EP166-Aptamer>CA2-Aptamer>ARC1172-Aptamer。同时,由图中可以看出:10th-ssDNA pool与SYL3C-Aptamer在10[font='times new roman'][size=16px]4[/size][/font]~10[font='times new roman'][size=16px]5[/size][/font]荧光强度波峰较高,说明二者与单个细胞的结合能力较好,结合位点较多,呈现良好的特异性和亲和性。SYL3-Aptamer荧光波峰明显右移,与单个细胞的结合位点较多。[font='times new roman'][size=16px]三、总结[/size][/font]本次说明旨在利用带荧光的适配体靶向特异性结合目的细胞的原理,利用流式细胞仪监测适配体结合靶细胞能力的强弱,同时还可以应用于不同适配体靶向同一种细胞的结合能力强弱的比较。进一步利用流式细胞仪,还可以测定适配体的Kd值;还可以根据预处理的条件不同,与对照组比较,来测定适配体靶向细胞的受体是位于细胞膜表面还是细胞内,从而进一步测定适配体的生物学稳定性。同时,流式细胞仪还有很多方面的应用,例如鉴定细菌、检测细胞凋亡等,一些抗体-细胞复合物的结合情况也能够由流式细胞仪来进行监测。 在进行流式上样的过程中,预处理、上样以及数据处理阶段都有需要注意的细节,例如:本次所使用的细胞为贴壁生长的内皮细胞,故在细胞预处理时需要先消化细胞;在进行上样前,需要将样品进行吸打混匀,以免细胞沉积在流式管底部,导致未吸取到样品;在应用流式细胞仪的过程中,使用前的维护、质控流程十分重要,该流程会直接影响所得数据的稳定性;不同的流式细胞仪的维护程序稍有不同,本次说明中的使用方法只适用于BD FACSAria III,流式细胞仪具有强大的分析功能,其在细胞研究中具有重要的作用。[align=left][/align][align=left][/align][align=left][/align][align=left][/align]
[font=宋体][font=宋体]在生物学和医学研究中,细胞增殖是一个关键过程,对于理解生命活动的基本规律以及疾病的发病机理具有重要意义。随着科技的发展,流式细胞仪作为一种高效、灵敏的分析工具,广泛应用于细胞增殖的检测。流式细胞仪通过快速分析单个细胞,可以对细胞周期、细胞增殖活性、细胞凋亡等多个方面进行研究。本文将探讨流式细胞仪在检测细胞增殖方面的主要方法,包括但不限于溴脱氧尿苷([/font][font=Calibri]BrdU[/font][font=宋体])掺入法、细胞周期蛋白检测法以及细胞大小分析法等,以期为读者提供全面的技术应用概览。流式细胞仪检测细胞增殖方法:[/font][/font][b][font=宋体][font=Calibri]1[/font][font=宋体]、[/font][font=Calibri]3H[/font][font=宋体](氚离子)掺入法[/font][/font][/b][font=宋体][font=宋体]原理:是在细胞[/font][font=Calibri]DNA[/font][font=宋体]合成时,用[/font][font=Calibri]3H[/font][font=宋体]脱氧胸腺嘧啶核苷代替普通的脱氧胸腺嘧啶核苷掺入新合成的[/font][font=Calibri]DNA[/font][font=宋体]中,增殖的细胞因为掺入[/font][font=Calibri]3H[/font][font=宋体]而具有放射性,通过定量检测样品细胞的放射性大小而反映细胞的增值活性[/font][/font][font=宋体][font=宋体]缺点:[/font][font=Calibri]1[/font][font=宋体])使用的是具有放射性的同位素,操作较为复杂,同时需要采取放射性保护措施 [/font][font=Calibri]2[/font][font=宋体])低比例高活跃增殖和高比例低活跃增殖可能得到的是相同的结果,用此方法无法进行鉴别 [/font][font=Calibri]3[/font][font=宋体])此方法无法进一步得到具有活性的增值细胞用于下一步的研究 [/font][font=Calibri]4[/font][font=宋体]) 此方法时间较短,无法检测加入前细胞的增殖情况,而且检测到放射性只能说明细胞[/font][font=Calibri]DNA[/font][font=宋体]合成,而不能提供合成[/font][font=Calibri]DNA[/font][font=宋体]的细胞是否进入增殖阶段的信息[/font][/font][b][font=宋体][font=Calibri]2[/font][font=宋体]、相对计数法[/font][/font][/b][font=宋体]原理:将对照组和各实验组控制在相同条件下直接计数然后比较计数结果得到增殖结论[/font][font=宋体]注意点:[/font][font=宋体][font=宋体]对照组与实验组每种细胞所加浓度必须相同,每组至少设置[/font][font=Calibri]3[/font][font=宋体]个复孔,这样每个孔可以得到[/font][font=Calibri]1[/font][font=宋体]个细胞数,将[/font][font=Calibri]3[/font][font=宋体]个复孔取平均值后就是这个组的结果。如果同时需要得到每孔目标细胞增殖后的绝对参数,在每孔细胞中加入[/font][font=Calibri]1*105PE[/font][font=宋体]标记的人工微球作为内参[/font][/font][font=宋体] [/font][font=宋体][font=宋体]收集各组的细胞于[/font][font=Calibri]EP[/font][font=宋体]管中,注意必须尽量将各组的所有细胞都收集起来。标记需要计数细胞的标志表型的荧光素偶联抗体,[/font][font=Calibri]4[/font][font=宋体]℃静置[/font][font=Calibri]30min[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]PBS[/font][font=宋体]洗涤一次,洗去游离的抗体[/font][/font][b][font=宋体][font=Calibri]3[/font][font=宋体]、示踪染料标记法[/font][/font][/b][font=宋体][font=宋体]示踪染料与细胞结合的方式:[/font][font=Calibri]1[/font][font=宋体])能够与细胞内的蛋白质上的氨基发生非特异性的共价结合 [/font][font=Calibri]2[/font][font=宋体])能够非特异性地嵌入细胞膜的脂质双分子层中与细胞发生非共价性结合[/font][/font][font=宋体] [/font][font=宋体][font=宋体]原理:示踪染料的荧光信号都很强,当细胞分裂时,母细胞内的染料会被平均分配到子细胞中,细胞荧光信号会被减弱一半,所以通过检测减弱的、发射示踪染料荧光信号的细胞比例就可以判断细胞增殖的强弱。当荧光强度减弱到标记时的[/font][font=Calibri]1/2[/font][font=宋体]以及以下的细胞都是增殖后的细胞,这些细胞所占比例越高则代表细胞增殖越活跃[/font][/font][font=宋体] [/font][font=宋体]标记方法:[/font][font=宋体][font=宋体]①纯化增殖反应的目标细胞,将细胞的浓度调整为[/font][font=Calibri]1*106/ml[/font][font=宋体],加入[/font][font=Calibri]CFSE[/font][font=宋体],其标记浓度为[/font][font=Calibri]5[/font][font=宋体]微摩尔[/font][font=Calibri]/[/font][font=宋体]升。置于[/font][font=Calibri]37[/font][font=宋体]℃水浴中标记[/font][font=Calibri]15min[/font][font=宋体],在标记过程中每隔一段时间混匀细胞一次[/font][/font][font=宋体] [/font][font=宋体][font=宋体]②加入预冷、含有血清的培养基终止标记,在[/font][font=Calibri]4[/font][font=宋体]℃冰箱中静置[/font][font=Calibri]5min[/font][font=宋体],离心沉淀[/font][/font][font=宋体] [/font][font=宋体][font=宋体]③用培养基再洗涤一次,尽量洗净未结合的游离的[/font][font=Calibri]CFSE[/font][font=宋体],然后将目标细胞静置在增殖体系中[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]4[/font][font=宋体]、[/font][font=Calibri]BrdU[/font][font=宋体]和[/font][font=Calibri]EdU[/font][font=宋体]掺入法[/font][/font][/b][font=宋体][font=Calibri]BrdU[/font][font=宋体]:[/font][font=Calibri]5-[/font][font=宋体]溴脱氧尿嘧啶核苷是胸腺嘧啶核苷的类似物,其特点是胸腺嘧啶环上[/font][font=Calibri]5[/font][font=宋体]位[/font][font=Calibri]C[/font][font=宋体]连接的甲基被溴取代,在细胞增殖[/font][font=Calibri]DNA[/font][font=宋体]合成时可以与内源性的胸腺嘧啶核苷竞争掺入到新合成的[/font][font=Calibri]DNA[/font][font=宋体]中,而[/font][font=Calibri]BrdU[/font][font=宋体]抗体可以特异性的识别[/font][font=Calibri]BrdU[/font][font=宋体],不与胸腺嘧啶核苷结合,所以可以用于检测细胞增殖[/font][/font][font=宋体][font=宋体]适用范围:适用于体内检测目标细胞的增殖,一般将[/font][font=Calibri]BrdU[/font][font=宋体]掺入小鼠的应用水中或经腹腔注射,经过一段时间后,取出目标细胞制成单细胞悬液然后用多聚甲醛固定细胞,后用打孔剂皂苷在细胞膜上打孔,最后标记荧光素偶联抗[/font][font=Calibri]BrdU[/font][font=宋体]抗体,目标细胞的[/font][font=Calibri]BrdU[/font][font=宋体]阳性细胞就是增殖的细胞,阳性比例越高,增殖越活跃。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]5[/font][font=宋体]、其他方法[/font][/font][/b][font=宋体][font=宋体]细胞周期法检测细胞增殖:流式细胞术能够检测细胞内[/font][font=Calibri]DNA[/font][font=宋体]的含量,所以可以检测细胞周期。处于[/font][font=Calibri]S[/font][font=宋体]期的细胞,[/font][font=Calibri]DNA[/font][font=宋体]的量处于二倍体和四倍体之间[/font][font=Calibri] [/font][font=宋体]处于[/font][font=Calibri]G2/M[/font][font=宋体]期时,[/font][font=Calibri]DNA[/font][font=宋体]量为四倍体。处于[/font][font=Calibri]S[/font][font=宋体]期和[/font][font=Calibri]G2/M[/font][font=宋体]期的细胞比例越高说明细胞增殖越活跃[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]PCNA[/font][font=宋体]检测细胞增殖:[/font][font=Calibri]PCNA[/font][font=宋体](增殖细胞核抗原),在细胞核合成且只存在于细胞核内,是[/font][font=Calibri]DNA[/font][font=宋体]聚合酶的辅助蛋白,所以与细胞[/font][font=Calibri]DNA[/font][font=宋体]的合成关系密切,是反映细胞增殖状态的良好指标[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Ki-67[/font][font=宋体]检测细胞增殖:是一种与细胞增殖特异相关的核抗原[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]CD71[/font][font=宋体]检测细胞增殖:是转铁蛋白受体,表达于细胞的表面,该受体广泛表达于各种恶性肿瘤细胞表面,正常细胞表达较少,与肿瘤细胞的增殖密切相关[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测技术服务[/b][/url],更多关于流式细胞仪检测细胞增殖详情欢迎咨询,详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]