推荐厂家
暂无
暂无
 银牌1年
银牌1年
 400-860-5168转6196
400-860-5168转6196
 留言咨询
留言咨询
 金牌1年
金牌1年
 400-860-5168转6165
400-860-5168转6165
 留言咨询
留言咨询
 留言咨询
留言咨询

 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转4551
400-860-5168转4551
 留言咨询
留言咨询



用葡聚糖凝胶除蛋白溶液中的盐,很难过下去,有什么办法啊
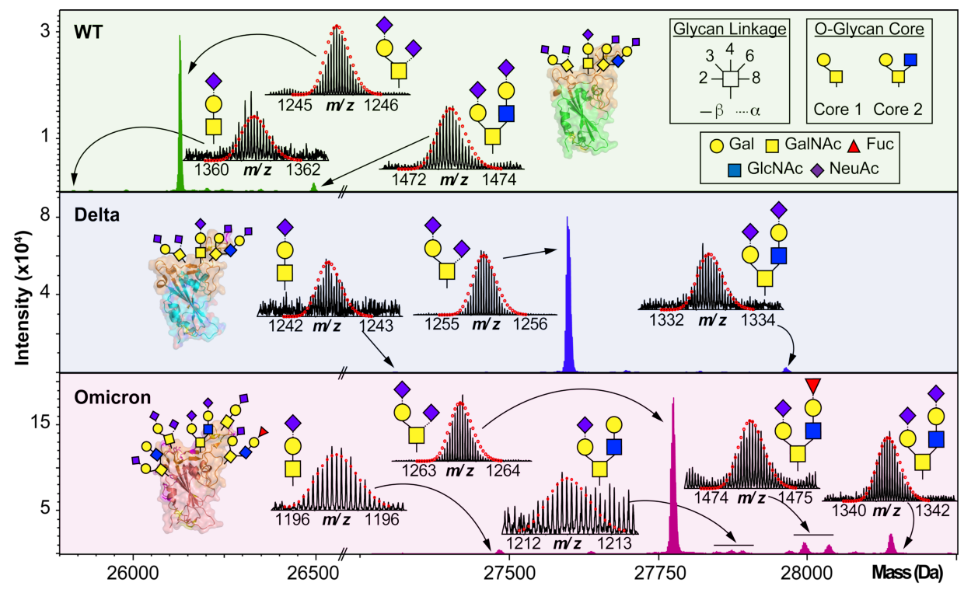
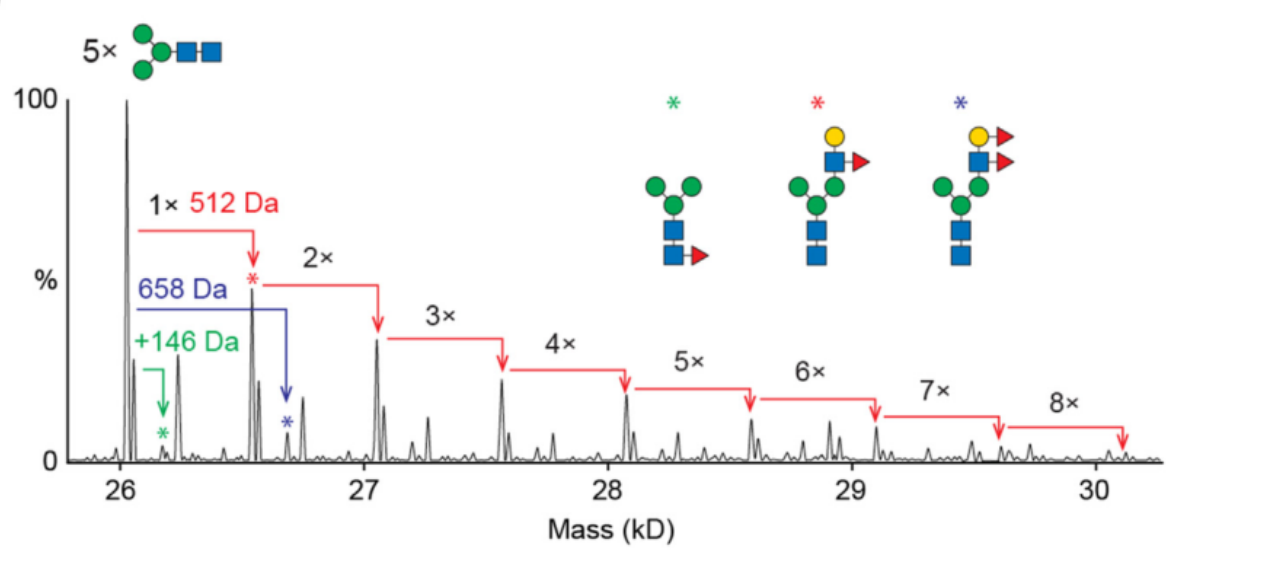
糖肽是什么包含一个叫做聚糖的碳水化合物的多肽(氨基酸分子)被称为糖肽(Glycopeptides)。由于聚糖在所有生物体细胞中无所不在,并且糖肽有保持健康和防止疾病作用,糖生物学领域出现了分子等方面的研究。【合肥国肽生物】此外,还开发出治疗某些感染类型的糖肽类抗生素。糖肽是通过肽合成过程生产出来的。在此过程中,聚糖绑定多肽,并与其它聚糖结合氨基酸联系在一起,直到产生一个链。新产生的多肽随后通过糖基化绑定蛋白质和脂质。这一酶催化过程让糖肽影响细胞之间的生化沟通。因此,这些多肽在生物体生命过程中有很重要的生物学作用。细胞产生皮肤和有机组织,并有抵御疾病,帮助身体保持体内平衡等作用。糖生物学试图确定糖肽的分子结构,并进一步探索这些多肽在与人体其它相关细胞和分子中的功能。通过确定糖肽结构,进一步了解它们的机制,糖生物学领域工作者能生产出有助于促进健康和延长寿命的治疗方法。例如,糖肽包含一种特质-在癌细胞扩散前必须被分解;因此,了解糖肽结构能让科学家创造一种防止糖肽变质和抑制癌细胞扩散的方法。糖肽抗生素是一种专门开发出来用于抵御特定类型细菌(对青霉素等常见治疗形式抵抗)的抗生素。例如,万古霉素就是一种常见的糖肽类抗生素,可用于治疗肠道发炎。这种疾病通常是由肠道有害细菌导致,而万古霉素能杀死这些细菌。不过,从糖肽提取的抗生素没有抵御病毒感染的功效。这些药物通常通过静脉注射,或口服药片治疗肠道感染。由于糖肽类药物一般被视为抵抗菌株的最后治疗手段,在病人开始感觉好转的情况下也应坚持完整个疗程。否则,再次感染会加剧,并且更难治疗。糖肽抗生素并非没有副作用。如果大剂量给予,这种药会导致皮疹,或通过呼吸道肌肉收紧而干扰呼吸。糖肽连键的主要类型有两种:一,N-糖肽键,是指β-构型的N-乙酰葡糖胺异头碳与天冬酰胺的γ-酰胺N原子共价连接而成的N-糖苷键。二,O-糖肽键,是指单糖的异头碳与羟基氨基酸的羟基O原子共价结合而成的O-糖苷键。我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:17718122172;17718122684;17730030476;17718122397多肽及蛋白质的人工合成多肽及蛋白质的人工合成,指以氨基酸为原料,用化学方法合成多肽或蛋白质。以氨基酸为原料,用化学方法合成多肽或蛋白质。其目的是:①确证天然多肽或蛋白质的结构;②生产天然的、在生物体内含量极微但有医疗或其他生物效用的多肽;③改变部分结构,研究其结构与功能的关系,并设计更有效的药物。
【序号】:3【作者】: 张立彦焦文娟包丽坤【题名】:三种离子物质对壳聚糖/果胶聚电解质复合物牛血清蛋白释放特性的影响【期刊】:现代食品科技. 【年、卷、期、起止页码】:2015,31(01)【全文链接】:https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CJFD&dbname=CJFDLAST2015&filename=GZSP201501008&uniplatform=NZKPT&v=ivma19ZMvHJaZIHyKyZR30CRPGu_zXf0CQAbNA5bBl48WAinaKwsKcGGTr_Z_rV2