表面活性剂与血红蛋白的作用中对转移电子数的影响检测方案(电化学工作站)
检测样品 其他
检测项目 对转移电子数的影响
方案详情文
智能文字提取功能测试中
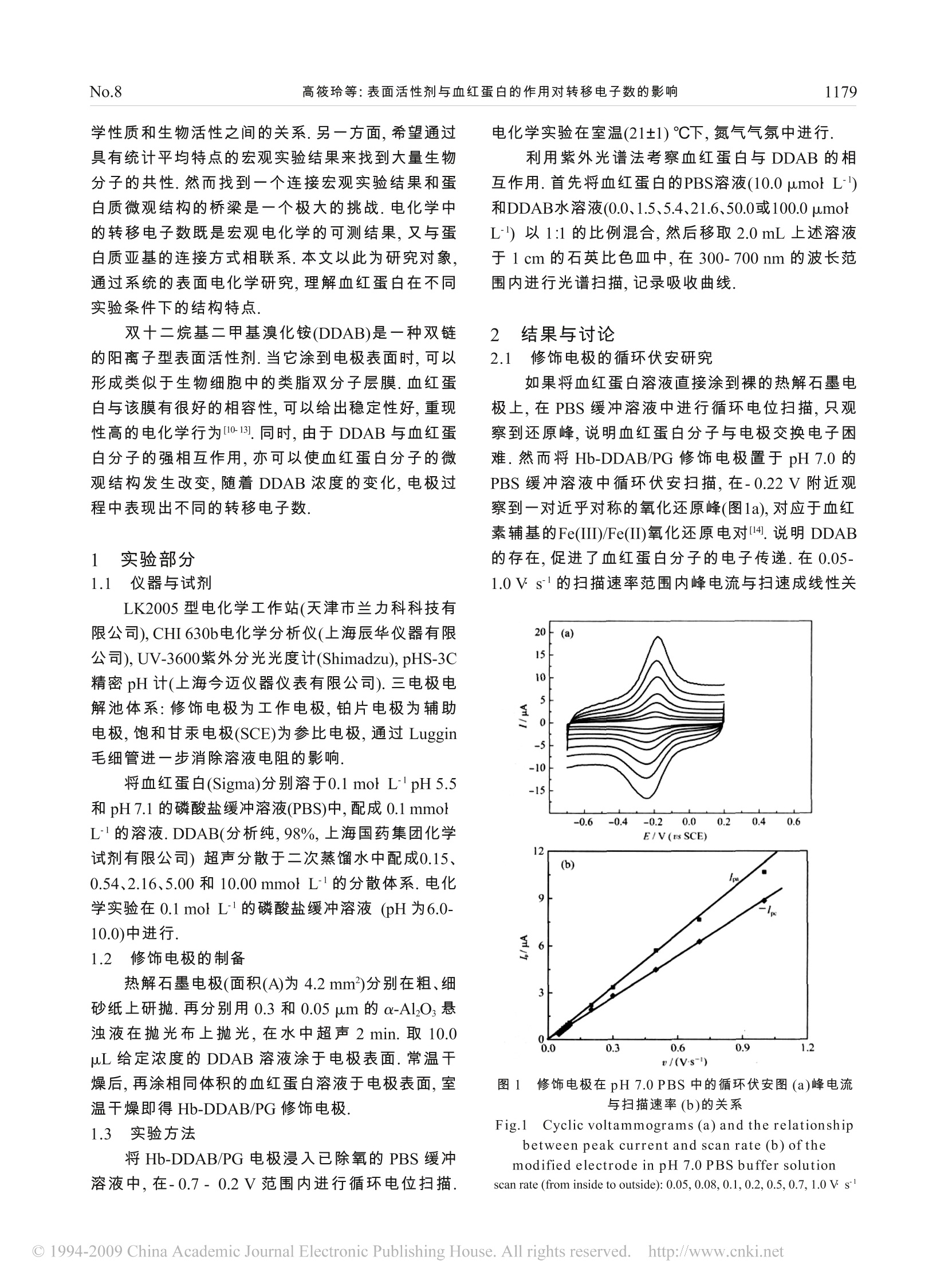
物理化学学报(Wuli Huaxue Xuebao)Acta Phys. -Chim. Sin.,2007,23(8):1178-11821178August 1179No.8.高筱玲等:表面活性剂与血红蛋白的作用对转移电子数的影响 表面活性剂与血红蛋白的作用对转移电子数的影响 高筱玲1 郭 彦2 田燕妮 赵健伟2* ('山西大学分子科学研究所,太原 030006: 2南京大学化学化工学院,生命分析化学教育部重点实验室,南京 210008) 摘要: 将不同浓度(0.15-10.0mmol·L-)的双十二烷基二甲基溴化铵(DDAB)和血红蛋白(Hb)依次修饰到热解石墨电极(PG)上,制备了稳定的Hb-DDAB/PG电极.利用循环伏安和紫外光谱研究了Hb-DDAB/PG电极的性质由Laviron模型得到的转移电子数表明该电化学反应由双电子过程逐步过渡到单电子过程,进而证明DDAB膜厚的增加导致血红蛋白亚基间作用的减弱和亚铁血红素的释放. 关键词: 血红蛋白; 双十二烷基二甲基溴化铵; 表面电化学; 转移电子数 中图分类号: O646 Influence of Surfactant on the Apparent Electron TransferNumber of Hemoglobin GAO Xiao-Ling GUO Yan广 TIAN Yan-Ni· ZHAO Jian-Wei (Institute ofMolecular Science, Shanxi University, Taiyuan030006, P. R. China;;Key Laboratory of AnalyticalChemistry for Life Science ofthe Ministry ofEducation, College of Chemistry and Chemical Engineering,Nanjing University, Nanjing2210008,P.R. China) Abstract: A modified electrode was prepared by sequential dropping didodecyldimethylammonium bromide(DDAB) with different concentrations and hemoglobin (Hb) solution on pyrolytic graphite (PG) electrode. Theelectrochemical property of the modified electrode was studied by cyclic voltammetry and UV spectrum. The dataanalyzed with Laviron model showed that with increasing the DDAB concentration, the thickness of films increasedand the heme was released from hemoglobin, so the electrochemical reaction changed from a double-electron processto a single-electron process. Key Words: Hemoglobin;; Didodecyldimethylammonium bromide;;Surface electrochemistry;;Electrontransfer number 生物大分子的直接电化学一直是生物电化学研究的热点.晶体结构分析证实,血红蛋白(Hb,相对分子质量为67000)是由4个肽链通过共价键结合而成的一种寡聚蛋白质,在生物体内起存储和运输氧气的作用1.2,其所含的辅基血红素能发生得失电子的反应.一般认为,在血红蛋白中血红素被肽链包裹,使得血红素不易接近电极表面;另一方面,蛋白质溶液中的杂质也可以在电极表面吸附从而阻碍直接电 子转移.近年来人们借助修饰电极技术来促进血红蛋白的电子转移反应,阐述其电化学特性[4-6],期望从电化学的结果来理解生物大分子的生物学行为.从分子水平阐述蛋白质的生物活性是目前化学生物学中最活跃的课题之一,我们力图从两种方法来开展这方面的工作.其一,直接建立分子水平的实验方法,利用导电的扫描探针显微镜为工具,通过在纳米尺度针尖上进行蛋白质修饰7-9,考察其电学性质、力 ( Received: January 9, 2007; Revised: A pril 28, 2007; Published on Web: J une 18,2 0 07. ) ( C orresponding authors. Email: tianyann@sxu.edu.cn,zhaojw@nju.edu.cn; Tel:+86 2 5-83596523. ) ( 山西省回国留学人员基金,山西省自然科学基金(2006011016),国家自然科学基金(20503012,20435010)资助项目 ) 学性质和生物活性之间的关系.另一方面,希望通过具有统计平均特点的宏观实验结果来找到大量生物分子的共性.然而找到一个连接宏观实验结果和蛋白质微观结构的桥梁是一个极大的挑战.电化学中的转移电子数既是宏观电化学的可测结果,又与蛋白质亚基的连接方式相联系.本文以此为研究对象,通过系统的表面电化学研究,理解血红蛋白在不同实验条件下的结构特点. 双十二烷基二甲基溴化铵(DDAB)是一种双链的阳离子型表面活性剂.当佗涂到电极表面时,可以形成类似于生物细胞中的类脂双分子层膜.血红蛋白与该膜有很好的相容性,可以给出稳定性好,重现性高的电化学行为110-13].同时,由于DDAB 与血红蛋白分子的强相互作用,亦可以使血红蛋白分子的微观结构发生改变,随着 DDAB 浓度的变化,电极过程中表现出不同的转移电子数. 1 实验部分 1.1 仪器与试剂 LK2005型电学学工作站(天津市兰力科科技有限公司), CHI 630b电化学分析仪(上海辰华仪器有限公司), UV-3600紫外分光光度计(Shimadzu), pHS-3C精密 pH计(上海今迈仪器仪表有限公司).三电极电解池体系:修饰电极为工作电极,铂片电极为辅助电极,饱和甘汞电极(SCE)为参比电极,通过 Luggin毛细管进一步消除溶液电阻的影响. 将血红蛋白(Sigma)分别溶于0.1 mol·L'pH5.5和pH 7.1的磷酸盐缓冲溶液(PBS)中,配成0.1 mmol·L的溶液.DDAB(分析纯,98%,上海国药集团化学试剂有限公司)超声分散于二次蒸馏水中配成0.15、0.54、2.16、5.00和10.00 mmol·L'的分散体系.电化学实验在 0.1 mol·L的磷酸盐缓冲溶液 (pH为6.0-10.0)中进行. 1.2 修饰电极的制备 热解石墨电极(面积(A)为 4.2 mm²)分别在粗、细砂纸上研抛.再分再用0.3和0.05 um 的α-AlO;悬浊液在在光布上布光,在水中超声2 min.取 10.0uL给定浓度的 DDAB 溶液涂于电极表面.常温干燥后,再涂相同体积的血红蛋白溶液于电极表面,室温干燥即得 Hb-DDAB/PG修饰电极. 1.3 实验方法 将 Hb-DDAB/PG 电极浸入已除氧的 PBS 缓冲溶液中,在-0.7-0.2V范围内进行循环电位扫描. 电化学实验在室温(21#)℃下,氮气气氛中进行. 利用紫外光谱法考察血红蛋白与 DDAB 的相互作用.首先将血红蛋白的PBS溶液(10.0 umol·L-)和DDAB水溶液(0.0、1.5、5.4、21.6、50.0或100.0 umol·L-)以11的比例混合,然后移取2.0 mL 上述溶液于1cm的石英比色皿中,在300-700 nm的波长范围内进行光谱扫描,记录吸收曲线. 2 结果与讨论 2.1 修饰电极的循环伏安研究 如果将血红蛋白溶液直接涂到裸的热解石墨电极上,在PBS 缓冲溶液中进行循环电位扫描,只观察到还原峰,说明血红蛋白分子与电极交换电子困难.然而将 Hb-DDAB/PG 修饰电极置于pH 7.0的PBS 缓冲溶液中循环伏安扫描,在-0.22V附近观察到一对近乎对称的氧化还原峰(图1a),对应于血红素辅基的Fe(III)/Fe(II)氧化还原电对4.说明DDAB的存在,促进了血红蛋白分子的电子传递.在0.05-1.0V·s的扫描速率范围内峰电流与扫速成线性关 图1 修饰电电在pH 7.0PBS 中的循环伏安图(a)峰电流与扫描速率(b)的关系 Fig.1 Cyclic voltammograms (a) and the relationshipbetween peak current and scan rate (b) of the modified electrode in pH 7.0 PBS buffer solutionscan rate (from inside to outside): 0.05,0.08,0.1,0.2,0.5,0.7,1.0V.s 系(见图1b),表现了典型的表面吸附物种的电化学行为[15].根据T=Q/nFA, n=4时计算得到血红蛋白的表面浓度为(6.5+0.9)×10mol·cm. 2.2 不同浓度的DDAB 对血红蛋白直接电化学的影响 用循环伏安法对不同浓度的 DDAB 修饰膜与血红蛋白的相互作用进行了研究.图2给出了在相同的电极上,预先溶于pH 5.5 的 PBS中的血红蛋白的电子传递速率常数与 DDAB浓度的关系.随着DDAB 浓度的增加,溶液状态由胶束向微囊过渡[16,这样在电极表面形成的双分子层结构可能更有利于抑制血红蛋白分子中大分子杂质在电极表面的吸附或形成更加致密有序的修饰膜.从而增大了电极表面的电子转移速率常数,但 DDAB 的浓度在约5mmol·L以上时, DDAB 对电子传递的促进不仅不再明显,反而有抑制的倾向.该现象可能是因为高浓度 DDAB 对血红蛋白结构的破坏, DDAB 浓度的增加导致了膜厚的增加,进而与血红蛋白分子的作用增强;血红蛋白分子在一定范围内的形变可以促进电子传递,然而更强的作用使分子结构变化过于剧烈,可能导致蛋白质的电化学活性中心失去作用,从而降低电子传递速率图,具体原因将在下面进一步进行分析. 进一步研究了溶解在 pH 5.5和pH 7.1的 PBS中的血红蛋白与给定浓度的 DDAB的相互作用,并用Laviron 模型计算了血红蛋白在电极表面的转移电子数(如图3所示).结果果明,随着 DDAB 浓度的增大,溶于 pH 5.5的 PBS 中的血红蛋白的转移电子数由2逐步向1过渡,表明该蛋白质的电极过程经历了由双电子过程到单电子过程的变化;而溶于 pH 图2 溶于pH 5.5 PBS中的Hb 在不同浓度的 DDAB膜中的电子传递速率常数(k)曲线 Fig.2 Plot of heterogeneous electron transfer rateconstants (k) against DDAB concentration 图3 Hb 在不同浓度的 DDAB 膜中的电子转移数曲线 Fig.3 Plots of the number ofelectron transfer againstDDAB concentration (a) Hb dissolved in pH 5.5 PBS; (b) Hb dissolved in pH 7.1 PBS 7.1的 PBS中的血红蛋白的转移电子数基本不变,表现了较为理想的单电子过程.血红蛋白分子有四个亚基,但电化学行为并没有直接反映出4电子反应的电极过程.这说明亚基之间的电子传递速率与电极到亚基之间的电子传递速率相当.由低浓度时转移电子数为2的实验结果,我们推测电极分别同血红蛋白中的两个亚基传递电子,然后以这两个亚. 基为中心进而向另两个亚基扩散,总体上表现了双电子的过程.随着 DDAB 浓度的增加,不仅观察到了表观转移电子数降低,而且在与电化学实验一致的条件下薄膜紫外吸收光谱也观察到高浓度的DDAB 使蛋白的吸收峰发生蓝移.这些结果说明DDAB影响了血红蛋白亚基之间的作用,使得它们之间的连接更为松散,从而阻碍了亚基之间的电子传递,导致表观转移电子数的降低. 2.3 Hb-DDAB/PG修饰电极对电荷传输的阻碍 为了阐述图2中表观电子传递速率常数与DDAB 浓度的变化关系,以2 mmol·LFe(CN)。为探针,进一步考察 DDAB 膜对电子传递的阻碍.由图4可见,探针分子的氧化还原峰电流随 DDAB 浓度的增加而明显变小,同时峰电位差也随之增大,但当浓度增大到5 mmol·L时,膜厚对其电子传递的影响基本趋于稳定.高浓度的 DDAB 溶液可以使电极表面形成更厚、更致密的修饰膜,它有效地阻挡了探针分子在电极表面的电化学反应,这一结果表明膜厚对表观电子传递速率常数是有影响的.此外由图4(b)可知,当DDAB 的浓度低于5mmol·L-时,峰电流的降低与 DDAB 浓度的增加近似呈线性关系.这意味着电荷在 DDAB 膜中的传输更可能以扩散方式为主. 图4 铁氰化钾在不同的修饰电极上的循环伏安曲线(a)及峰电流与 DDAB 浓度的关系(b) Fig.4 Cyclic voltammograms (a) and the relationshipbetween peak current and (b)DDAB contrations of Fe (CN)。 at different modified electrodes(A) Hb, (B) 0.15 mmol·LDDAB+Hb, (C) 2.16 mmol·LDDAB+Hb, (D) 5.00 mmol·LDDAB+Hb, (E) 10.00 mmol·L"DDAB+Hb;scan rate: 100 mV·s 2.4 不同浓度 DDAB 与血红蛋白作用的紫外吸收光谱性质 实验表明,溶于 pH 5.5的 PBS中的血红蛋白在406 nm处有一个吸收峰(如图5所示),当加入 DDAB后,该吸收峰不仅明显减小,而且峰位也略有蓝移.Koper 研究了肌红蛋白,观察到类似的结果,并认为在DDAB的作用下,亚铁血红素从蛋白质中释放出来[18,19吸光度的差异表明了亚铁血红素在不同浓度DDAB的作用下释放程度不同.当浓度低时, DDAB结合血红蛋白的程度小,只有部分亚铁血红素释放,此时有较高的吸光度.当 DDAB 的浓度逐渐增大时,它与血红蛋白间的相互作用增强,导致有较多的亚铁血红素释放,吸光度也随之降低.这一现象与电化学实验中转移电子数的变化给出了一致的信息,即不同浓度的 DDAB 与血红蛋白相互作用强弱不同,因而造成其转移电子数的不同. 2.5 pH对血红蛋白电化学行为的影响 在实验的pH范围(6.0-10.0)内,给定浓度的DDAB 图5 Hb(10.0 umol·L-I)在不同浓度 DDAB 溶液中的UV吸收曲线 Fig.5UV spectra of Hb (10.0 umol·L-) in DDABsolution with different concentrations c(DDAB)/(umol·L): a) 0.0, b) 1.5, c) 21.6, d) 50.0, e) 100.0; pH=5.5 膜中的血红蛋白均能得到稳定可逆的氧化还原峰,式电位随pH 值的增加而负移,这种现象与水分子以及血红素周围氨基酸的质子化作用有关,在蛋白质分子中同时存在着氧化还原中心和质子化位点,电子传递伴随质子转移的反应,会改变氧化态或还原态中心离子与质子化过程的静电作用,表现形式为氧化还原峰电势随溶液 pH值的增加而负移.溶于 pH 5.5 的 PBS中的血红蛋白在浓度为0.15mmol·L的 DDAB 的膜中时,在 pH 6.0-10.0 范围内,E,与pH值之间存在线性关系,斜率为-34.1mV/pH(如图6所示),略小于单电子单质子反应理论值(-59.0mV/pH)的一半[20.当 DDAB的浓度增大到2.16或10.0mmol·L-1时,其斜率为(-43#2)mV/pH,这意味着两种条件下的电化学反应伴随着不同的质子化作用.而溶于 pH 7.1 的 PBS 中的血红蛋白在改变 DDAB 浓度时,其斜率均在-40.0mV/pH附 图6 式电势E 与pH的关系图 Fig.6 Plots of E vs pH a) 0.15 mmol·LDDAB+Hb; b) 10.00 mmol·LDDAB+Hb;pH=5.5 .近,这些结果均说明质子化作用不是一个简单过程,可能受到血红素轴向配位基团和水合铁离子质子化作用的共同影响21. 3 结 论 用循环伏安和紫外光谱研究了血红蛋白在不同浓度的 DDAB 修饰电极上的电化学行为.结果表明,随着 DDAB 浓度的增大,溶于 pH 5.5的PBS中的血红蛋白的转移电子数由2逐步向1过渡,表明该蛋白质的电极过程经历了由双电子过程到单电子过程的变化;而溶于 pH 7.1 的 PBS中的血红蛋白的转移电子数基本不变,表现了理想的单电子过程,结合紫外光谱数据,我们认为DDAB 膜厚的增加导致血红蛋白亚基间作用的减弱和亚铁血红素的释放,因而造成其在电极表面的转移电子数的不同. ( References ) ( 1 W eissbluth, M. M olecular Biology: Biochem. B iophys., 1974, 15: 68 ) ( 2 G abbianelli,R.; Santroni, A. M. ; Fedeli, D.; Kantar, A.; Falcioni, G.Biochem. Biophys. Res. Commun., 1 998,242: 560 ) ( 3 Armstrong,F. A. Bioinorg.Chem., 1990, 72 : 137 ) ( 4 Yang,J; Hu, N. F. Bioelectrochem. Bioenerg., 1 999,48: 1 17 ) ( 5 C ai, C. X.; C h en, J . E lectrochemistry, 2004, 10(2): 1 59 [ [蔡称心, 陈 静.电化学,2004,10(2):1 5 9] ) ( 6 H u , N . F .; Zeng, Y. H. Chemistry, 2001, (3): 152 [胡乃非,曾泳 淮.化学通报,2001,(3): 152] ) ( 7 Zhao,J . W.; Wang,N. Chem. J. Chin. Univ.,2005, 26: 751 [赵健伟,王 楠.高等学校化学学报,2005,26: 751] ) ( 8 Zhao, J. W.; Davis, J.J.; Sansom, M. S. P.; H u ng, A. J. Am. Chem. Soc . , 2004,126: 5 601 ) ( 9 Zhao, J. W.; D avi s , J. J. Colloid s Surf. B , 2005,40: 189 ) ( 10 Rusling, J. F. Acc. Chem. Res . ,1998 , 31:363 ) ( 11 L u , Z. Q.; Huang, Q. D .; Rusling, J. F.J. Electroanal. Chem., 1997,423:59 ) ( 12 N assar, A. E. F.; Willis, W. S .; Rusling, J. F. Anal. Chem., 1995, 67:2386 ) ( 13 Rusling, J. F.; Nassar, A. E . F. J . Am. Chem. Soc. , 1993, 1 15: 11891 ) ( 14 Liu, H . H .; T ian, Z. Q.; Lu, Z. X.; Pang, D. W. Biosen. Bioelectro., 2004,20:294 ) ( 15 L a viron, E . J. Electroanal. Chem.,1979 , 101: 1 9 ) ( 16 Ono, Y .;Kawasaki, H. ; Annaka, M.; Mae d a, H. J. C ol l oid Interface Sci.,2005,287:685 ) ( 17 Chattopadhyay,K.; M a zumdar, S. Bioelectrochemistry, 2 000,53:17 ) ( 18 de Groot,M. T.; Merkx, M .; Koper, M. T .M. J. Am. C hem. S oc., 2005,127:16224 ) ( 19 de G root, M. T .; Merkx, M.;Koper, M. T . M. Electrochem.Commun., 2006,8:999 ) ( 20 Bond, A. M. Modern polarographic methods in analyticalchemistry. New Y ork: Marcel Dekker, 1980: 2 7 ) ( 21 Yamazaki,I. ; Araiso, T.; Hayashi,Y. A dv. B iophys., 1 978, 11 : 2 4 9 ) O China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
关闭-
1/5

-
2/5
还剩3页未读,是否继续阅读?
继续免费阅读全文产品配置单
天津市兰力科化学电子高技术有限公司为您提供《表面活性剂与血红蛋白的作用中对转移电子数的影响检测方案(电化学工作站)》,该方案主要用于其他中对转移电子数的影响检测,参考标准《暂无》,《表面活性剂与血红蛋白的作用中对转移电子数的影响检测方案(电化学工作站)》用到的仪器有LK2005电化学工作站。
我要纠错
推荐专场
相关方案






 咨询
咨询