大黄酚和牛血清蛋白中电化学/ 光谱性质研究检测方案(电化学工作站)
检测样品 其他
检测项目 电化学/ 光谱性质研究
方案详情文
智能文字提取功能测试中
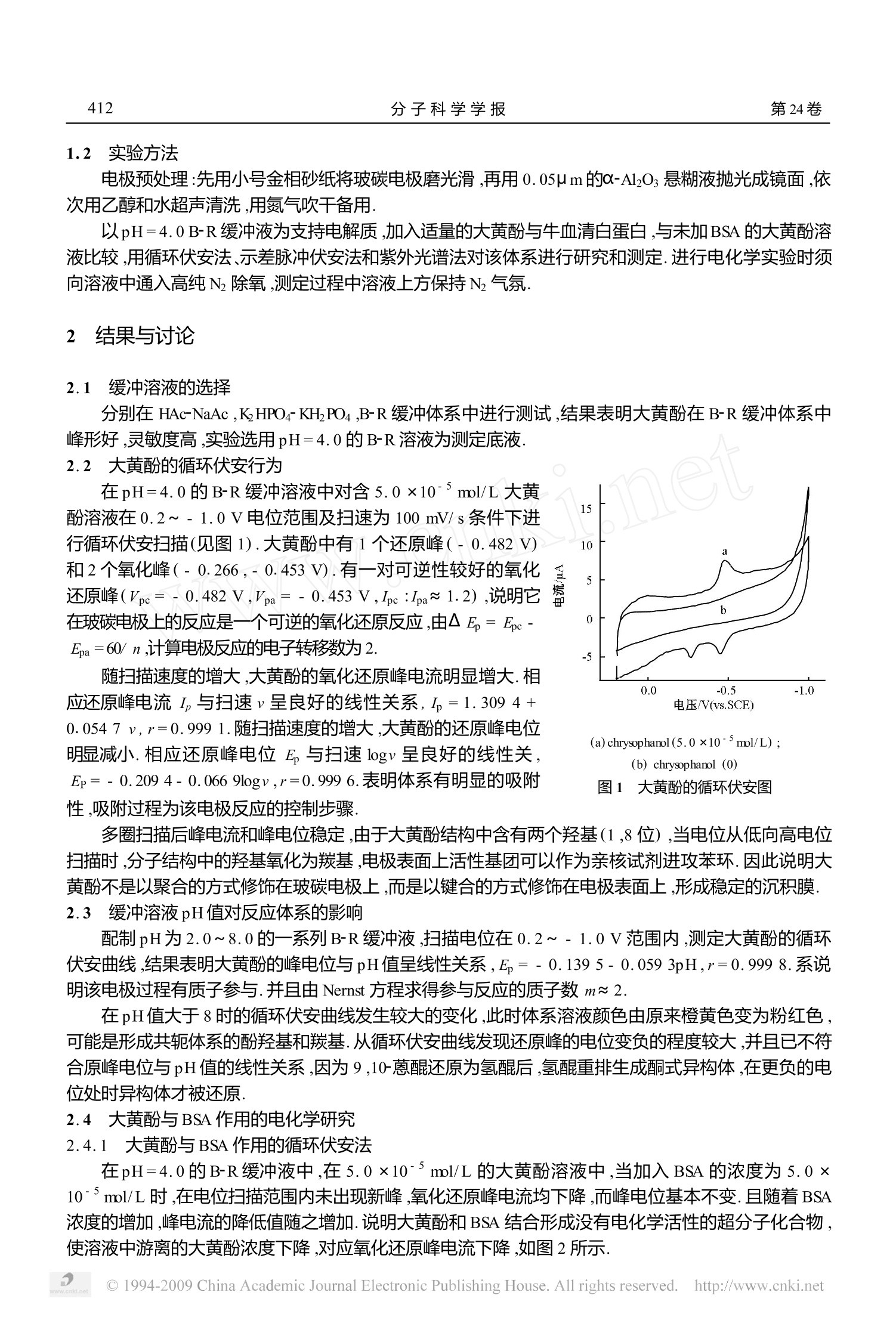
分 子 科 学 学 报JOURNAL0F MOLECULAR SCIENCE第24卷第6期2008年12月Vol.24 No.6December 2008 412分子科学学报第24卷 [文章编号]1000-9035(2008)06-0411-05 大黄酚和牛血清蛋白相互作用的电化学/光谱性质研究 李守君”:,方洪壮,武冬梅,孙长海,丁立新,赵志宇,单静影(佳木斯大学化学与药学院,黑龙江佳木斯154007) [摘 要1 在pH=4.0的 Britton-Robinson (B-R)缓冲体系中,应用循环伏安法、示差脉冲伏安法和紫外光谱法对大黄酚与牛血清白蛋白(BSA)相互作用的电化学/光谱性质进行研究.结果表明,二者结合生成了一种非电活性的超分子化合物.BSA的存在导致大黄酚氧化还原峰电流降低,峰电位基本不变,峰电流的下降值值所加入的BSA 浓度在一定范围内呈线性关系.线性范围为5.0×10-6~1.0×10~7mol/L,检出限为3 ×10~mol/L. [关键词]大黄;牛血清白蛋白;电化学;光谱 [中图分类号10611 [学科代码1 150 15 「文献标识码 A 在一定条件下,药物分子与蛋白质之间可通过分子间作用力形成超分子化合物1-3,考察蛋白质与药物分子的相互作用,对阐明生物大分子与小分子配体间相互作用机理和规律具有重要的意义1451.这种超分子化合物与小分子配体本身相比在电化学和光谱性质上有明显的变化,以此为基础建立许多蛋白质的分析方法6],但文献报道多以光谱法为检测方法.电分析化学法具有简单、快捷、高灵敏度和高选择性等特点,为蛋白质的生物电化学研究提供了重要的研究方法[8-13].大黄酚是中药大黄中的一种有效成分,属于蒽醌类衍生物[14],具有电化学氧化还原性质,对大黄酚与牛血清白蛋白(BSA)相互作用的研究尚未见报道.本文主要研究在酸性B-R缓冲溶液中大黄酚与BSA 相互作用的电化学/光谱性质,大黄酚修饰电极可望作为蛋白质的电化学探针用于蛋白质的测定. 1 实验部分 1.1 仪器与试剂 LK2005 电化学工作站(天津市兰力科化学电子高科技有限公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);UV757CRT型紫外-可见分光光度计(上海精密科技仪器公司);PB-20标准型pH计(德国赛多利斯股份公司);三电极系统:玻碳电极(GCE)为工作电极,饱和甘汞电极(SCE)为参比电极,铂丝电极为对电极. 大黄酚(ARS)(中国药品生物制品检定所),5.0 ×10'mol/L,使用时再进行稀释;牛血清白蛋白(BSA)(北京奥博星生物技术责任有限公司),相对分子质量为65000,1.0 ×104mol/L,4 ℃保存;Brit-ton-Robinson (B-R)系列缓冲液;高纯N2(99.99%);所用试剂均为分析纯,水为石英亚沸二次蒸馏水 ( 收稿日期:2008-07-23 ) ( 基金项目:黑龙江省自然科学基金资助项目(B200609),黑龙江省教育厅科技项目(10541221);佳木斯大学科技项目(L2007-89),黑龙 江省教育厅重点实验室项目. ) ( 联系人简介:李守君(1962-),教授,硕士研究生导师,主要从事生物电化学研究. ) ( Email:shoujun1962 @163. com ) 1.2 实验方法 电极预处理:先用小号金相砂纸将玻碳电极磨光滑,再用0.05 um的α-Al203悬糊液抛光成镜面,依次用乙醇和水超声清洗,用氮气吹干备用. 以pH=4.0B-R缓冲液为支持电解质,加入适量的大黄酚与牛血清白蛋白,与未加BSA的大黄酚溶液比较,用循环伏安法、示差脉冲伏安法和紫外光谱法对该体系进行研究和测定.进行电化学实验时须向溶液中通入高纯N除氧,测定过程中溶液上方保持N2气氛. 2 结果与讨论 2.1 缓冲溶液的选择 分别在 HAc-NaAc ,KHPO4-KH,PO4,B-R缓冲体系中进行测试,结果表明大黄酚在B-R缓冲体系中峰形好,灵敏度高,实验选用pH=4.0的B-R溶液为测定底液. 2.2 大黄酚的循环伏安行为 在pH=4.0的B-R缓冲溶液中对含 5.0 ×10-5mol/L大黄酚溶液在0.2~-1.0V电位范围及扫速为100 mV/s条件下进行循环伏安扫描(见图1).大黄酚中有1个还原峰(-0.482V)和2个氧化峰(-0.266,-0.453V).有一对可逆性较好的氧化还原峰(Vpc=-0.482V,Vpa=-0.453V,Ipe :Ipa~1.2),说明它在玻碳电极上的反应是一个可逆的氧化还原反应,由△E=Ec-Ea=60/n,计算电极反应的电子转移数为2. 随扫描速度的增大,大黄酚的氧化还原峰电流明显增大.相应还原峰电流I,与扫速v呈良好的线性关系,I=1.309 4+0.0547 v,r=0.999 1.随扫描速度的增大,大黄酚的还原峰电位明显减小.相应还原峰电位 E, 与扫速 logv呈良好的线性关,Ep=-0.209 4-0.066 9logv,r=0.999 6.表明体系有明显的吸附性,吸附过程为该电极反应的控制步骤. (a)chrysophanol(5.0×10-5mol/L);(b) chrysophanol(0) 图1 大黄酚的循环伏安图 多圈扫描后峰电流和峰电位稳定,由于大黄酚结构中含有两个羟基(1,8位),当电位从低向高电位扫描时,分子结构中的羟基氧化为羰基,电极表面上活性基团可以作为亲核试剂进攻苯环.因此说明大黄酚不是以聚合的方式修饰在玻碳电极上,而是以键合的方式修饰在电极表面上,形成稳定的沉积膜. 2.3 缓冲溶液pH 值对反应体系的影响 配制pH为2.0~8.0的一系列B-R缓冲液,扫描电位在0.2~-1.0V范围内,测定大黄酚的循环伏安曲线,结果表明大黄酚的峰电位与pH值呈线性关系,E,=-0.139 5-0.059 3pH,r=0.999 8.系说明该电极过程有质子参与.并且由 Nernst 方程求得参与反应的质子数m≈2. 在pH值大于8时的循环伏安曲线发生较大的变化,此时体系溶液颜色由原来橙黄色变为粉红色可能是形成共轭体系的酚羟基和羰基.从循环伏安曲线发现还原峰的电位变负的程度较大,并且已不不合原峰电位与pH值的线性关系,因为9,10-蒽醌原原为氨醌后,氢醌重排生成酮式异构体,在更负的电位处时异构体才被还原. 2.4 大黄酚与BSA 作用的电化学研究 2.4.1 大黄酚与BSA 作用的循环伏安法 在pH=4.0的B-R缓冲液中,在5.0×10mol/L的大黄酚溶液中,当加入BSA 的浓度为5.0×10'mol/L时,在电位扫描范围内未出现新峰,氧化还原峰电流均下降,而峰电位基本不变.且随着BSA浓度的增加,峰电流的降低值随之增加.说明大黄酚和BSA结合形成没有电化学活性的超分子化合物,使溶液中游离的大黄酚浓度下降,对应氧化还原峰电流下降,如图2所示. (a) cBsA=0;(b) CBSA=5.0 ×10-6mol/L (a) cBsA=0.625 ×10-6mol/L;(b) cBSA=1.250 ×10-6mol/L;(c)CBSA=2.500 ×10-6mol/L 图2 大黄酚与BSA作用的循环伏安图 图3 大黄酚与不同浓度 BSA作用的差分脉冲伏安图 2.4.2 大黄酚与BSA 作用差分脉冲伏安法 差分脉冲伏安法(diferential pulse voltammetry ,DPV)可提高灵敏度和选择性,我们采用DPV 法研究大黄酚与 BSA 相互作用的电化学行为见图3,大黄酚在pH=4.0的B-R缓冲液中,产生一个灵敏的还原峰峰电位为-0.459V.在溶液中加入一定量的BSA后还原峰电位几乎不变,而峰电流大大降低,峰电流的降低值同加入的BSA量在一定范围内呈线性关系,其线性回归方程为:AI=- 780+506c,r=0.9987(AI为大黄酚与大黄酚和BSA化合物电流的差值,单位 mA;c 为BSA的浓度,单位mol/L).检出限为3 ×10-7ml/L.对5×10-mol/L的BSA 进行7次平行测定,RSD为3%,因而可望用于 BSA的定量测定. 2.4.3 反应时间对体系的影响 大黄酚和BSA结合反应的速率很快,相互作用8 min 后峰电流基本稳定,并在3h内保持稳定. 2.4.4 参与电极反应的电子数、质子数和电极反应标准速率常数计算 电极反应电子数可由式1-3求得,大黄酚的电极反应电子数为2.大黄酚与BSA 相互作用后,应用同样的方法计算大黄酚的电极反应过程电子转移数也为2. 式中,◎为电量,S为峰面积,v为扫描速度,「为吸附量. 固定大黄酚和BSA的浓度,改变B-R缓冲溶液的pH值,以相应pH 值的大黄酚溶液作参比,考察溶液酸度对加入BSA 后大黄酚峰电流和峰电位的影响.结果表明pH值的大小对两者相互作用有较大的影响,pH=4.0时二者峰电流有最大的差值,相互作用最强,因此实验选取pH=4.0的B-R缓冲溶液.在不同pH值条件下,引入BSA后的循环伏安图有共同特点,即在扫描电位范围内均未出现新峰,峰电位基本不变,而峰电流却有不同程度的降低.随着溶液pH值的增大,峰电位E负移,其线性回归方程为:E,=-0.142 1-0.061 5pH,r=0.9985,由2.3方法计算得电极反应质子为2. 由峰电位随扫描速度的变化,可得电极反应的电荷转移系数α和表面电极反应标准速率常数k,151.当 nE,>200 mV时, 分别将还原峰电位 Ec氧化峰电位 Ea对扫描速度的对数 logv作图,可获得两条直线,由直线的斜 率求得α值.k,由(6)公式计算: 文献[16]报道对于大多数反应体系0值在0.3~0.7之间.本文计算得到的α值与文献相符. 通过实验和计算发现大黄酚的电极反应过程电子转移数与质子数均没有变化.说明无论BSA 是否存在,大黄酚的电极反应没有变化,只是体系游离的大黄酚浓度降低,使峰电流降低. 2.5 大黄酚与 BSA相互作用的光谱研究 2.5.1 大黄酚与BSA 相互作用紫外光谱特征 图4 大黄酚与BSA相互作用的紫外光谱 图5 大黄酚与BSA光谱残余的紫外图谱 对pH=4.0的B-R缓冲溶液在200~500nm进行紫外吸收光谱扫描,以去离子水为参比,扫描波长范围内无明显吸收.取一定量的 BSA溶于 pH=4.0的缓冲溶液中使 BSA 的浓度为5.0 ×10"mol/L,在200~500 nm进行紫外吸收光谱扫描,如4图(a)线,显示牛血清蛋白在278 nm处有一个吸收峰. 取一定量的大黄酚溶液加到pH=4.0的B-R缓冲溶冲中使大黄酚的浓度为1.0×10'mol/L,从200~500 nm 进行吸收光谱的扫描,如图4(b)线.大黄酚的3个吸收峰分别是272,292和409 nm;而牛血清蛋白在278nm处有一个吸收峰,为了避免BSA的吸收的干扰,大黄酚的观察峰选在远离这些吸收峰处,选择409 nm 观察吸收光谱的变化. 取一定量大黄黄和BSA溶解到pH=4.0的B-R缓冲溶液中,使大黄酚和BSA的浓度均为1.0×10ml/L,在室温下混合均匀,放置8 min 时间以保证结合反应达到平衡.在200~500 nm进行吸收光谱的扫描,如图4(c)线.发现加入BSA 后吸收光谱图发生了变化.说明大黄酚与BSA发生了结合反应. 2.5.2 大黄酚与 BSA 相互作用正交投影解析 对大黄酚和BSA相互作用体系,可用大黄酚的光谱(Sa)和BSA 光谱(Sb)构成一正交阵M,在按设定的反应时间后,获取反应体系的混合物光谱(Sab),并对正交阵进行投影.应用Matlab6.5语言编制程序进行计算,得到大黄酚与 BSA 相互作用的残余光谱矢量模值0.4603,残余光谱曲线如图5所示.大黄酚与BSA 相互作用所得的残余光谱为非零曲线,残余光谱矢量模的值大于零,说明该反应体系有新的具有光谱特征的物质生成,即大黄酚与BSA发生了结合形成了新的超分子化合物. 2.6 机理探讨 由于 BSA 的空间结构由3个结构域组成,每个结构域由2个亚结构域以槽口相对的方式形成圆筒状结构,几乎所有疏水性氨基酸残基都包埋在圆筒的内部,构成疏水性腔.研究表明,对大黄酚体系中是否加入BSA对其电化学参数无显著的影响.因此进一步推测大黄酚与BSA作用后形成了一种非电活性的超分子化合物,大黄酚进入 BSA圆筒内部,BSA分子中的疏水性氨基酸残基进入大黄酚的蒽环结构,由于 BSA 的包埋使得大黄酚的电化学活性基团隐藏于BSA 内部而不易在电极上发生氧化还原反应,导致大黄酚的痒化还原峰电流降低. 3 结论 大黄酚与BSA 相互作用前后电极反应过程电子转移数、质子数和表面电极反应标准速率常数等电化学参数均未发生显著变化.并且发现作用前后循环不安曲线的形状基本不变,只是相应的峰电流有所下降.表明大黄酚与 BSA 相互作用形成非电化学活性的超分子化合物,使氧化还原反应的峰电流下降大黄酚修饰电极可作为蛋白质的电化学探针用于蛋白质的测定. 根据正交投影方法原理,应用Matlab6.5语言编制程序对大黄酚与BSA 相互作用进行了计算,进一步证明了大黄酚与 BSA 相作作用形成一种超分子化合物结论的正确性. ( [参 考 号 文 献k ) ( S ESNOUSKI S ,ZORIN V,KHLUDEYEV I,et a l. [ J ]. B i ochim Biophys Ac t a ,2005,1 7 25:394-402. ) ( MARTINEZPLAJJ,MARTINEZ- GOMEZ MA,MART I N-BIOSCA Y. [J1. Flectrophoresis ,2004 ,25:3176-3185. ) ( HATTORI T,BATAL D AR S,KAT O R ,et al.[J]. Anal Bioc h em ,2005 ,342 ,229-236. ) ( 孙伟,焦奎,刘晓云.[J].分析测试学报,2002,30(3):312-314. ) ( 王学亮,孙伟,焦韦.[J].分析测试学斤,2005,24(6):106-109. ) ( 周大炜,李乐道,李发美[J].色 谱 ,2004,22(1):116-120. ) 何梅,发之宁.阴永光.1.中国现代应用药学杂志,2001,20(1):429-432. ( 王海人,肖忠柏,宋功武,等.[J].分析测试学报,2001,20(4):45-46. ) ( 黄波,邹国林,杨天鸣.[J].化学学报,2002,60(10):1867-1871. ) ( [10] 胡秋娈,赵风林,李克安.[J].分析测试学报,2000,19(1):45-47. ) ( [11] 卢继新,张贵珠,王月梅.[J].分析化学,2001,29(2):192-194. ) ( [12] 易帅,吴军,郭明,等.[J].浙江大学学报:理学版,2004,31(3):314-318. ) ( [13] 王敬政,贺吉香,江香球.[J].分析化学,2001,29(7):782-784. ) ( [14] 胡秀丽,刘忠英,张寒琦,等.[J].分子科学学报,2005,21(1):54-58. ) ( [15] 董绍俊,车广礼,谢远武.化学修饰电极.第2版.[M].北京:科学出版社,2003:129-130. ) ( [16] 张祖训,汪尔康.电化学原理和方法.[M].北京:科学出版社,2003,32-33. ) Electrochemical and spectral study ofthe interaction between chrysophanol and BSA LI Shourjun ",FANG Hong-zhuang ,WU Dongmei ,SUN Chang-hai ,DINGLi-xin, ZHAO Zhi-yu,SHAN Jing ying (College of Chemistry and Phamacy ,Jiamusi University ,Jiamusi 154007 ,China) Abstract :In pH=4.0 Britton Robinson(B-R) buffer solution ,electrochemical/ spectral properties of the interactionbetween chrysophanol and bovine serum albumin (BSA) were studied by using CV,differential pulse voltammetry(DPV) and UV. The results showed that Chrysophanol and bovine serum protein generated a electrochemical inactivesupermolecular compound. At the same time ,the combined reaction mechanism was discussed. The redox peak current of chrysophanol decreased and the electric potential changed little as a result of the presence of BSA. The relationship between the peakcurrentdecline and the concentration of BSAAwaslinear in thlee range of5.0×10-6~1.0 ×107 mol/L,and the detection limit was 3 ×10~’mol/L. Key words :chrysophanol ;bovine serum albumin ;electrochemistry; spectrum ◎China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
关闭-
1/5

-
2/5
还剩3页未读,是否继续阅读?
继续免费阅读全文产品配置单
天津市兰力科化学电子高技术有限公司为您提供《大黄酚和牛血清蛋白中电化学/ 光谱性质研究检测方案(电化学工作站)》,该方案主要用于其他中电化学/ 光谱性质研究检测,参考标准《暂无》,《大黄酚和牛血清蛋白中电化学/ 光谱性质研究检测方案(电化学工作站)》用到的仪器有LK2005电化学工作站。
我要纠错
推荐专场
相关方案






 咨询
咨询