方案详情文
智能文字提取功能测试中
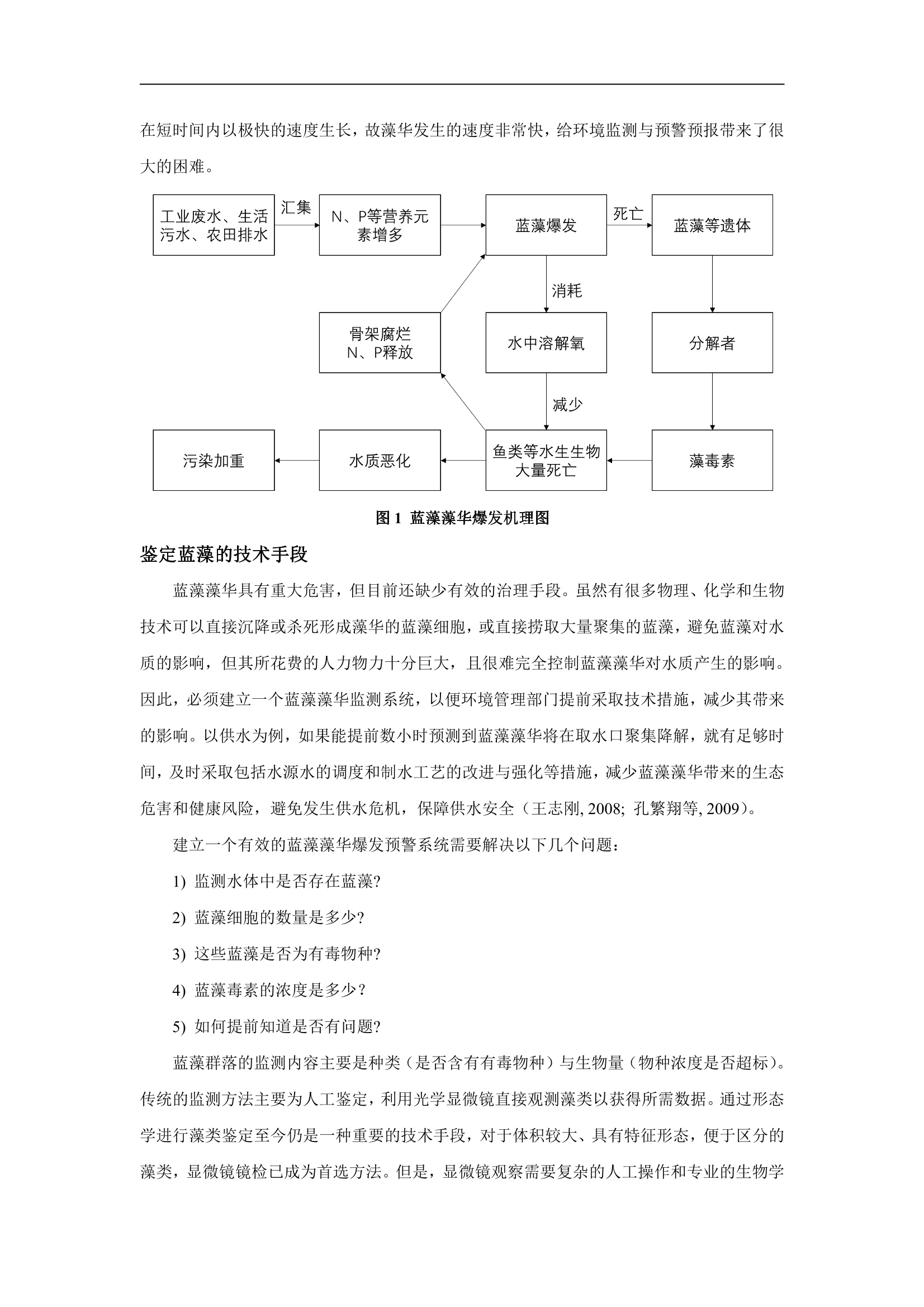
蓝藻藻华快速监测技术解析 版权所有:北京欧仕科技有限公司(转载需授权) 工程师:王珊珊 蓝藻藻华及其危害 随着人类活动强度的加剧,大量的氮、磷等营养物质通过各种途径进入河流、湖泊、海洋等水体,造成水体富营养状态。有研究表明:我国目前66%以上的湖泊、水库处于富营养化水平,其中22%处于重富营养和超富营养状态(陈小峰等,2014;胡利静等,2015)。与富营养化伴生的一个生态灾害现象是浮游植物藻华的大面积爆发 (Farrow et al.,2020)。不同浮游植物类群形成的藻华会导致水体呈现出蓝色、红色、绿色、乳白色等不同的颜色,甚至有些物种会聚集形成丝状体或片状体,大面积的漂浮在水体表面,引发水体缺氧等一系列环境问题,严重时可能会导致鱼类和其他水生生物的大量死亡(孔繁翔和高光,2005;王志刚,2008;莫婉等,2009)。因此,水体富营养化现象以及由此形成的藻华灾害已经成为我国湖泊目前与今后相当长一段时期内的重大环境问题。 在各种藻华中,蓝藻藻华发生的范围最广、危害最大,对人体健康会造成较大的伤害,在世界各地及我国均有大量的报道(肖道富等,2005;胡传林等,2010;李李铭等,2019)。蓝藻门(Cyanophyta) 与其他真核藻类门中的物种有明显的区别:蓝藻细胞没有完整的细胞核结构,没有核膜、核仁,仅有核质聚集在细胞的中央区,被称为原核细胞;没有色素体等细胞器,通过分散在“核区”以外原生质内的色素进行光合作用,藻体结构简单,单细胞藻体,各式群体和丝状体;生活史中没有有性生殖和具有鞭毛的生殖细胞(钱树本等,2005)。蓝藻分布十分广泛,遍布世界各地,但大多数物种是淡水的,海生的物种较少。 在世界范围内,蓝藻藻华发生的频率与规模都呈现出迅猛的增长趋势(陈隽,2006)。在我国,不仅有许多富营养型的湖泊如太湖、巢湖、滇池等连年发生蓝藻藻华,甚至在一些流速较大的河流中如钱塘江、汉江等也有蓝藻藻华事件的发生(陆开宏,2009)。发生在无锡的水污染事件就是因为水源地附近蓝藻大量堆积,厌氧分解过程中产生了大量的氨气、硫醇、硫醚以及硫化氢等异味化学物质导致(路云霞等,2008;杨铭威等,2009)。如图1所示:N、P元素增多使得蓝藻藻华爆发,蓝藻的大量繁殖消耗了水体中大量的溶解氧,进而使得生活在水体中的其他水生生物(鱼类等)大量死亡,水质恶化,而鱼类等死亡水生生物的骨架腐烂、分解又释放出来大量的N、P营养盐,形成了一个恶性循环。在许多情况下,蓝藻可以 在短时间内以极快的速度生长,故藻华发生的速度非常快,给环境监测与预警预报带来了很大的困难。 图1蓝藻藻华爆发机理图 鉴定蓝藻的技术手段 蓝藻藻华具有重大危害,但目前还缺少有效的治理手段。虽然有很多物理、化学和生物技术可以直接沉降或杀死形成藻华的蓝藻细胞,或直接捞取大量聚集的蓝藻,避免蓝藻对水质的影响,但其所花费的人力物力十分巨大,且很难完全控制蓝藻藻华对水质产生的影响。因此,必须建立一个蓝藻藻华监测系统,以便环境管理部门提前采取技术措施,减少其带来的影响。以供水为例,如果能提前数小时预测到蓝藻藻华将在取水口聚集降解,就有足够时间,及时采取包括水源水的调度和制水工艺的改进与强化等措施,减少蓝藻藻华带来的生态危害和健康风险,避免发生供水危机,保障供水安全(王志刚,2008;孔繁翔等,2009)。 建立一个有效的蓝藻藻华爆发预警系统需要解决以下几个问题: 1)监测水体中是否存在蓝藻? 2)蓝藻细胞的数量是多少? 3)这些蓝藻是否为有毒物种? 4)蓝藻毒素的浓度是多少? 5)如何提前知道是否有问题? 蓝藻群落的监测内容主要是种类(是否含有有毒物种)与生物量(物种浓度是否超标)。传统的监测方法主要为人工鉴定,利用光学显微镜直接观测藻类以获得所需数据。通过形态学进行藻类鉴定至今仍是一种重要的技术手段,对于体积较大、具有特征形态,便于区分的藻类,显微镜镜检已成为首选方法。但是,显微镜观察需要复杂的人工操作和专业的生物学 分类知识,费时费力,易因观察者的主观判断造成误差,不能及时准确地反映水体污染状况,且不能进行原位实时监测,难以满足种群动力学观测量大、连续的要求,在实际应用中具有一定的局限性。另外,、,一些物种具有相似的形态学特征,在光学显微镜下很难分辨出来,可能需要借助电子显微镜,但检测速度更慢,更难适用于大量样品。 随着光学仪器的发展,高效液相色谱仪、流式细胞仪已成为藻类多样性分析的主要技术手段。通过分析藻类的细胞色素特征,可以得到定性及定量的结果,效率远高于形态学镜检。随着分子水平研究的迅猛发展,使得 DNA分子鉴定方法逐渐成为一种新的藻类多样性研究方法,其准确性方面都有着较大的优势。分子鉴定方法,首先需要选取被鉴定物种所含有的标记基因,通过 DNA 测序进行序列的相似度比对,进而分析被检测类群的多样性。以上这些方法虽然诞生时间不同、发展速度差异较大,但具有不同的优缺点,需要根据目标藻类的特征进行合理的选择。表1列举了常见藻类鉴定分析的技术及其特点(Trask et al., 2005;Lomas et al., 2011;钱奎梅等,2015;孟溪,2019)。 表1藻类鉴定分析常用方法 技术方法 应用方面 测量速度 优点 缺点 镜检 样品少、直 慢 准确度高且能较为全面 耗时耗力;需有经验的专业人员; 接计数 地反映样品的种类分布 水样中的非藻颗粒会造成干扰 高效液相色 样品多 慢 准确、便捷;可以确定藻 需前处理;受胞内物组成限制;藻 谱 类群落的组成和丰度 类特征色素基础性数据还比较缺乏 流式细胞仪 样品多,直 快 操作时间短,能灵敏检测 仪器昂贵;适用于小型细胞;鉴定 接计数 细胞死、活状态 水平低 分子鉴定 少量样品 慢 准确度高 过程繁琐,需要要序及 PCR过程 FlowCam 的优势 流式影像仪 (Flow Cytometer and Microscope,FlowCam)将流式细胞技术、显微成像技术和图像采集技术相结合,具有连续成像和流式细胞计数的功能。因此,相比其他的技术手段, FlowCam 具有自己独特的优势,主要包括: 1)快速计数; 2)高速显示数字化的生物体图像; 3)多参数分析; 4)建立图像库,实现自动分类; 5)较好的区分生命体和非生命体; 6)现场检测。 FlowCam 的应用案例 (1)综合监测 美国的一家饮用水机构为保证其用水安全,提出了一个综合监测蓝藻细胞的方法,如图2所示。首先,我们需要对水体中的蓝藻细胞进行鉴定和计数。减少样品测量时间的同时还要保证测量的准确性,精确测量浮游生物的体型和丰度是评估和表征许多重要指标的必要手段。一些学者对 FlowCam 的准确性进行了对比试验,如侯建军等(2004)对实验室培养的3种纯种赤潮藻进行了不同计数方法(库尔特计数法、FlowCam 计数法、可见分光度法计数法、显微镜计数法)的比较研究,发现 FlowCam 在纯种细胞计数方面有明显的优势,是比较简便、快捷、可行的细胞计数方法,且能人为分辨出细胞生长后期的细胞碎片甚至是死细胞。而准确计数微囊藻和鱼腥藻等群体型和丝状型蓝藻细胞对监测潜在的有毒蓝藻至关重要。Lehman 等(2017)准确计算了含有群体型微囊藻和丝状型鱼腥藻样品的细胞密度。 当 FlowCam 检测到样品中微囊藻、鱼腥藻和颤藻(这三种蓝藻均产生毒素)浓度较高时,需对样品进行 qPCR 检测,以确认样本中的蓝藻菌是否有产生毒素的基因。样本中有微囊藻细胞并不意味着就会有毒素的产生。如果产生毒素的基因不存在,或者没有被激活,那么微囊藻毒素就不会存在。如果 qPCR结果是阳性,存在产毒基因,之后要利用 LC-MS/MS(液相色谱-质谱联用仪)对样品进行毒素检测,分析样品中毒素的浓度是否达到监测标准。LC-MS/MS分析样品成本较高,因此 FlowCam 数据和 qPCR检测结果联合使用,以证明或放弃毒素检测。 同时利用 GC-MS (气相色谱质谱联用仪)来监测饮用水中引起人类感官不悦的两种典型嗅味物质:MIB(二甲基异茨醇)和GSM(土臭素)。一般认为 GSM 随着鱼腥藻数目的增加而增加。因此,当FlowCam 计数鱼腥藻细胞超过200个/mL时,则表明嗅味事件可能已迫在眉睫。当 GC-MS 结果确认存在嗅味物质时,便开始用 PAC (粉末活性炭)处理,以去除 MIB 和 GSM。 图2 监测有毒蓝藻的流程图 (2)治理检测 现有的除藻方法有化学除藻法、生物除藻法和物理除藻法。化学除藻法是利用化学试剂对藻类进行杀除,但化学试剂处理过程中,可能会使蓝藻细胞的降解,进而导致有毒物质(微囊藻毒素等)、恶臭代谢物(MIB、GSM)等释放到水体中,造成环境的二次污染,使水质环境形成恶性循环(孔繁翔等,2009)。 Jason 等(2005)利用FlowCam 结合叶绿素a分析化学除藻法对水体中蓝藻细胞的破坏或溶解能力。通过荧光粒子浓度和叶绿素a分析,将叶绿素a的损失量化为细胞损伤。FlowCam 拍摄的图像为细胞损伤提供了定性观察,可以更好的了解细胞损伤中裂解的风险。 生物除藻法主要通过水生生态系统食物链关系,即利用水中浮游动物和鱼类对水华藻类的摄食,改变生物群落结构,增加对藻华藻量的控制能力。生物除藻法不会对环境造成二次污染,但是极易造成外来物种入侵,进而对整个生态环境系统造成严重破坏。因此,需要找到合适的临界值,才能达到较好的控制效果。Ide 等(2007)通过与传统显微镜分析的比较,探讨了使用FlowCam 快速分析桡足类摄食的有效性和可靠性。结果表明,用 FlowCam 估计的桡足类动物的摄食率与用显微镜观察浮游动物的摄食率是一致的;从颗粒的体积特异性荧光强度上, FlowCam 成功地区分了浮游动物和浮游植物,且用较较少不到显微计数所需时间的十分之一。因此,未来我们也可以通过 FlowCam 来探究鲢鱼等生物进食蓝藻的速率,进而估算其控制藻华所需要的数量。 物理除藻法不会造成二次污染和生物入侵,但技术成本高、操作环境差。随着超声波技术的发展,将超声波用于除藻抑藻方面的研究日益增多。超声波除藻技术以其清洁、高效、反应条件温和等特点,在蓝藻藻华控制领域有着广阔的应用前景。2015年夏天,新泽西州的一个饮用水处理设备进行了一项研究,在超声波浮标测试中使用了 FlowCam 来帮助识别物种,并通过计数细胞和测量生物体积来监测浮标对蓝藻藻华控制的效果。 结论 FlowCam 实现了藻类细胞的快速检测与自动分类,减少了人工操作,不但能在实验室内进行样品分析,还可以在野外进行实时监测,且系统维护相对简单,具有较高的实用性,最有可能实现有害藻类早期预警的技术方法,在实际应用中应逐步探索形成标准的监测方法,在湖泊、海洋等生态系统的研究中开拓更广阔的领域。 虽然 FlowCam 已经获得广泛应用,但是在技术上仍存在一些不足,自动分类仍然需要人工操作的辅助。FlowCam 主要是根据细胞大小及色素差异对一些特定类群藻类进行识别,对于室内培养的纯种藻分类效果较好,而野外样品要复杂的多。一方面,赤潮藻细胞种类繁多,许多不同种类的浮游藻在形态学上极为相似; 另--方面,同一种类的藻细胞在不同生长时期以及不同视点所获取的图像又可能在形态上具有差异性,这就使得自动识别工作非常困难;加之由于技术的限制,通常获得的图像分辨率较差,更在一定程度上影响了识别的准确度。当FlowCam 应用于其他浅水湖泊时,需要使用者根据实际情况建立适用于该水体的藻类信息数据库,方可实现部分藻类的自动分类。 ( 参考文献 ) ( Farrow C R , A c kerman J D , S mith R E, et al. R iverine tran s port and nutr i ent inputs affectphytoplankton communities in a coastal embayment[J]. Freshwater Biology, 2020,65(2):289-303. ) ( Ide K, Takahashi K, Kuwata A, et al. A rapid analysis of copepod feeding using FlowCAM[J].Journal of Plankton Research, 2007, 3 0(3):275-281. ) ( Jason H S , Lisa C, Tammi L R , et a l. Co m bing new technologies for determination ofphytoplankton community structure in the northern gulf of Mexico[J]. Journal of Phycology, 2005,41(2):305-310. ) ( Lehman P W , K urobe T, Le s meister S, et a l . Impacts of the 2 014 severe drought on theMicrocystis bloom in San Francisco Estuary[J] . Harmful Algae, 2017:94-108. ) ( Lomas M W , Bronk D A, Den En g h G V, e t a l. Use of Flow Cy t ometry to MeasureBiogeochemical Rates and P r ocesses i n t h e Ocean[J]. Annual R e view of Marine Sci e nce, 2011,3(1):537-566. ) ( T rask B, D en E n gh G J, El g ershuizen J H , et al. Analysis o f p h ytoplankton by flowcytometry[]. Cytometry,2005,2(4):258-264. ) ( 陈隽.肝毒性微囊藻毒素在巢湖和太湖水生动物体内的生物富集及对水产品安全性的潜在威胁[D].北京:中国科学院大学,2006. ) ( 陈小锋,揣小明,杨柳燕.中国典型湖区湖泊富营养化现状、历史演变趋势及成因分析 [J].生态与农村环境学报,2014,30(04):438-443. ) ( 侯建军,黄邦钦,戴相辉.赤潮藻细胞计数方法比较研究[].中国公共卫 生,2004(08):15-16. ) ( 胡传林,万成炎,吴生桂,等.蓝藻水华的成因及其生态控制进展[].长江流域资源与环 境,2010,1 9 (12):1471-1477. ) ( 胡利静,肖艳翼,蒋新益,等.淡水蓝藻控制方法的概述[J].水产养殖,2015,36(02):6-11. ) ( 孔繁翔,高光.大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J].生态学 报,2005(03):589-595. ) ( 孔繁翔,马荣华,高俊峰,等.太湖蓝藻水华的预防、预测和预警的理论与实践[J].湖泊科 学,2009,21(03):314-328. ) ( 李晟铭,刘吉平,宋开山,等.基于 Landsat影像巢湖蓝藻水华暴发时空变化特征及其驱动因素分析[J].长江流域资源与环境,2019,28(05):1205-1213. ) ( 陆开宏.蓝藻水华与2种藻食性水生动物的相互作用[D].青岛:中国海洋大学,2009. ) ( 路云霞,吴长年,黄戟,等.由“无锡太湖水华事件”论太湖富营养化的防治[J].生态经 济,2008(02):154-157. ) ( 孟溪.藻类鉴定及分类方法研究进展[J].生物化工,2019,5(02):102-104.莫婉婉,李策,刘玉,等.认识“水华”[].湿地科学与管理,2009,1(05):62-63. ) ( 钱奎梅,刘霞,陈宇炜.淡水浮游植物计数与定量方法[].湖泊科 学,2015,2 7 (05):767-775. ) ( 钱树本,刘东艳,孙军.海藻学[M].青岛:中国海洋大学出版社,2005. ) ( 王志刚.水体浮游植物浓度原位分类测量方法研究与系统研制[D].北京:中国科学技术 大学,2008. ) ( 肖兴富,李文奇,刘娜,等.富营养化水体中蓝藻毒素的危害及其控制[J].中国水利水电 科学研究院学报,2005(02):116-123. ) ( 杨铭威,石亚东,孙志,等.太湖蓝藻爆发引发无锡供水危机的思考[J].水利利 济,2009, 27(03):36-38+74-75. ) 蓝藻藻华快速监测技术解析版权所有:北京欧仕科技有限公司(转载需授权 )工程师:王珊珊蓝藻藻华及其危害随着人类活动强度的加剧,大量的氮、磷等营养物质通过各种途径进入河流、湖泊、海洋等水体,造成水体富营养状态。有研究表明:我国目前66%以上的湖泊、水库处于富营养化水平,其中22%处于重富营养和超富营养状态(陈小峰等, 2014; 胡利静等, 2015)。与富营养化伴生的一个生态灾害现象是浮游植物藻华的大面积爆发(Farrow et al., 2020)。不同浮游植物类群形成的藻华会导致水体呈现出蓝色、红色、绿色、乳白色等不同的颜色,甚至有些物种会聚集形成丝状体或片状体,大面积的漂浮在水体表面,引发水体缺氧等一系列环境问题,严重时可能会导致鱼类和其他水生生物的大量死亡(孔繁翔和高光, 2005; 王志刚, 2008; 莫婉湫等, 2009)。因此,水体富营养化现象以及由此形成的藻华灾害已经成为我国湖泊目前与今后相当长一段时期内的重大环境问题。在各种藻华中,蓝藻藻华发生的范围最广、危害最大,对人体健康会造成较大的伤害,在世界各地及我国均有大量的报道(肖兴富等, 2005; 胡传林等, 2010; 李晟铭等, 2019)。蓝藻门(Cyanophyta)与其他真核藻类门中的物种有明显的区别:蓝藻细胞没有完整的细胞核结构,没有核膜、核仁,仅有核质聚集在细胞的中央区,被称为原核细胞;没有色素体等细胞器,通过分散在“核区”以外原生质内的色素进行光合作用,藻体结构简单,单细胞藻体,各式群体和丝状体;生活史中没有有性生殖和具有鞭毛的生殖细胞(钱树本等, 2005)。蓝藻分布十分广泛,遍布世界各地,但大多数物种是淡水的,海生的物种较少。在世界范围内,蓝藻藻华发生的频率与规模都呈现出迅猛的增长趋势(陈隽, 2006)。在我国,不仅有许多富营养型的湖泊如太湖、巢湖、滇池等连年发生蓝藻藻华,甚至在一些流速较大的河流中如钱塘江、汉江等也有蓝藻藻华事件的发生(陆开宏, 2009)。发生在无锡的水污染事件就是因为水源地附近蓝藻大量堆积,厌氧分解过程中产生了大量的氨气、硫醇、硫醚以及硫化氢等异味化学物质导致(路云霞等, 2008; 杨铭威等, 2009)。如图1 所示:N、P元素增多使得蓝藻藻华爆发,蓝藻的大量繁殖消耗了水体中大量的溶解氧,进而使得生活在水体中的其他水生生物(鱼类等)大量死亡,水质恶化,而鱼类等死亡水生生物的骨架腐烂、分解又释放出来大量的N、P营养盐,形成了一个恶性循环。在许多情况下,蓝藻可以在短时间内以极快的速度生长,故藻华发生的速度非常快,给环境监测与预警预报带来了很大的困难。 图1 蓝藻藻华爆发机理图鉴定蓝藻的技术手段蓝藻藻华具有重大危害,但目前还缺少有效的治理手段。虽然有很多物理、化学和生物技术可以直接沉降或杀死形成藻华的蓝藻细胞,或直接捞取大量聚集的蓝藻,避免蓝藻对水质的影响,但其所花费的人力物力十分巨大,且很难完全控制蓝藻藻华对水质产生的影响。因此,必须建立一个蓝藻藻华监测系统,以便环境管理部门提前采取技术措施,减少其带来的影响。以供水为例,如果能提前数小时预测到蓝藻藻华将在取水口聚集降解,就有足够时间,及时采取包括水源水的调度和制水工艺的改进与强化等措施,减少蓝藻藻华带来的生态危害和健康风险,避免发生供水危机,保障供水安全(王志刚, 2008; 孔繁翔等, 2009)。建立一个有效的蓝藻藻华爆发预警系统需要解决以下几个问题:1) 监测水体中是否存在蓝藻?2) 蓝藻细胞的数量是多少?3) 这些蓝藻是否为有毒物种?4) 蓝藻毒素的浓度是多少?5) 如何提前知道是否有问题?蓝藻群落的监测内容主要是种类(是否含有有毒物种)与生物量(物种浓度是否超标)。传统的监测方法主要为人工鉴定,利用光学显微镜直接观测藻类以获得所需数据。通过形态学进行藻类鉴定至今仍是一种重要的技术手段,对于体积较大、具有特征形态,便于区分的藻类,显微镜镜检已成为首选方法。但是,显微镜观察需要复杂的人工操作和专业的生物学分类知识,费时费力,易因观察者的主观判断造成误差,不能及时准确地反映水体污染状况,且不能进行原位实时监测,难以满足种群动力学观测量大、连续的要求,在实际应用中具有一定的局限性。另外,一些物种具有相似的形态学特征,在光学显微镜下很难分辨出来,可能需要借助电子显微镜,但检测速度更慢,更难适用于大量样品。随着光学仪器的发展,高效液相色谱仪、流式细胞仪已成为藻类多样性分析的主要技术手段。通过分析藻类的细胞色素特征,可以得到定性及定量的结果,效率远高于形态学镜检。随着分子水平研究的迅猛发展,使得DNA分子鉴定方法逐渐成为一种新的藻类多样性研究方法,其准确性方面都有着较大的优势。分子鉴定方法,首先需要选取被鉴定物种所含有的标记基因,通过DNA 测序进行序列的相似度比对,进而分析被检测类群的多样性。以上这些方法虽然诞生时间不同、发展速度差异较大,但具有不同的优缺点,需要根据目标藻类的特征进行合理的选择。表1列举了常见藻类鉴定分析的技术及其特点(Trask et al., 2005; Lomas et al., 2011; 钱奎梅等, 2015; 孟溪, 2019)。表1 藻类鉴定分析常用方法FlowCam的优势流式影像仪(Flow Cytometer and Microscope , FlowCam)将流式细胞技术、显微成像技术和图像采集技术相结合,具有连续成像和流式细胞计数的功能。因此,相比其他的技术手段,FlowCam具有自己独特的优势,主要包括:1) 快速计数;2) 高速显示数字化的生物体图像;3) 多参数分析;4) 建立图像库,实现自动分类;5) 较好的区分生命体和非生命体;6) 现场检测。FlowCam的应用案例(1)综合监测 美国的一家饮用水机构为保证其用水安全,提出了一个综合监测蓝藻细胞的方法,如图2所示。首先,我们需要对水体中的蓝藻细胞进行鉴定和计数。减少样品测量时间的同时还要保证测量的准确性,精确测量浮游生物的体型和丰度是评估和表征许多重要指标的必要手段。一些学者对FlowCam的准确性进行了对比试验,如侯建军等(2004)对实验室培养的3种纯种赤潮藻进行了不同计数方法(库尔特计数法、FlowCam计数法、可见分光度法计数法、显微镜计数法)的比较研究,发现FlowCam在纯种细胞计数方面有明显的优势,是比较简便、快捷、可行的细胞计数方法,且能人为分辨出细胞生长后期的细胞碎片甚至是死细胞。而准确计数微囊藻和鱼腥藻等群体型和丝状型蓝藻细胞对监测潜在的有毒蓝藻至关重要。Lehman等(2017)准确计算了含有群体型微囊藻和丝状型鱼腥藻样品的细胞密度。当FlowCam检测到样品中微囊藻、鱼腥藻和颤藻(这三种蓝藻均产生毒素)浓度较高时,需对样品进行qPCR检测,以确认样本中的蓝藻菌是否有产生毒素的基因。样本中有微囊藻细胞并不意味着就会有毒素的产生。如果产生毒素的基因不存在,或者没有被激活,那么微囊藻毒素就不会存在。如果qPCR结果是阳性,存在产毒基因,之后要利用LC-MS/MS(液相色谱-质谱联用仪)对样品进行毒素检测,分析样品中毒素的浓度是否达到监测标准。LC-MS/MS分析样品成本较高,因此FlowCam数据和qPCR检测结果联合使用,以证明或放弃毒素检测。 同时利用GC-MS(气相色谱质谱联用仪)来监测饮用水中引起人类感官不悦的两种典型嗅味物质:MIB(二甲基异茨醇)和GSM(土臭素)。一般认为GSM随着鱼腥藻数目的增加而增加。因此,当FlowCam计数鱼腥藻细胞超过200个/ mL时,则表明嗅味事件可能已迫在眉睫。当GC-MS结果确认存在嗅味物质时,便开始用PAC(粉末活性炭)处理,以去除MIB和GSM。 图2 监测有毒蓝藻的流程图(2)治理检测现有的除藻方法有化学除藻法、生物除藻法和物理除藻法。化学除藻法是利用化学试剂对藻类进行杀除,但化学试剂处理过程中,可能会使蓝藻细胞的降解,进而导致有毒物质(微囊藻毒素等)、恶臭代谢物(MIB、GSM)等释放到水体中,造成环境的二次污染,使水质环境形成恶性循环(孔繁翔等, 2009)。Jason等(2005)利用FlowCam结合叶绿素a分析化学除藻法对水体中蓝藻细胞的破坏或溶解能力。通过荧光粒子浓度和叶绿素a分析,将叶绿素a的损失量化为细胞损伤。FlowCam拍摄的图像为细胞损伤提供了定性观察,可以更好的了解细胞损伤中裂解的风险。生物除藻法主要通过水生生态系统食物链关系,即利用水中浮游动物和鱼类对水华藻类的摄食,改变生物群落结构,增加对藻华藻量的控制能力。生物除藻法不会对环境造成二次污染,但是极易造成外来物种入侵,进而对整个生态环境系统造成严重破坏。因此,需要找到合适的临界值,才能达到较好的控制效果。Ide等(2007)通过与传统显微镜分析的比较,探讨了使用FlowCam快速分析桡足类摄食的有效性和可靠性。结果表明,用FlowCam估计的桡足类动物的摄食率与用显微镜观察浮游动物的摄食率是一致的;从颗粒的体积特异性荧光强度上,FlowCam成功地区分了浮游动物和浮游植物,且用时较少不到显微计数所需时间的十分之一。因此,未来我们也可以通过FlowCam来探究鲢鱼等生物进食蓝藻的速率,进而估算其控制藻华所需要的数量。物理除藻法不会造成二次污染和生物入侵,但技术成本高、操作环境差。随着超声波技术的发展,将超声波用于除藻抑藻方面的研究日益增多。超声波除藻技术以其清洁、高效、反应条件温和等特点,在蓝藻藻华控制领域有着广阔的应用前景。2015年夏天,新泽西州的一个饮用水处理设备进行了一项研究,在超声波浮标测试中使用了FlowCam来帮助识别物种,并通过计数细胞和测量生物体积来监测浮标对蓝藻藻华控制的效果。结论FlowCam实现了藻类细胞的快速检测与自动分类,减少了人工操作,不但能在实验室内进行样品分析,还可以在野外进行实时监测,且系统维护相对简单,具有较高的实用性,最有可能实现有害藻类早期预警的技术方法,在实际应用中应逐步探索形成标准的监测方法,在湖泊、海洋等生态系统的研究中开拓更广阔的领域。虽然FlowCam已经获得广泛应用,但是在技术上仍存在一些不足,自动分类仍然需要人工操作的辅助。FlowCam主要是根据细胞大小及色素差异对一些特定类群藻类进行识别,对于室内培养的纯种藻分类效果较好,而野外样品要复杂的多。一方面,赤潮藻细胞种类繁多,许多不同种类的浮游藻在形态学上极为相似;另一方面,同一种类的藻细胞在不同生长时期以及不同视点所获取的图像又可能在形态上具有差异性,这就使得自动识别工作非常困难;加之由于技术的限制,通常获得的图像分辨率较差,更在一定程度上影响了识别的准确度。当FlowCam应用于其他浅水湖泊时,需要使用者根据实际情况建立适用于该水体的藻类信息数据库,方可实现部分藻类的自动分类。参考文献Farrow C R, Ackerman J D, Smith R E, et al. Riverine transport and nutrient inputs affect phytoplankton communities in a coastal embayment[J]. Freshwater Biology, 2020, 65(2): 289-303.Ide K, Takahashi K, Kuwata A, et al. A rapid analysis of copepod feeding using FlowCAM[J]. Journal of Plankton Research, 2007, 30(3): 275-281.Jason H S, Lisa C, Tammi L R, et al. Combing new technologies for determination of phytoplankton community structure in the northern gulf of Mexico[J]. Journal of Phycology, 2005, 41(2): 305-310.Lehman P W, Kurobe T, Lesmeister S, et al. Impacts of the 2014 severe drought on the Microcystis bloom in San Francisco Estuary[J]. Harmful Algae, 2017: 94-108.Lomas M W, Bronk D A, Den Engh G V, et al. Use of Flow Cytometry to Measure Biogeochemical Rates and Processes in the Ocean[J]. Annual Review of Marine Science, 2011, 3(1): 537-566.Trask B, Den Engh G J, Elgershuizen J H, et al. Analysis of phytoplankton by flow cytometry[J]. Cytometry, 2005, 2(4): 258-264.陈隽. 肝毒性微囊藻毒素在巢湖和太湖水生动物体内的生物富集及对水产品安全性的潜在威胁[D]. 北京: 中国科学院大学, 2006.陈小锋, 揣小明, 杨柳燕. 中国典型湖区湖泊富营养化现状、历史演变趋势及成因分析[J]. 生态与农村环境学报, 2014, 30(04): 438-443.侯建军, 黄邦钦, 戴相辉. 赤潮藻细胞计数方法比较研究[J]. 中国公共卫生, 2004(08): 15-16.胡传林, 万成炎, 吴生桂, 等. 蓝藻水华的成因及其生态控制进展[J]. 长江流域资源与环境, 2010, 19(12): 1471-1477.胡利静, 肖艳翼, 蒋新益, 等. 淡水蓝藻控制方法的概述[J]. 水产养殖, 2015, 36(02): 6-11.孔繁翔, 高光. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J]. 生态学报, 2005(03): 589-595.孔繁翔, 马荣华, 高俊峰, 等. 太湖蓝藻水华的预防、预测和预警的理论与实践[J]. 湖泊科学, 2009, 21(03): 314-328.李晟铭, 刘吉平, 宋开山, 等. 基于Landsat影像巢湖蓝藻水华暴发时空变化特征及其驱动因素分析[J]. 长江流域资源与环境, 2019, 28(05): 1205-1213.陆开宏. 蓝藻水华与2种藻食性水生动物的相互作用[D]. 青岛: 中国海洋大学, 2009.路云霞, 吴长年, 黄戟, 等. 由“无锡太湖水华事件”论太湖富营养化的防治[J]. 生态经济, 2008(02): 154-157.孟溪. 藻类鉴定及分类方法研究进展[J]. 生物化工, 2019, 5(02): 102-104.莫婉湫, 李策, 刘玉, 等. 认识“水华”[J]. 湿地科学与管理, 2009, 1(05): 62-63.钱奎梅, 刘霞, 陈宇炜. 淡水浮游植物计数与定量方法[J]. 湖泊科学, 2015, 27(05): 767-775.钱树本, 刘东艳, 孙军. 海藻学[M]. 青岛: 中国海洋大学出版社, 2005.王志刚. 水体浮游植物浓度原位分类测量方法研究与系统研制[D]. 北京: 中国科学技术大学, 2008.肖兴富, 李文奇, 刘娜, 等. 富营养化水体中蓝藻毒素的危害及其控制[J]. 中国水利水电科学研究院学报, 2005(02): 116-123.杨铭威, 石亚东, 孙志, 等. 太湖蓝藻爆发引发无锡供水危机的思考[J]. 水利经济, 2009, 27(03): 36-38+74-75.
关闭-
1/7

-
2/7
还剩5页未读,是否继续阅读?
继续免费阅读全文产品配置单
北京欧仕科技有限公司为您提供《地表水中蓝藻藻华检测方案(藻类计数仪)》,该方案主要用于环境水(除海水)中生物检测,参考标准《暂无》,《地表水中蓝藻藻华检测方案(藻类计数仪)》用到的仪器有FlowCAM流式影像仪、Flowcam5000流式影像仪。
我要纠错
推荐专场
藻类计数仪/浮游动植物计数仪
更多相关方案






 咨询
咨询





