

 泛指一般有机化合物,其氧化反应可由下式表示:
泛指一般有机化合物,其氧化反应可由下式表示:
 在氧化反应中要消耗 1/2(2a+b/2+d+5/2e+2f-c)摩尔的氧,用此法计算出的COD值称为理论需氧量(ThOD),其单位一般用g/g(即每克有机物耗氧克数)表示。在评价COD的方法时往往引入氧化率的概念,将实际测得的需氧量与理论需氧量相比而得。即:
在氧化反应中要消耗 1/2(2a+b/2+d+5/2e+2f-c)摩尔的氧,用此法计算出的COD值称为理论需氧量(ThOD),其单位一般用g/g(即每克有机物耗氧克数)表示。在评价COD的方法时往往引入氧化率的概念,将实际测得的需氧量与理论需氧量相比而得。即:
haypiny
第1楼2006/08/10
2.1.概述
2.1.1.原理
COD重铬酸钾法从建立至今已有100多年的历史;
在强酸性溶液中,一定量的重铬酸钾氧化水样中还原性物质,过量的重铬酸钾以试亚铁灵作指示剂,用硫酸亚铁铵溶液回滴。根据用量算出水样中还原性物质消耗氧的量。
重铬酸钾在强酸性介质中的氧化反应式为:
回流加流热时,反应温度为146℃即419K。反应体系中硫酸浓度为9mol/L,其活度系数r为0.72(查表后计算而得),故此时的条件电极电位为:
式中:E’ ——条件电极电位; E°——标准电极电位; R——气体常数,为8.314J/K•mol; T——绝对温度; n——化学反应的当量数; F——法拉第常数,为9.65×104 C/mol; r——活度系数; a——活度; c——浓度。
因此:
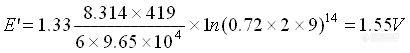
由此可见,在上述反应条件下,它具有较高的氧化能力,足以使许多有机化合物的氧化率达95~100%。
但对于苯和吡啶等有机化合物,具有特殊的稳定性。在苯的分子结构中,六个碳原子以sp2 杂化轨道与氢原子的S轨道互相交错形成六个碳-碳σ键,又各以 sp2杂化轨道与氢原子的S轨道相交错形成六个碳氢键,每个碳原子还有一个p 轨道,这六个 p轨道上的未配对电子可以组成六个分子轨道,其中三个是成键轨道。在基态下,苯分子的六个π电子都在成键轨道内,它们的动量比在三个孤立的 π 轨道中要低的多,因此苯环是个很安定的体系。在CODCr的氧化体系中,难以将其氧化,其氧化率仅17%。另一方面,20℃时苯在水中的溶解度仅为0.07g苯/100g水,也就是说水的饱和苯溶液所能引起的COD也仅364mg/L。吡啶环也有相似的稳定结构,其氧化率也只有20%左右。从表18—2可见,当苯环上的氢被羟基、氨基,羧基取代后,其氧化率可从17%增至99%以上,这表明由于羟基、氨基和羧基对苯环的诱导效应和共轭效应使苯环活化易于断键而被氧化。
(二)硫酸根的催化作用
为了促使水中还原性物质的充分氧化,需要加入硫酸银作催化剂,为使硫酸银分布均匀,常将其定量加入浓硫酸中,待其全部溶解后(约需2d)使用。
推断硫酸银的催化机理为:有机物中含羟基的化合物在强酸性介质中首先被重铬酸钾氧化羧酸。这时,生成的脂肪酸与硫酸银作用生成脂肪酸银,由于银原子的作用,使羧基易断裂而生成二氧化碳和水,并进一步生成新的脂肪酸银,其碳原子要较前者少一个。如此循环重复,逐步使有机物全部氧化成二氧化碳和水。
若以RCH2CH20H泛指有机醇类化合物,则会发生如下反应: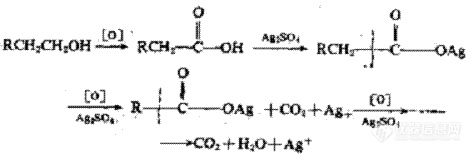
采用10g Ag2S04/1000ml H2SO4用量是完全足量的,完全没有必要使用更多的硫酸银。如对经常测定的水样,有充分的数据对照,还可适当减少Ag2S04的用量。
还有一些报道,采用其他一些金属的盐类作为催化剂。有人报道了用铜置换废液中银,金属银加硝酸溶解生成硝酸银,再与(NH4)2S04反应析出Ag2S04结晶,此过程生产出的Ag2S04有足够的纯度供COD测定用。大大节约了Ag2SO4试剂。
haypiny
第3楼2006/08/10
2.1.2. 干扰及其消除
酸性重铬酸钾氧化性很强,可氧化大部分有机物,加入硫酸银作催化剂时,直链脂肪族化合物可完全被氧化,而芳香族有机物却不易被氧化,吡啶不被氧化,挥发性直链脂肪族化合物、苯等有机物存在于蒸气相,不能与氧化剂液体接触,氧化不明显。氯离子能被重铬酸盐氧化,并且能与硫酸银作用产生沉淀,影响测定结果,故在回流前向水样中加入硫酸汞,使成为络合物以消除干扰。氯离子含量高于1000mg/L的样品应先作定量稀释,使含量降低到1000mg/L以下,再行测定。
如将COD看作还原性物质的污染指标,则除氯离子之外的无机还原物质的耗氧全包括在内。如将COD看作有机物的污染指标的话,则需将无机还原物质的耗氧除去。对于Fe2+、S2-等无机还原物的干扰,可根据其测定的浓度,由理论需氧量计算出其需氧量,从而对已测的COD值加以校正。Fe2+和S2-的理论需氧量值分别为O.11g/g和O.47g/g。
对 的干扰一般采用氨基磺酸去除,其加入量为10rag氨基磺酸/mg 对Cl-的干扰一般采用HgSO4去除,其加入量为0.4g HgS04/20ml水样(这儿[Cl-]<2000mg/L)。
氯离子广泛存在于自然界中,在CODcr的实验条件下(不加HgS04时),氯离子可以完全被氧化,经实验证明,氯离子的含量和测得的CODcr值存在良好的线性关系,其斜率为0.226mgCOD/L/mg[Cl-]/L。这儿理论上的计算是一致的:
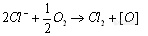
Cl-被完全氧化时,1mg Cl-相当于消耗0.226mg的氧(16/(2 x 35.5)=0.266)。从完全氧化昕需的时间来看,加热10min就可以氧化99%,如不采用回流加热,单靠浓流酸放热反应,其体系的温度为106℃,20min后降为50℃,在这段时间内,氯离子的氧化率为53%。由此可见,在CODcr,的测定条件下,氯离子是很容易被氧化的。
从两个半反应的标准电极电位看,氯离子应不被酸性重铬酸钾氧化;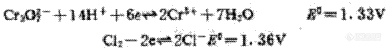
但在CODcr的测定中,体系为强酸性介质,酸度大小直接影响重铬酸钾氧化的条件电极电位,而酸度大小却与氯离子的条件电极电位无关。由前面所述可知,在测定CODcr时,体系中氧化剂的条件电极电位达1.55V,完全可使反应按以下方向进行。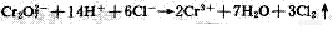
氯离子在反应体系中可能与Ag2SO4或HgSO4发生反应:
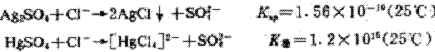
由此可见,后者要较前者优先进行。为避免前一个反应的进行,往往在取来水样分析时,第一步先加入HgS04,让其络合氯离子。
在氧化过程中,会出现如下反应:


尽管[HgCl4]2-的稳定常数很大,但难免仍有少量氯离子存在,马上被酸性重铬酸钾所氧化。因此,我们即使采用HgSO4掩蔽氯离子的影响,仍会有少量的氯离子被氧化。另外,在实验中也发现,按标准方法加HgS04掩蔽氯离子时所测的CODcr值与不加HgS04时测得的COD1值和O.226[C1-]的差值并不相等,即:
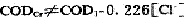
要使该式相等,要添加一个校正值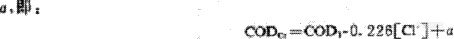
式中COD1表示不加HgSO4时测得的COD值(为防止Ag2S04对氯离子的沉淀作用,在反应开始时不加Ag2SO4,待反应30min后,再加入Ag2SO4)。[Cl-]表示氯离子浓度,CODcr表示标准方法测得的COD值。
校正值 就是一小部分未络合的氯离子所产生的COD值。可先采用已知浓度的NaCl溶液测出此校正值 ,如图18-4所示。在实际计算中,可从COD1、[Cl-]及 值计算出CODcr值。此法可省去使用剧毒药品HgSO4的手续,其计算值与测定结果误差在8%之内。
2.1.3. 方法的适用范围
用0.25mg/L浓度的重铬酸钾溶液可测定大于50mg/L的COD值,未经稀释水样的测量上限是700mg/L,用0.025mol/L浓度的重铬酸钾溶液可测定5~50mg/L的COD值,但
低于lOmg/L时测量准确度较差。
2.2. 仪器
2.2.1. 回流装置:带250ml锥形瓶的全玻
璃回流装置见图(如取样量在30ml以上,
采用500ml锥形瓶的全玻璃回流装置)。
2.2.2. 加热装置:电热板或变阻电炉。
2.2.3. 50ml酸式滴定管。
haypiny
第4楼2006/08/10
2.3.试剂
2.3.1.重铬酸钾标准溶液(1/6K2Cr2O7=0.2500mol/L ):称取预先在120℃ 烘干2h的基准或优级纯重铬酸钾12.258g溶于水中,移入1000ml容量瓶,稀释至标线,摇匀。
2.3.2.试亚铁灵指示液:称取1.48g邻菲啰啉(C12H8N2.H2O,1,10-phenanthndine ),0.695g 硫酸亚铁(FeSO4.7H20 )溶于水中,稀释至100ml,贮于棕色瓶内。
2.3.3. 硫酸亚铁铵标准溶液[(NH4)2FeSO4.6H20 ≈0.1mol/L] :称取39.5g硫酸亚铁铵溶于水中,边搅拌边缓慢加入20ml浓硫酸,冷却后移入1000ml容量瓶中,加水稀释至标线,摇匀。临用前,用重铬酸钾标准溶液标定。
标定方法:准确吸取10.00ml重铬酸钾标准溶液于500ml锥形瓶中,加水稀释至110ml左右,
缓慢加入30ml浓硫酸,混匀。冷却后,加入3滴试亚铁灵指示液(约0.15ml),用硫酸亚铁铵溶液滴定,溶液的颜色由黄色经蓝绿色至红褐色即为终点。
式中,c——硫酸亚铁铵标准溶液的浓度(mol/L);V——硫酸亚铁铵标准滴定溶液的用量(ml)。
2.3.4.硫酸-硫酸银溶液:于2500ml浓硫酸中加入25g硫酸银。放置1-2d,不时摇动使其溶解(如无2500ml容器,可在500ml浓硫酸中加入5g硫酸银)。
2.3.5.硫酸汞:结晶或粉末。
2.4.步骤:
终点由蓝绿色变成红棕色
① 取20.00ml混合均匀的水样(或适量水样稀释至20.00ml)置250ml磨口的回流锥形瓶中,准确加入10.00ml重铬酸钾标准溶液及数粒小玻璃珠或沸石,连接磨口回流冷凝管,从冷凝管上口慢慢地加入30ml硫酸—硫酸银溶液,轻轻摇动锥形瓶使溶液混匀,加热回流2h(自开始沸腾时计时)。
注1. 对于化学需氧量高的废水样,可先取上述操作所需体积1/10的废水样和试剂,于15×150㎜硬质玻璃试管中,摇匀,加热后观察是否变成绿色。如溶液显绿色,再适当减少废水取样量,直至溶液不变绿色为止,从而确定废水样分析时应取用的体积。稀释时,所取废
水样量不得少于5ml,如果化学需氧量很高,则废水样应多次稀释。
注2. 废水中氯离子含量超过30mg/L时,应先把0.4g硫酸汞加入回流锥形瓶中,再加20.00ml废水(或适量废水稀释至20.00ml)、摇匀。以下操作同上。
② 冷却后,用90ml水冲洗冷凝管壁,取下锥形瓶。溶液总体积不得少于140ml,否则因酸度太大,滴定终点不明显。
③ 溶液再度冷却后,加3滴试亚铁灵指示液,用硫酸亚铁铵标准溶液滴定,溶液的颜色由黄色经蓝绿色至红褐色即为终点,记录硫酸亚铁铵标准溶液的用量。
④ 测定水样的同时,以20.00ml重蒸镏水,按同样操作步骤作空白试验。记录滴定空白时硫酸亚铁铵标准溶液的用量。
2.5.计算
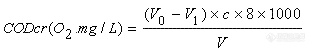
式中c——硫酸亚铁铵标准溶液的浓度(mol/L);V0 ——滴定空白时硫酸亚铁铵标准溶液用量 (ml); V1——滴定水样时硫酸亚铁铵标准溶液的用量(ml);V——水样的体积(ml);8——氧1/2O)摩尔质量(g/mol)。
haypiny
第5楼2006/08/10
采用不同的测定方法会出现不同的结果,表2-2收集了常见的有机化合物用两种不同方法测定COD时的氧化率。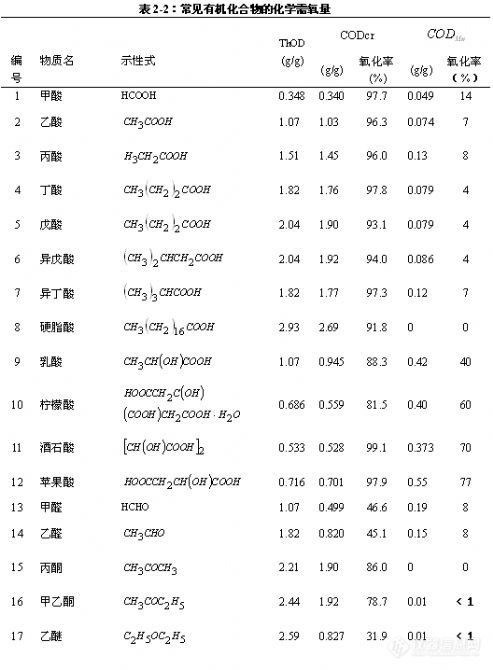

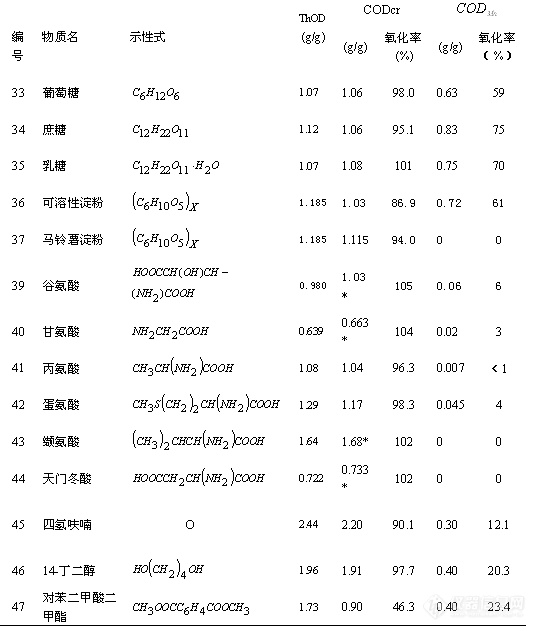
* 有部分氨基被氧化成 NO2,使其氧化率超过100%。但在较高压力的密闭反应系统中,其压力可抑制 NO2的生成,在0.2MPa时,其氧化率约为80%,在0.6MPa时,其氧化率约为50%。中国国家环境监测总站环境标准所配制的COD标准液是由谷氨酸和葡萄糖配制。
* 甲基苯酚为各异构体的混合体。
从以上介绍可以看出,如果我们将COD作为有机物含量这个指标,则显示出其不合理性。它不能覆盖测定所有的有机物,同时它又是一个条件性指标,即具有相同COD理论含量但化学结构上不同的物质其实际测定结果是不同的。因此,这个标准体系若将COD作为有机物含量来看,则不是计量学上不变性原则所要求的那种理想的标准体系。
但化学耗氧量指标的原意是为了了解水体中将有多少需要消耗水中氧气的物质。消耗水中氧气的物质不仅是有机物,还包括水中的还原性物质无机物。那些在重铬酸钾法中消解氧化率低的物质,在水中的耗氧也少,所以重铬酸钾法也有着其合理性。
如果我们将COD也作为有机物含量这个指标,其理由是在所有发明的废水测定的实验室方法中它是最为廉价的一个。因此它是在精度要求、测定成本、我国环境污染现状等多因素之间折中优化的产物,是这种意义上最好的方法。
我国现仍使用COD指标也是为针对我国水质的特殊性及保持历史数据的延续和可比较性。
haypiny
第6楼2006/08/10
3.1 现市场上已通过国家认证的仪器有以下几类:
a.重铬酸钾消解法 程序式 光度测量法
----------------------库仑滴定测量法
b.重铬酸钾消解法 流动注射式 光度测量法
c.氢氧基氧化 电化学测量方法
d.TOC转换COD法 燃烧法
---------------焦硫酸钠消解法
e.UV转换COD法 物理方法 紫外比色法
其中a,b,c,d的氧化能力差距很大,其氧化电位如下:
氧化剂 氧化电位
OH (氢氧基) 2.85V
K2Cr2O7 (重铬酸钾) 1.33V
由于CODcr是一个条件试验方法,不同的物质有不同的氧化率,故在线仪器的测量结果是以国标的手工测量法为标准。仪器以不同的条件进行实验,其氧化率不同时,就应通过和手工分析的数据进行比较,拟合校正曲线,使测量结果和手工法一致,但是这种拟合有一定的局限性。
haypiny
第7楼2006/08/10
3.2 重铬酸钾消解法
重铬酸钾法的在线分析仪器中,其氧化率和反应速度应氧化条件不同而分3类:
3.2.1 完全按照标准手工法的反应条件进行(程序式标准型)
程序式在线分析析仪器的概念是,仿照手工法,将取样、加试剂、加液计量、反应器、检测器、计算、清洗等集成在一起,通过电机、气动、阀门、管道,由各种控制器、电脑按设定的测量周期和程序,自动完成取样、定量、加试剂、反应、检测、清洗、计算、定标等
操作,实现在线自动分析。
COD程序式标准型仪器测量速度和标准手工法相近,需1-2小时,仪器构造基本是将手工法实验室的装置搬入仪器内,再加上气压输液系统、机电器件和控制系统,实现自动测量。有的仪器甚至连手工法的电炉和回流装置,都是一点不改地原样照搬进去。这种仪器的氧化率与标准手工法相近,测量范围通常是30―5000(通过改变试剂浓度、取样杯大小,分多档测量范围)。因是使用滴定法,水体色度对测定无影响,准确度较高。但结构复杂。
haypiny
第8楼2006/08/10
3.2.2 仿手工法,缩短氧化时间(程序式高温型)
缩短时间后,氧化率不够,通过用实际水样的手工法结果做标准拟合校正曲线,目前大
多程序式重铬酸钾法在线仪器都是这种方式。结构和器件较标准型仪器简单而先进,输液系统大多使用蠕动泵,反应温度提高,反应时间通常在30分钟。检测器大多是用波长为640nm的比色计,检测反应后生成的Cr3+的量。测量范围通常是30―5000(通过改变试剂浓度、取样杯大小,分多档测量范围)。
现在有的仪器为了避免水样突然超出测量范围而得不到定量结果,将仪器设计成400nm波长低量程式光度计和640nm波长高量程式光度计二个检测器,测量范围可分成0-500、100-1500、500-5000mg/L。为了克服蠕动泵引起的故障率,已有仪器使用注射泵取代之。
这类仪器较之标准型的仪器,简构大大简化,故障率下降,一些好的仪器,其准确度和精度都能满足这标要求,是目前大多国产厂家生产的仪器。由于反应条件和手工法不一致,所以安装调试时的工作量稍大,同时要求水质的成份变化不能太大。又由于大多是使用640nm的可见光测量,有色水体有可能干扰测量结果。

haypiny
第9楼2006/08/10
3.2.3高温高压法缩短氧化时间(流动注射式高温高压型)
流动注射分析(简称FIA)型COD在线分析仪就是通过高温(180℃)高压(0.6MPa)来加快消解反应速率,所选择的温度、压力、时间,使其氧化率和标准手工法氧化率基本一致。
FIA是由高效液相色谱发展起来的新技术,在发达国家应用很普及,是溶液分析的革命性新技术。其定义为:“从注入一定体积并在无空气分隔的连续载流中得到分散的试样区带形的浓度梯度中收集信息的技术”。
COD仪流动注射分析原理示意图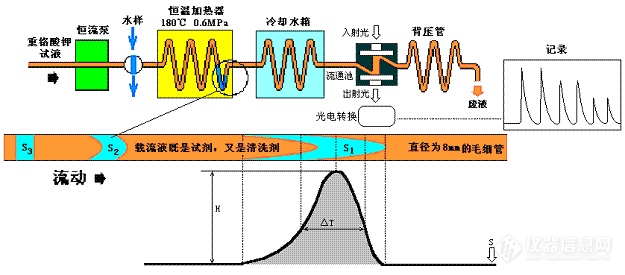
FIA的主要特点可以概括为:
① 广泛的适应性
FIA可与多种检测手段联用,既可完成简单的进样操作又可实现诸如在线溶剂萃取、在线柱分离及在线消化等较复杂的溶液操作自动化。它还是一种比较理想的进行自动监测与过程分析的手段。
② 高效率
一般分析速度可达100-300样/h,包括较复杂的处理,如萃取、吸着柱分离等过程的测定也可达40-60样/h。
③ 低消耗
FIA是一种微量分折技术:一般消耗试样为l0-100ul测定,试剂消耗水平也大体相似。与传统手工操作相比,可节约试剂与试祥90%一99%。这对于使用贵重试剂的分析有重要意义。
④ 高精度
完全密封的系统,降低了外界环境接触影响,如大气接触影响等,所有样品都采用了同样的方法分析出来,因此可得到更高的分析精度及重复性。一般FIA的测定精度可达0.1%—1%RSD,多数优于相应的手工操作。即使是很不稳定的反应产物或经过很复杂的在线处理,测定精度仍可达1.5%一3%RSD。
⑤ 设备简单
对于最简单的FIA仪器,仅有一个恒流泵,一个注样阀,一根毛细管,一个检测器即可。古语云:大道简易。即愈是高级的,愈是简单。
FIA技术应用于COD在线分析,是国家“九五”、“十五”攻关的优先项目。因为COD仪使用FIA技术有着其他方法无法获得的优越性:
利用其峰宽信息,可直接测量很低和很高的浓度。测量范围为3.5—50000mg/L
利用380nm比色光源测定Cr+6的量,使仪器的灵敏度大大提高,检出限大大降低.,可测很低的浓度。因使用的紫外光源,避免了因使用640nm附近的比色光源测定Cr+3引起的对水体色度的不适性。
微径毛细管流动装置可方便、安全地利用高温高压,使测定速度大大加快,最短测量周期为7分钟/个样,实现真正意义上的在线监测。由于使用高温高压绝大多数水质不需使用硫酸银和硫酸汞。
在0.6MPa反应条件下,Cl-≤400mg/L时,无需加Hg掩蔽
Cl- + Cr2O3-2 + H+ → Cr+3 + Cl0↑
氯离子在400-1500mg/L时只需加入1克即可有效掩蔽(0.001g/每样次,是国标法的1/400)。加入2g硫酸汞/2500mL可有效掩蔽4000mgCl-/L;加入3g硫酸汞/2500mL可有效掩蔽6000mgCl-/L
由于是微量分析技术可大大节约运行成本,又因是相对比较分析,其试剂可以循环反复使用,大大减少了运行费用。以仪器每天6个样品及自动标定计算,每年试剂费用只要90元钱。这目前是各种测量方法中费用最低的了。而且由于试剂循环使用,没有了二次污染。
因FIA易于实现自动化,其结构很简单,加上用陶瓷注射泵取代故障率较高的蠕动
泵及采用免维护取样系统,使仪器无易损备件,故障率很低。
FIA法从根本上区别于其他溶液自动分析技术之处在于充分利用了在细管道中被注入连续流动液流中的塞状试祥的分散(即物理混合)过程的高度重现性而不是去追求均匀的混合状态。图5.4b是塞状试样在流过一段管道后出现的典型分散状态,如果载流同时是试剂,可以看出二者已在一定程度上相互渗透混合,如果载流流速不变,在一定的留存时间时,虽然混合是很不完全的,但分散状态是完全可以重现的。这与图中手工加入试剂后的混合状态形成了鲜明对比。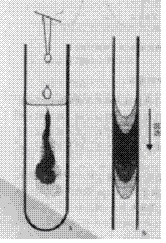
haypiny
第10楼2006/08/10
3.3 非重铬酸钾法
3.3.1 氢氧基法-(电化学测量方法)
其测量原理是用电化学反应,当污水与电解质Na2SO4定量进入反应槽,污水中所含的有机物会被电极表面所产生的氧化剂“氢氧基”所氧化,同时也消耗电流。
当工作电极(PbO2电极)保持一定电位时,污水中的有机物被氧化所消耗的电流与有机物的浓度呈一定关系,在校正后可计算出COD值。
由于氧化剂OH的氧化电位,大大高于重铬酸钾,使得一些用K2Cr2O7法氧化率低的化合物氧化率变高,而且其各种物质的氧化率提高的系数不一致,这样,在测量单一成分水样或固定成分水样时可以拟合,对于常变化成分的水样就无法拟合校正曲线,使得分析结果与标准方法不一致。
氢氧基法的仪器结构简单、不使用有害化学试剂、测量速度极快,反应30秒钟即可完成,最短测量周期6分钟,通常是半年换一次电极。运行成本较低,故障率也较低。
haypiny
第11楼2006/08/10
总有机碳(TOC),是以碳的含量表示水体中有机物质总量的综合指标。由于一切有机物都含碳元素,加之TOC的标准测定方法采用燃烧法(900℃),因此能将有机物全部氧化,它比BOD、COD更能直接表示有机物的总量,因此常常被用来评价水体中有机物污染的程度。
T0C测量原理
采用高温燃烧法测量T0C值。普通热催化氧化反应温度在680℃和900℃之间,样品注入两个反应器中,在高温下样品中的所有无机碳和有机碳都被转化成二氧化碳,并通过载气排出。经冷却、除湿干燥后,到达非分散红外检测器(NDIR),检测出二氧化碳的含量。检测信号为波峰形式,此波峰面积与样品中的总碳(TC)浓度成正比,利用校准曲线就可计算出样品中的总碳浓度。
测量总无机碳(TIC)时,将酸性液体连续地注入反应器中的样品中,并通过载气将反应
生成的CO,排出。经冷却、除湿干燥后,到达非分散红外检测器,检测出二氧化碳的含量。总无机碳的检测信号为波峰形式,此波峰面积与样品中的总无机碳浓度成正比,利用校准曲线就可计算出样品中的总无机碳浓度。
采用差值法,即TOC=TC-TIC,
TOC是以样品中有机物的含碳个数进行计量换算有机物量的,所有有机物均以100%计算出C个数。
如下图示: 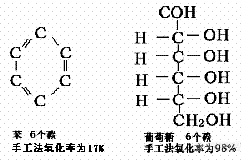
这样,如果排污水样成分不定,当标定时,使用的校正用水样如果只含葡萄糖,那么某水样中含有苯时,测得的COD就会比标准手工法高出5倍多。
近年来,国内外已研制出各种类型的TOC分析仪。按工作原理不同,可分为燃烧氧化非分散红外吸收法、电导法、气相色谱法、湿法氧化非分散红外吸收法等。这些不同的方法适应了不同的水质、价格和测定成本之间的优化要求。通常TOC法的仪器结构较复杂、不
使用有害化学试剂、测量速度极快,测量仅需3分钟,测量周期5分钟,测量范围1—200、5—2000、100—50000mg/L。在计量学、无二次污染和测定速度等方面比COD优越。