在纳米科技和材料科学的研究中,粒径分布是一个非常重要的参数,它直接影响到纳米材料的性能和应用。而衡量粒径分布的方法有很多,其中最常用的两个指标是多分散指数(PDI)和粒径分布宽度(SPAN)。那么,它们到底有什么区别呢?

01
多分散指数(PDI)

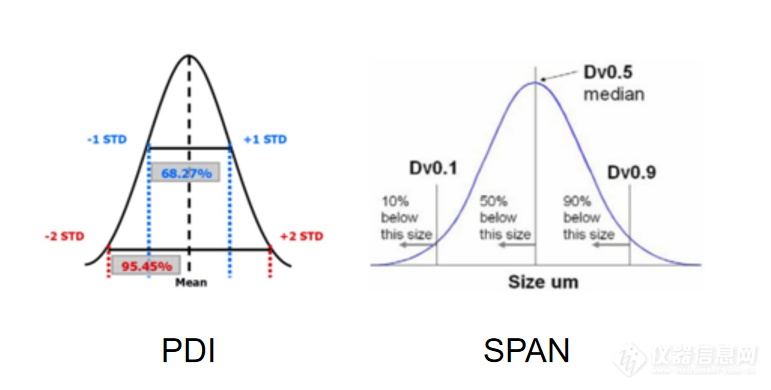
多分散指数(Polydispersity Index,PDI)是表征颗粒分布均匀程度的重要参数之一,它是实际粒径分布与理想单分散体系(即所有颗粒大小相同)之间的偏差度量。PDI的数值通常由动态光散射(DLS)测量得到,反映了颗粒尺寸分布的宽度和均匀性。
PDI的计算公式如下:
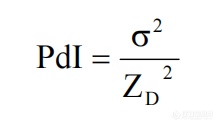
其中,σ是颗粒的标准偏差,ZD 表示光强加权平均粒径。PDI的数值范围一般在0到1之间:
PDI = 0:表示完全单分散,即所有颗粒的尺寸完全相同。
PDI < 0.1:表示较高均一的分散体系。
PDI > 0.5:表示体系中颗粒尺寸分布较宽,存在较大程度的多分散性。

02
粒径分布宽度(SPAN)

粒径分布宽度(SPAN)是另外一个表征颗粒分布宽度的指标。SPAN通常用于表征非对称分布的颗粒体系,特别是在颗粒直径分布呈现较大偏斜时。
SPAN的计算公式如下:
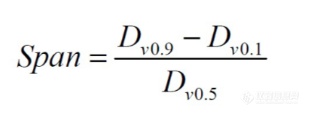
其中,d10、d50和d90分别表示粒径累计分布达到10%、50%和90%的粒径值。SPAN值越大,表明颗粒尺寸分布越宽。

03
PDI与SPAN的区别

在纳米颗粒粒径分布评价中,常规的PBE分析是基于D10、D50、D90和SPAN的;其中D50和SPAN作为主要BE参数,D10和D90作为支持参数;目前,无论是作为选项还是要求,Z-average和PDI仅作为D50和Span的替代品,作为某些产品(如DLS设备)在无法给出SPAN时所采用的替代方案;与SPAN相比,PDI放大了的T/R(受试药物与参比药物)差异;与SPAN相比,想通过PBE评价,使用PDI可能更困难。
4、数值范围和标准不同:
PDI的数值范围在0到1之间,主要用于评估颗粒分布的均一性。而SPAN没有固定的范围,更加关注颗粒分布的宽度。

04
结论

对于科学研究和工业应用,选择合适的指标进行表征,有助于更好地理解和控制纳米颗粒的特性和行为。总的来说,PDI和SPAN都是评估纳米颗粒粒径分布的重要指标,它们在不同的应用场景中有各自的优势和适用性。
对于采用当前药物开发中科学评价PBE的角度,PDI不是合适的参数,也不是替代SPAN的正确选择。PDI可能仅仅是伴随DLS技术的广泛使用才应用到药物颗粒评价中的,但用于药物递送中外泌体、脂质纳米粒、病毒粒等生物颗粒样本往往是多分散的,DLS等基于颗粒布朗运动的表征方法严格上说并不适用。因此,国家药品监督管理局(NMPA)药品审评中心亦在发文中建议除平均粒径外,积累颗粒累积分布D10,D50,D90,SPAN及总颗粒数等研究数据。由于DLS方法原理测算的是拟合平均粒径 (Z-average),无法给出颗粒累积分布D10,D50,D90参数,因此建议采用多种检测方法对纳米颗粒进行深入研究 [1]。
通过本文的介绍,希望大家对PDI和SPAN有了更清晰的认识,在以后的研究和应用中,能够更加准确地选择和使用这些指标。
[1] 杨丹,赵欣,李小静,李敏. 预防用mRNA疫苗脂质纳米颗粒质量研究及质量控制药学评价的考虑. 中国新药杂志. 2023年 第32卷 第24期
[2] Pathak SM, Ruby PK, Aggarwal D. In vitro and in vivo equivalence testing of nanoparticulate intravenous formulations. Drug Res (Stuttg). 2014;64(4):169-176. doi:10.1055/s-0033-1357204
文献速递| 使用电阻脉冲感应方法评估五种细胞外囊泡分离方法的质量和效率
【Nature子刊】改进与优化基于NTA的EV单颗粒荧光标记及检测方法
干货:MISEV2023指南解读(一):EV的表征
揭秘颗粒表征方法的LOD:如何选择最精准的检测方法?
相关产品

关注

拨打电话

留言咨询