

在本研究中,我们采用了基于电阻脉冲感应 (RPS) 策略的NanoCoulter颗粒分析仪,能够对单个EVs进行多参数分析,用于比较传统差速超速离心法、超滤法、尺寸排阻色谱法、膜亲和结合法和聚合物沉淀法等不同EV分离技术的质量和效率。数据表明,基于RPS策略的NanoCoulter 分析仪在EV表征中是可靠且有效的。结果显示,虽然在三种商业化分离试剂盒和超滤法中观察到较高的颗粒浓度,但传统的差速超速离心法表现出最高的纯度。总之,我们的研究结果为不同EV分离方法的评估提供了可靠证据,这有助于开发基于EV的疾病生物标志物和治疗方法。

引言

细胞外囊泡 (EVs) 是从不同细胞和生物流体中分离出的纳米级囊泡,高纯度EV的分离和表征被认为是临床应用中的重要挑战。国际细胞外囊泡学会和中国细胞外囊泡学会已经发布了一套关于EVs分离和质量评估的团体标准。
传统的差速超速离心法 (UC) 被认为是EVs分离的“金标准”,可以有效地从各种细胞和生物流体中分离出EVs。最近,市面上已经出现了一些基于不同原理的商业化分离试剂盒,包括尺寸排阻色谱 (SEC) 、聚合物沉淀、膜亲和分离和超滤 (UF) 等。例如,Izon公司的qEV是一种SEC柱;System Biosciences公司的ExoQuick基于聚合物沉淀原理;Qiagen公司的exoEasy依赖于膜的亲和结合;Millipore公司的超滤管是一种离心过滤装置。为了提高纯度,研究人员已经尝试将不同的方法结合起来,如超离和SEC,以分离EVs。尽管这些试剂盒使用耗时较短,且无需特殊设备,但由于EV质量的不确定性,其在科学和临床应用中的适用性尚不明确。特别是对于血浆或血清样本而言,EV和脂蛋白颗粒在粒径和密度上存在显著重叠,这通常会导致这两种不同成分在分离时混合在一起。此外,在将分离的EV用于下游蛋白质组学、核酸组学和脂质组学分析之前,必须使用粒径、浓度、zeta电位和纯度等不同参数全面表征EV的质量和数量。
目前,已经有多种技术用来比较各种EV分离技术的分离效率,包括透射电子显微镜 (TEM) 、动态光散射 (DLS) 、纳米颗粒追踪分析 (NTA) 和纳米流式细胞术 (nFCM) 。TEM具有高分辨率,能够检测单个颗粒的真实数据,但使用前的样品处理复杂,且检测颗粒数量有限。此外,TEM技术无法表征液体环境中的颗粒。DLS通过平均颗粒散射光的总强度来获得数据,由于瑞利散射定律的原理,较大颗粒的信号会严重屏蔽较小颗粒的信号,因此无法获得每个颗粒的真实数据。NTA难以揭示所有尺寸EV的全貌,因为其最小可检测尺寸为70-90 nm。另外,NTA的操作过程复杂,使用前需要进行校准和上样浓度摸索等。nFCM结合了瑞利散射和鞘流单分子荧光检测技术,扩展了传统流式细胞术在纳米颗粒检测中的应用,实现了纳米尺度病毒、EV等的检测。但其检测范围仅限于与二氧化硅纳米颗粒折射率相似的纳米颗粒样本。
电阻脉冲感应 (RPS),也称为库尔特技术,可以基于单颗粒检测精确测量溶液中颗粒的大小和浓度。在恒定电流驱动下,颗粒可以通过绝缘膜中充满电解质溶液的小孔。由于颗粒在孔中排斥相应体积的电解质溶液,膜内的电阻发生变化,从而在实时测量中观察到电压脉冲。获得的单个电压脉冲包含颗粒大小、数浓度和zeta电位等详细信息,实现了EV的单颗粒检测。RPS技术可以准确表征各种复杂环境中的纳米颗粒,无论液体环境中的折射率是否较低、离子浓度是否较高或流动性是否较差。在实际应用中,大多数测量的样品都由复杂且不均匀的组分组成。例如,EV包含核酸、蛋白质、脂质等多种复杂内容物,同时粒径分布有大有小。基于整体的纳米颗粒传统表征方法难以准确表征多分散性的纳米颗粒,如EV的组成和比例。RPS技术受颗粒与分散介质之间相互作用的影响较小,对检测复杂样品表现出优异的性能,并且具有基于单颗粒数据的统计能力。此外,RPS技术还可以简单快速地同时测量颗粒的大小和zeta电位。
因此,本研究中使用人血清作为模型系统来提取EV样本,并将三种商业分离试剂盒和超滤的性能与经典超离方法进行了比较。基于RPS技术,在NanoCoulter颗粒分析仪上测量了EV样本的粒径、尺寸分布、颗粒浓度、zeta电位和纯度等特性。

材料与方法

从一名健康志愿者处采集了30 mL外周血,并获得了健康志愿者的知情同意书。本研究中人体血样的采集已经过伦理委员会的批准。血液以3500×g离心10 min,获得的上清液(血清)被收集并储存在−80°C,以备后续使用。
使用5种方法从分离的血清中提取了EVs,包括传统的差速超速离心法、超滤法以及3种市售的EV提取试剂盒:
血清以3500×g离心20 min,然后在4°C下以15000×g离心30 min。随后,用 0.22 µm的滤膜过滤上清液,并在超速离心机 (Beckman Coulter, USA) 中以100000×g在4°C下离心2 h。之后,弃去上清液,获得的EVs用PBS重悬。
使用Amicon® ultra-0.5离心过滤装置 (Millipore Amicon® Ultra 100 K) 对血清进行纯化和浓缩。具体步骤如下:将血清用PBS稀释至2 mL。稀释后的血清被加入到预先用PBS冲洗的过滤器中。样品在4°C下以12000×g离心15 min进行浓缩。随后,用PBS冲洗滤液,并在4°C下再次以12000×g离心10 min。最后,将滤器倒置在另一个微量离心管中,并以2000×g离心5 min,将浓缩后的样品转移到管中。
参照制造商的说明,使用exoEasy Maxi试剂盒 (Qiagen, 76064) 进行实验。使用0.8 µm孔径的滤膜 (Millipore Millex-AA, SLAA033SB) 从血清中排除大颗粒。将血清样本与XBP缓冲液1: 1充分混合,轻轻翻转试管5次,然后将该混合物加入exoEasy亲和柱,并在室温下500×g离心1 min。向混合物中加入10 mL XWP缓冲液,并以5000×g离心5 min,以去除柱上剩余的缓冲液。然后,将柱转移到一个新的收集管中,向柱膜上加入400 µL XE缓冲液,并孵育1 min。最后,将亲和柱以500×g离心5 min,收集洗脱液。
qEV柱 (Izon, 1000871) 在使用前至少用10 mL PBS平衡。然后,将500 µL制备好的血清滴加到柱子上,并立即以每管500 µL的体积收集不同的分级。在纯化过程中用PBS洗脱EVs。由于前17个分级不包含EVs,因此被弃去。将第18到26个分级组合起来作为下游分析的EV样品。在进行下一步分析之前,通过超滤对其进行浓缩。
将ExoQuick分离试剂盒 (System Biosciences) 中的ExoQuick ULTRA加入到250 µL血清中,并将混合物在4°C下孵育30 min。然后样品以3000×g离心10 min。将得到的EVs重悬转移到预先洗涤过的ExoQuick ULTRA柱中。然后将柱以1000×g离心30 s。
使用NanoCoulter颗粒分析仪 (Resun Technology公司,深圳) 检测粒径、颗粒浓度和zeta电位。在电解质溶液中的纳米孔芯片两侧各有两个电极。当电流通过孔时,在孔周围会产生一个“电感应区”。当颗粒穿过充满电解质溶液的纳米孔时,颗粒会部分置换电解质,瞬间增加电感应区的电阻并产生脉冲信号。该仪器使用NanoCoulter软件准确测量和分析脉冲信号,并获得包括粒径、浓度和zeta电位在内的多维数据 (n=3) 。NanoCoulter颗粒分析仪基于库尔特原理,当测量颗粒穿过孔时,孔内溶液被短暂置换导致膜上孔离子电流的减少。每当粒子穿过孔时,仪器都会记录位阻事件信号。测得的位阻信号的大小与粒子的体积成正比,从而可以确定粒子的直径。设备使用已知尺寸的标准微球溶液作为参考进行尺寸校准。该(聚苯乙烯)标准微球可以从商业供应商处购买(具备NIST可追溯的尺寸标准及证书),其真实直径已通过电子显微镜确认。
在进行纳米流式操作之前,打开仪器的激光器并冲洗管道4 min。使用质控微球调整仪器状态,先后对标准粒径微球、PBS缓冲液进行测试。之后,对提取的EV样品 (100 µL) 进行适当稀释。使用相应的软件计算粒径和浓度结果 (n=3) 。
将通过超离 (UC) 、超滤 (UF) 、exoEasy、qEV和ExoQuick方法制备的10 µL EV样品放置在涂有碳的网格上,并干燥5 min。用2%磷钨酸对样品进行负染色1 min。然后使用在120 kV下运行TEM (Tecnai G2 Spirit BioTwin) 对样品进行成像。
实验数据以平均值±标准差 (S.D.) 表示。误差条 (error bars) 代表三次重复实验的标准差。使用ORIGIN软件 (ORIGIN,马萨诸塞州,美国) 对数据进行分析。

结果

RPS检测平台由两个部分组成,即AI数据处理模块和检测卡模块。AI数据处理模块包括:电源模块、AI处理模块、信号采集模块和测量基座 (图1a–d) 。电源模块为系统提供电力,AI处理模块为软件算法提供数据处理功能,信号采集模块提供高速数据采样和智能识别功能,测量基座用于插入检测卡。检测卡模块由硅基芯片和测试组件组成,检测卡由两个可拆卸的腔室结构组成,硅基纳米孔芯片位于腔室中间。一个腔室加入电解质缓冲液,另一个腔室加入悬浮在缓冲液中的样品。通过在腔室之间施加电压,离子电流从一个腔室流出,并通过纳米孔进入另一个腔室,形成电流回路。当颗粒穿过充满电解质溶液的纳米孔时,它将进入通道,并排除部分电解质,从而增加纳米孔的电阻,使离子电流降低。信号采集模块捕捉到检测电流的瞬时变化,产生电阻脉冲。与颗粒穿过纳米孔相关的一系列电阻脉冲使得每个单独的颗粒都可以被测量。脉冲的高度与颗粒尺寸相关(正比),脉冲的宽度与颗粒的zeta电位相关(反比),脉冲的频率与颗粒浓度相关。这些纳米颗粒的数据通过NanoCoulter软件进行处理 (图1e和f) 。
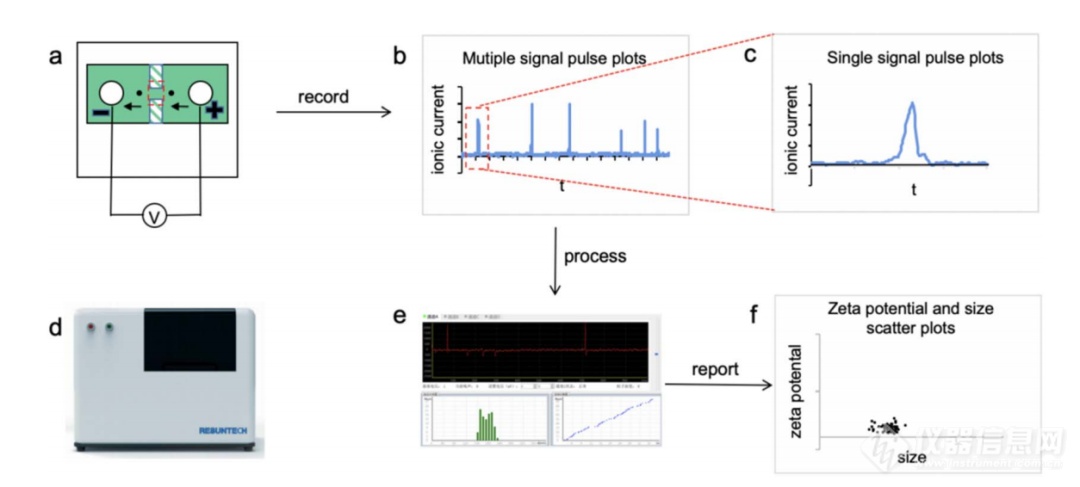
图 1. NanoCoulter颗粒分析平台工作原理示意图。
3.2 EV制备的颗粒尺寸和浓度分析
使用超离、超滤和三种不同的商业化试剂盒从血清中分离EVs。使用基于RPS策略的NanoCoulter 分析仪测量颗粒尺寸和浓度。测试原理如下:当导电液体中的颗粒通过纳米孔时,颗粒与导电液体之间的电导率差异会导致电极之间的电压发生一定变化,形成脉冲信号。脉冲的振幅对应颗粒的体积和尺寸,脉冲的频率对应颗粒的数量和浓度。
在开始测量之前,对EV样品进行了适当的稀释。图2和图3显示了通过不同分离方法制备的EVs的颗粒尺寸分布及其平均/中位粒径。结果显示,从人类血清中分离出的EVs的尺寸在EV的预期范围内 (30-150 nm) 。UC (71 nm) 、UF (71 nm) 、exoEasy (71 nm) 和qEV (67 nm) 方法制备的EVs的平均直径没有显著差异,并且具有相对狭窄的尺寸分布。UC的中位粒径为71 nm,UF为70 nm,exoEasy为70 nm,qEV为66 nm,这与平均尺寸一致。相比之下,ExoQuick分离的EVs表现出相对更宽的尺寸分布。测得的平均尺寸为77 nm,中位尺寸为75 nm,比其他四种方法稍大。
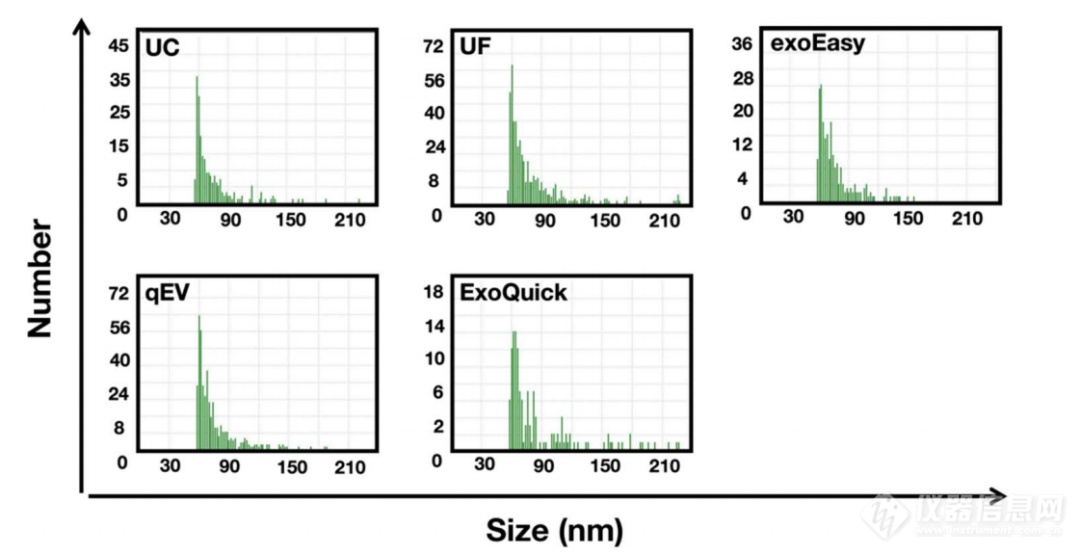
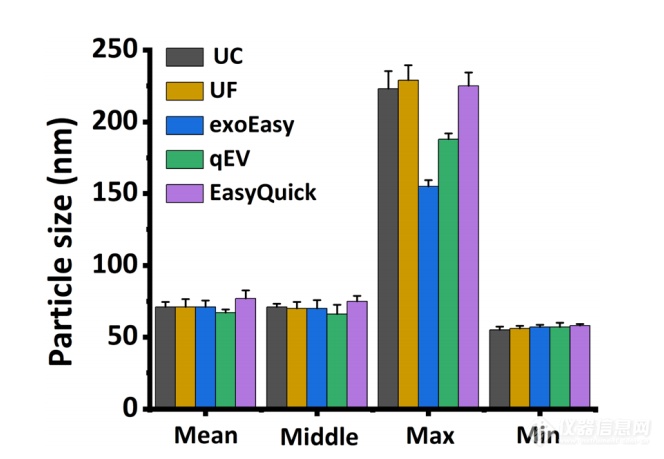
图 3. 五种EVs分离方法制备的 EVs 的粒径中值、平均值、最大值和最小值(n = 3)。
接下来,我们评估了不同分离方法制备的EVs的颗粒浓度。由于EVs的数量和浓度取决于所用的初始血清量,因此基于其初始血清体积进行了统计分析。原始颗粒浓度基于样品的测量浓度和稀释因子进行计算。图4和表1显示了不同样品的颗粒浓度。结果显示,与其他四种分离方法相比,UC的颗粒产量显著减少。UC分离的EVs颗粒浓度仅为7.33×10¹⁰ particles/mL。值得注意的是,如果在UC分离过程中存在大量EVs的损失,血清中EVs的颗粒数量可能会被严重低估。exoEasy分离的EVs颗粒浓度为9.14×10¹⁰ particles/mL,比UC略高,而UF方法、qEV和ExoQuick分离的EVs颗粒浓度则比UC和exoEasy高得多,分别为3.72×10¹¹ particles/mL (qEV) 、8.82×10¹¹ particles/mL (ExoQuick) 和2.10×10¹² particles/mL (UF) 。在所有分离方法中,UF方法显示出最高的颗粒浓度,而UC则显示出最低的颗粒浓度。UC分离的EVs颗粒浓度分别比UF、ExoQuick、qEV和exoEasy方法低28.6倍、12.0倍、5.1倍和1.2倍。
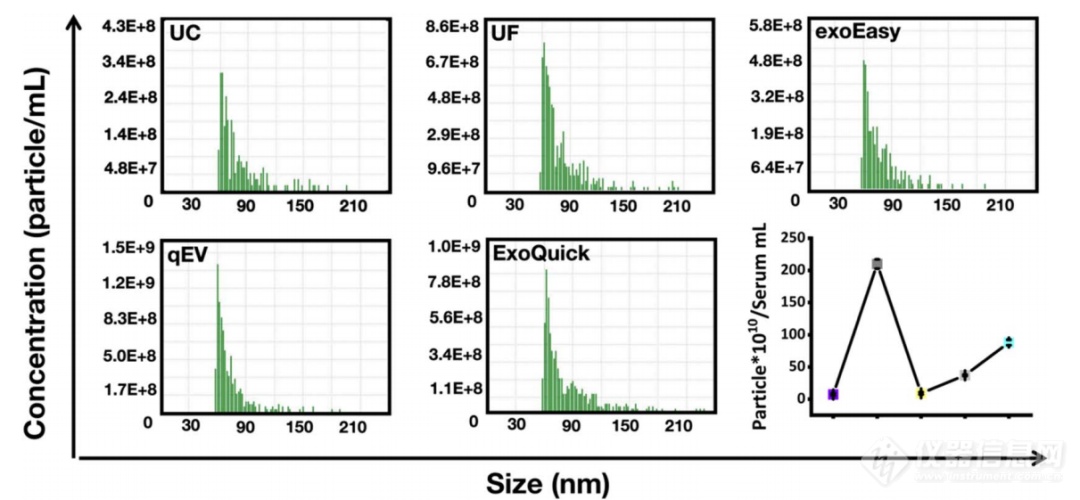
图 4. 五种EVs分离方法制备的 EVs 的粒子浓度分布直方图。折线图展示了每毫升血清中的粒子浓度,误差线表示每种分离方法三次重复实验的标准偏差 (S.D.)。
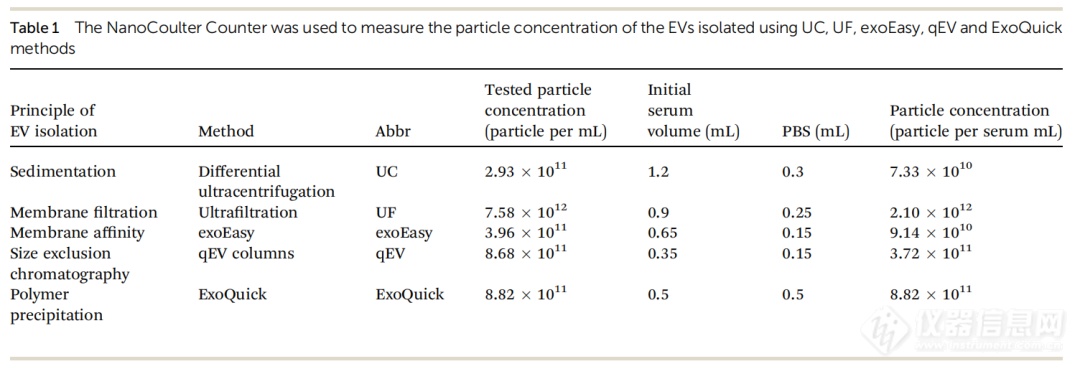
表 1.五种EVs分离方法制备的 EVs 粒子浓度。
我们将EV样品稀释到不同比例,使用NanoCoulter 颗粒分析仪测量颗粒尺寸和浓度的实验稳定性。如表2所示,不同稀释比例下EVs的直径和浓度几乎没有显著差异。这表明NanoCoulter在测量EV样品的颗粒尺寸和浓度方面具有较高稳定性。
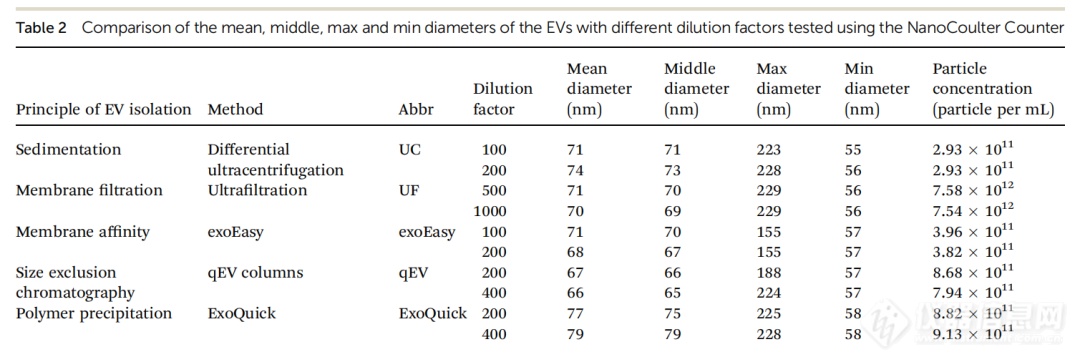
表 2. 不同稀释倍数的 EVs 的平均、中位、最大和最小粒径的比较。
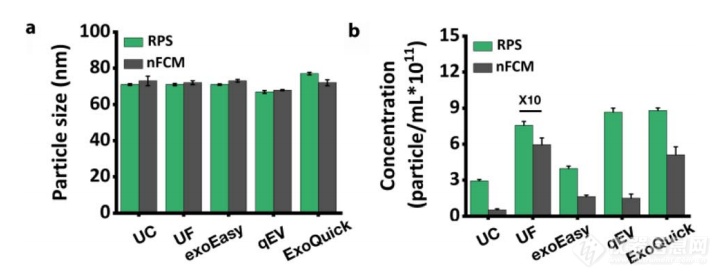
nFCM是一种常用的EV制剂颗粒尺寸和浓度的测量方法。因此,我们比较了使用NanoCoulter 颗粒分析仪和nFCM纳米流式测试的EV尺寸和浓度。结果显示在表3和图5中。我们可以得出结论,两种方法获得的粒径没有显著差异,但使用NanoCoulter 分析仪测试的不同EVs的浓度比nFCM的结果普遍要高。
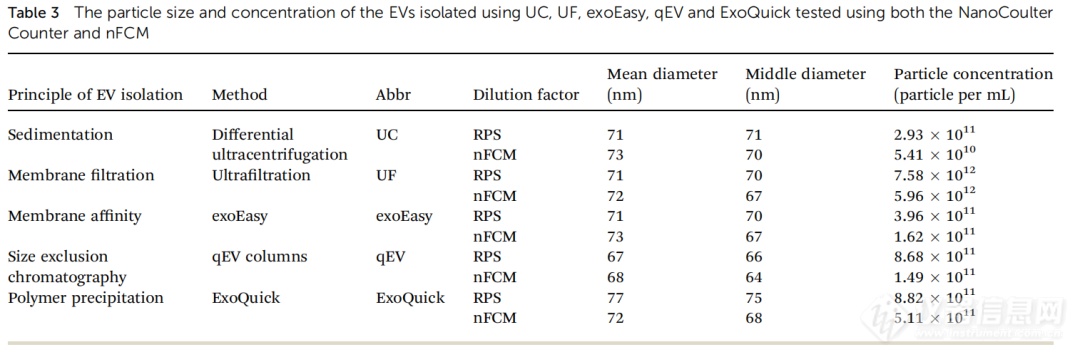
表 3. 使用NanoCoulter 和 nFCM 测试五种EVs分离方法分离的EVs 的粒径和浓度。
使用RPS方法检测Zeta电位的原理如下:当带电颗粒穿过纳米孔时,由于颗粒排除了与其体积相同的溶液,孔内的电阻发生变化,产生相应的电压脉冲。脉冲的宽度对应颗粒的电泳迁移率及相应的Zeta电位。
Zeta电位的数值与胶体分散的稳定性有关。Zeta电位是测量颗粒之间相互排斥或吸引力的强度。通常认为,颗粒的Zeta电位(绝对值)越高,溶液体系越稳定;Zeta电位(绝对值)较低时,颗粒倾向于在溶液中凝聚,意味着吸引力超过排斥力,破坏了其分散性,从而导致聚集和沉降。常用的电位测量方法主要是电泳法,它通过多普勒电泳光散射来测量纳米颗粒的Zeta电位。在本研究中,我们也使用NanoCoulter 颗粒分析仪检测Zeta电位。图6和表4显示了不同EVs的Zeta电位均为负值,范围在-10.18至-19.68 mV之间。ExoQuick的Zeta电位为-10.18 mV,是所有组中最低的(绝对值)。UC显示出较高的绝对Zeta电位值 (-16.45 mV) ,而UF、exoEasy和qEV的Zeta电位最高(绝对值),且三者之间无显著差异 (UF: -19.26 mV,exoEasy: -19.27 mV,qEV: -19.68 mV) 。
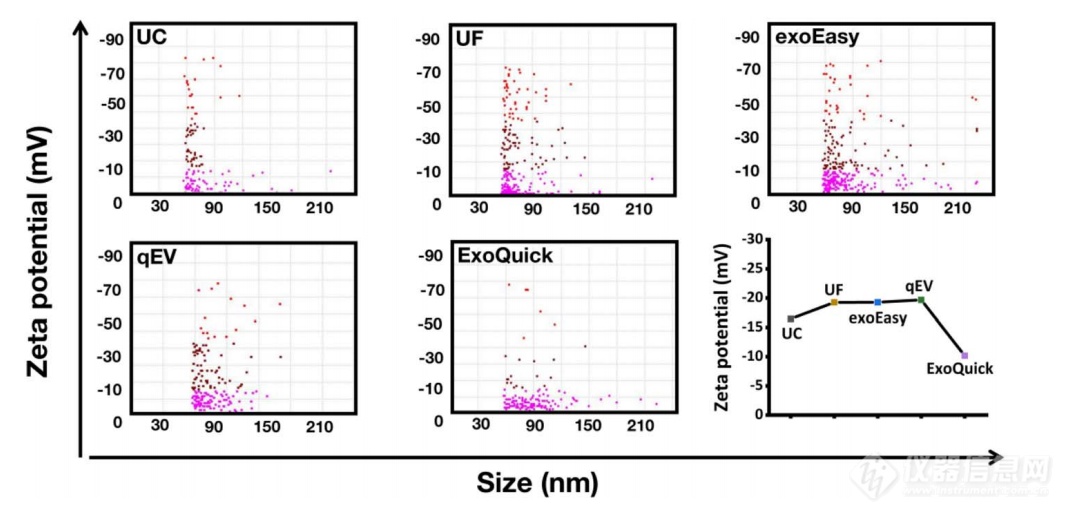
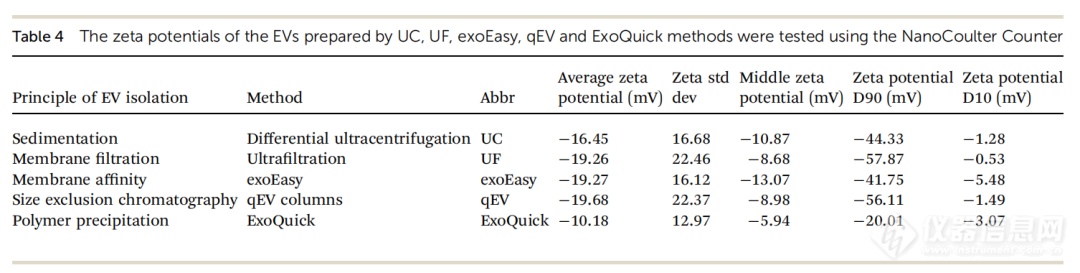
表 4. 五种EVs分离方法制备的 EVs的zeta电位。
根据NanoCoulter和nFCM的测试结果,制备的血清EVs的直径均在EV的预期范围内 (30-150 nm) 。我们进一步使用透射电子显微镜 (TEM) 对不同EVs制备的形态进行了表征,这是公认的纳米颗粒表征技术。图7展示了通过不同分离方法制备的EVs的典型TEM图像。除了UF方法,使用UC、exoEasy、qEV和ExoQuick方法分离的EVs均在TEM图像中清晰地呈现出“杯状”结构。它们的尺寸分布轮廓与已鉴定EVs的尺寸分布曲线非常相似,大多数颗粒的直径小于80 nm。所有样本中都能明显看到密集的蛋白质颗粒。尤其是使用UF方法分离的EVs在冷冻后显示出潜在的聚集倾向。我们经过努力仍然无法找到单个颗粒,因此从TEM图像中观察到的EVs尺寸相对较大。总体而言,我们的TEM图像数据显示,除UF方法外,其他方法均能在尺寸范围和形态方面隔离出质量较高的EVs。

图 7. 通过 UC (a)、UF (b)、exoEasy (c)、qEV (d) 和 ExoQuick (e) 方法制备的 EVs 的 TEM 图像(a、c、d、e 的尺度条:100 nm,b 的尺度条:1 mm)。
TSG101、CD63和CD81在高浓度时被广泛用作EVs的经典蛋白标志物,从而表示EVs的高纯度。图8展示了使用五种不同方法制备的血清EVs中TSG101、CD63和CD81蛋白的表达。在相同蛋白浓度下,UC、UF、exoEasy和qEV方法分离的EVs均表现出高强度和高度相似的蛋白表达。值得注意的是,ExoQuick组的免疫印迹不够清晰,这可能是由于该样本中EV标志蛋白浓度相对较低。
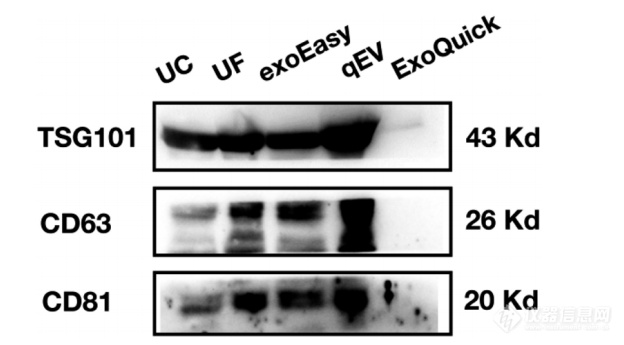
图 8. 通过 Western blot 分析五种EVs分离方法分离的 EV 样本中 TSG101、CD63 和 CD81 的表达。
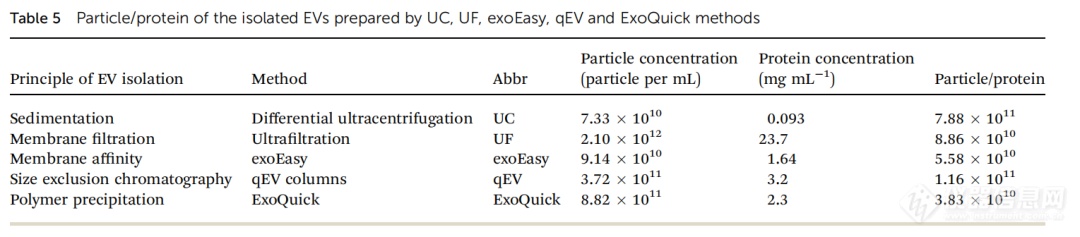
从血清中分离出的EVs不可避免地含有诸如蛋白质聚集物和脂蛋白等非囊泡物质。颗粒数量与蛋白质浓度的比值是评估EV纯度的方法之一。每毫克蛋白质的颗粒数量越多,EV的纯度就越高。因此,我们使用NanoCoulter测量了不同纯化方法得到的EVs的颗粒数量,并使用BCA试剂盒测量了蛋白质浓度。EVs的颗粒/蛋白比值显示,UC分离的EVs纯度最高 (7.88×10¹¹,见表5) 。qEV分离的EVs纯度略低于UC,颗粒/蛋白比值为1.16×10¹¹。然而,UF (8.86×10¹⁰) 、exoEasy (5.58×10¹⁰) 和ExoQuick (3.83×10¹⁰) 方法的EVs纯度较低。
结论

综上所述,我们使用UC、UF、exoEasy、qEV和ExoQuick方法从血清中制备了EVs。使用基于RPS原理的NanoCoulter 颗粒分析仪对EVs的直径、浓度和Zeta电位进行了表征,证明了它们的纯度和制备效率。我们的研究表明, NanoCoulter 方法为EV表征提供了可靠且有效的数据。结果进一步显示,UC方法分离的EVs具有高性能和高纯度。该研究工作在EVs诊疗领域的应用中具有广阔的前景。
本论文由中国农业科学院特产研究所与吉林大学中日联谊医院联合发表。中国农业科学院特产研究所彭英华研究员为论文的通讯作者,杨敏博士为论文第一作者。本研究得到了吉林省科学技术发展计划项目的经费支持。
参考文献

粒径分布计算用PDI还是SPAN? 别再傻傻分不清了
【Nature子刊】改进与优化基于NTA的EV单颗粒荧光标记及检测方法
干货:MISEV2023指南解读(一):EV的表征
揭秘颗粒表征方法的LOD:如何选择最精准的检测方法?
相关产品

关注

拨打电话

留言咨询