临床急需境外新药审评审批工作程序之二(政策图解)
导读:国家药品监督管理局官方微信公众号“中国药闻”发布了临床急需境外新药审评审批工作程序之二的图解版本,该版本为广大受众群体提供了更加清晰、直观的政策解读方式。
国家药品监督管理局官方微信公众号“中国药闻”发布了临床急需境外新药审评审批工作程序之二的图解版本,该版本为广大受众群体提供了更加清晰、直观的政策解读方式。
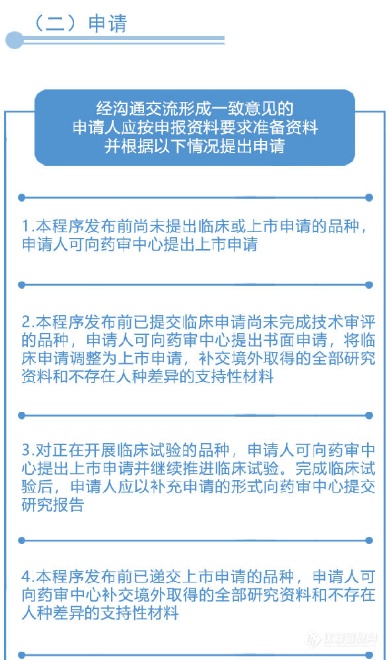
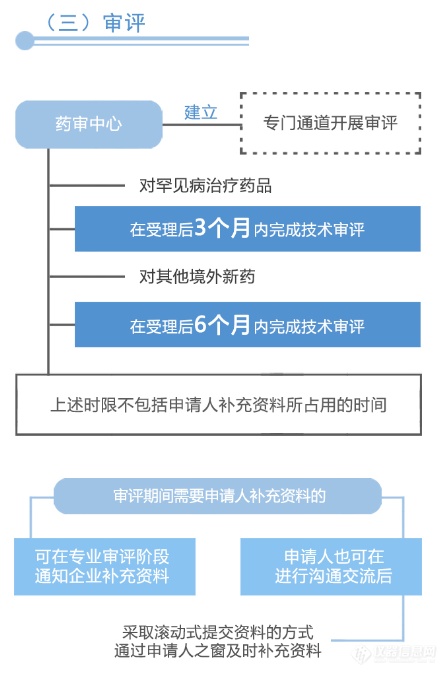
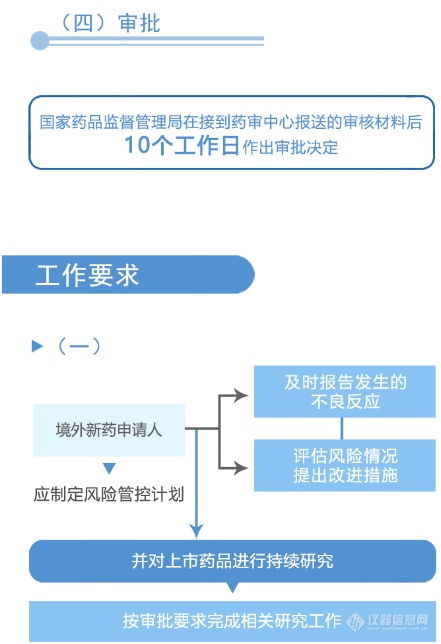
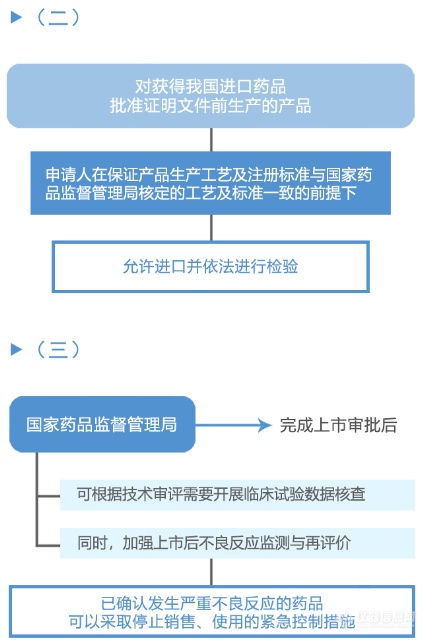
从图解中可以看到,国家药品监督管理局、国家卫生健康委员会建立专门通道对临床急需的境外已上市新药进行审评审批的工作程序(之二)主要为:第一,进入审评审批程序,凡列入专门通道审评审批品种名单的,其在美国、欧盟或日本首次上市的持证商经研究认为不存在人中差异的,可以按照以下程序开展注册工作:沟通交流、申请、审评与审批。之后,国家药品监督管理局在接到药审中心报送的审核材料后10个工作日做出审批决定。附图解



来源于:仪器信息网
热门评论
最新资讯
新闻专题
更多推荐
写评论…
0

















