北京大学王初课题组发展硫辛酰化修饰的组学鉴定新方法
导读:在这项工作中,作者发展了新型的用于捕获硫辛酰化修饰的化学探针,并结合定量化学蛋白质组学的技术,首次实现在大肠杆菌和哺乳动物细胞中的硫辛酰化修饰位点全局性鉴定与定量。
近日,北京大学化学与分子工程学院、北大-清华生命联合中心王初课题组在Journal of American Chemical Society杂志上发表题为“Quantitative Site-Specific Chemoproteomic Profiling of Protein Lipoylation”的研究文章。在这项工作中,作者发展了新型的用于捕获硫辛酰化修饰的化学探针,并结合定量化学蛋白质组学的技术,首次实现在大肠杆菌和哺乳动物细胞中的硫辛酰化修饰位点全局性鉴定与定量,并对大肠杆菌中特定底物蛋白中三个硫辛酰化修饰位点的调控和硫辛酰化修饰合成酶的功能进行了研究。
硫辛酰化修饰是一种通过酰胺键将硫辛酸共价连接到蛋白质赖氨酸残基上的翻译后修饰。硫辛酰化修饰在进化中高度保守,并且位于细菌和哺乳细胞核心代谢途径几种重要蛋白质复合物(丙酮酸脱氢酶复合物,酮戊二酸脱氢酶复合物和支链酮酸脱氢酶复合物)的活性口袋中,作为关键辅因子发挥着重要的催化作用。硫辛酰化修饰的失调与人类代谢紊乱、癌症等疾病相关。因此,加深对硫辛酰化修饰调节的理解对于研究与这些疾病相关分子机制具有重要的意义。
早期工作主要通过结构生物学和生物化学的方法对单个蛋白硫辛酰化修饰进行研究。近些年来,科学家们通过将基于抗体或化学连接的方法与基于质谱的蛋白质组学技术结合,实现了不同细胞类型和组织中硫辛酰化修饰的检测。然而,硫辛酰化抗体的结合亲和力不足,无法实现对所有硫辛酰化修饰蛋白进行鉴定。最近,北京大学陈兴课题组发展了一种化学连接策略用于硫辛酰化修饰蛋白的鉴定(Angew. Chem. | 蛋白质硫辛酰化修饰的化学标记),但未能实现在组学层面对硫辛酰化修饰位点的定量分析和检测。而使用选择反应检测扫描(SRM)的方法则可以实现对特定的底物蛋白二氢硫辛酰胺乙酰转移酶(DLAT)中硫辛酰化修饰位点进行相对定量,但很难实现对所有的硫辛酰化修饰位点进行全覆盖。因此,到目前为止,仍然缺乏一种用于全局分析蛋白质组中蛋白质硫辛酰化修饰的位点特异性鉴定和定量的方法。
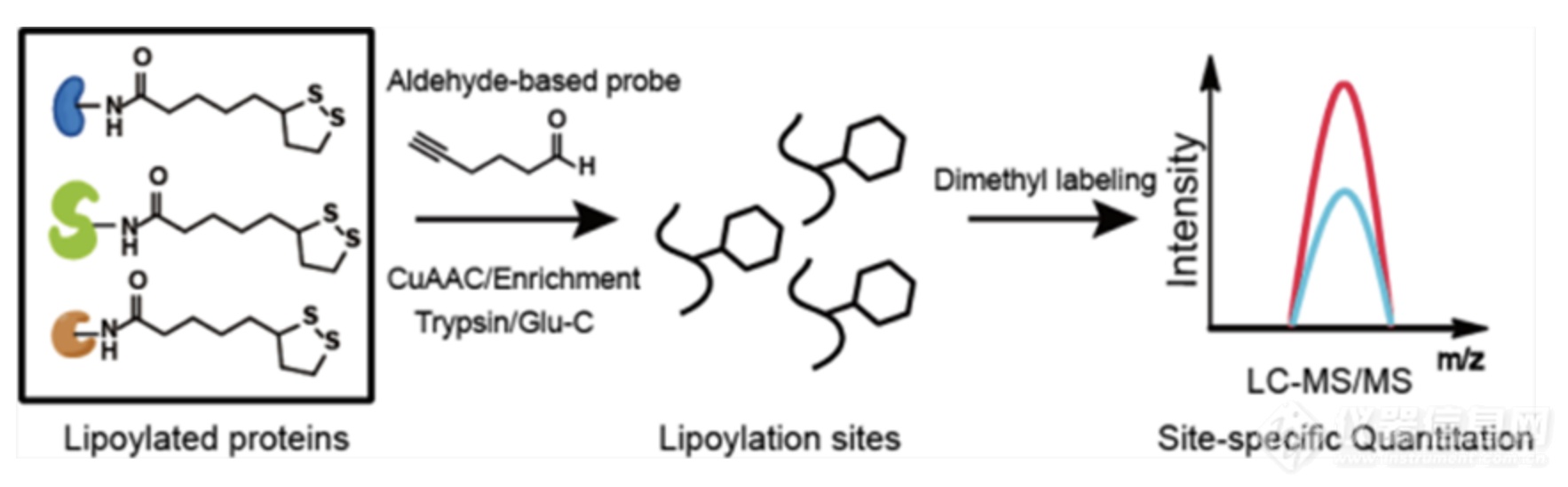
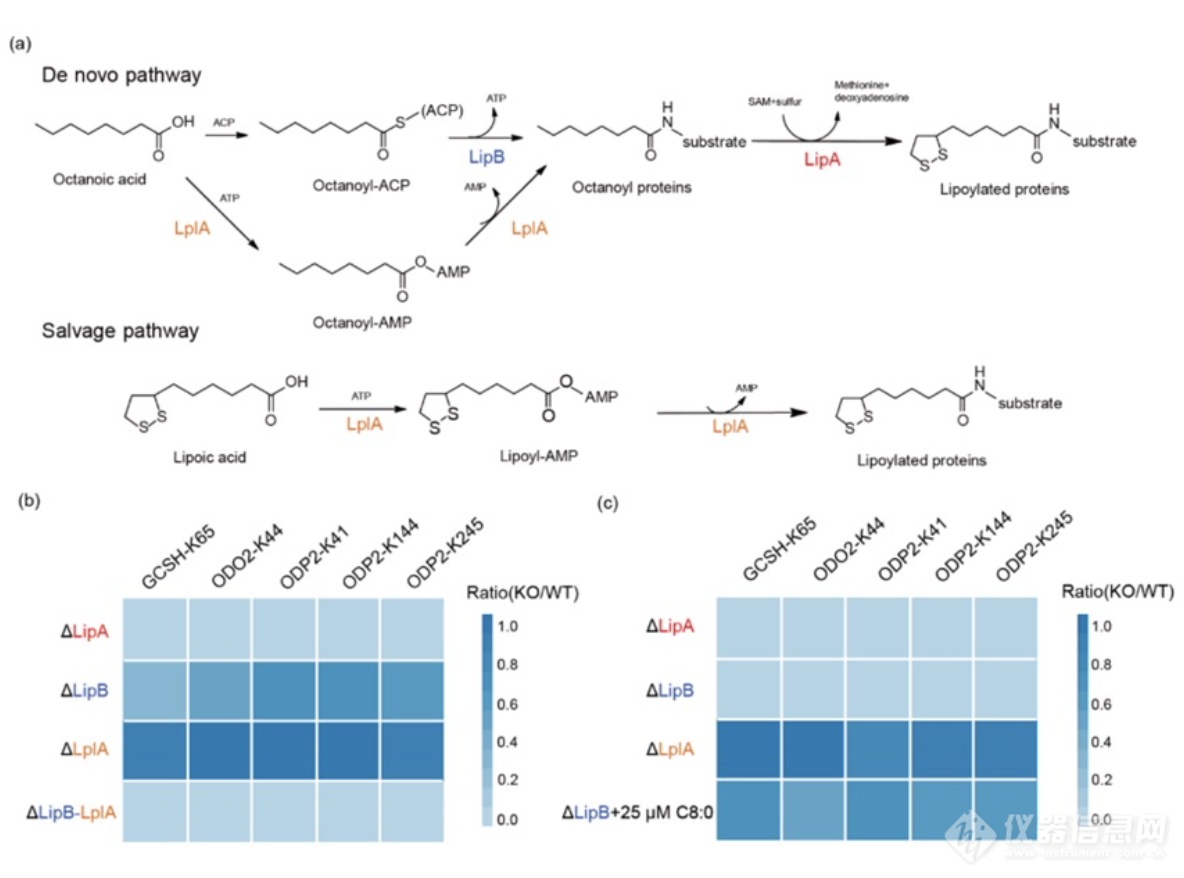
本论文发展了一种标记硫辛酰化修饰的探针和一套具有位点分辨率的定量化学蛋白质组技术。作者受醛基基团保护策略中常用的基于硫缩醛的方法启发,设计了丁醛探针BAP。该探针中含有醛基,可与硫辛酰化修饰发生缩合反应,并结合生物正交基团炔基,通过铜催化的点击化学反应引入可切割的富集标签。作者结合底物序列分析结果,使用V8蛋白内切酶Glu-C代替常规的胰蛋白酶Trypsin,实现了对大肠杆菌中所有已知硫辛酰化修饰位点的鉴定。
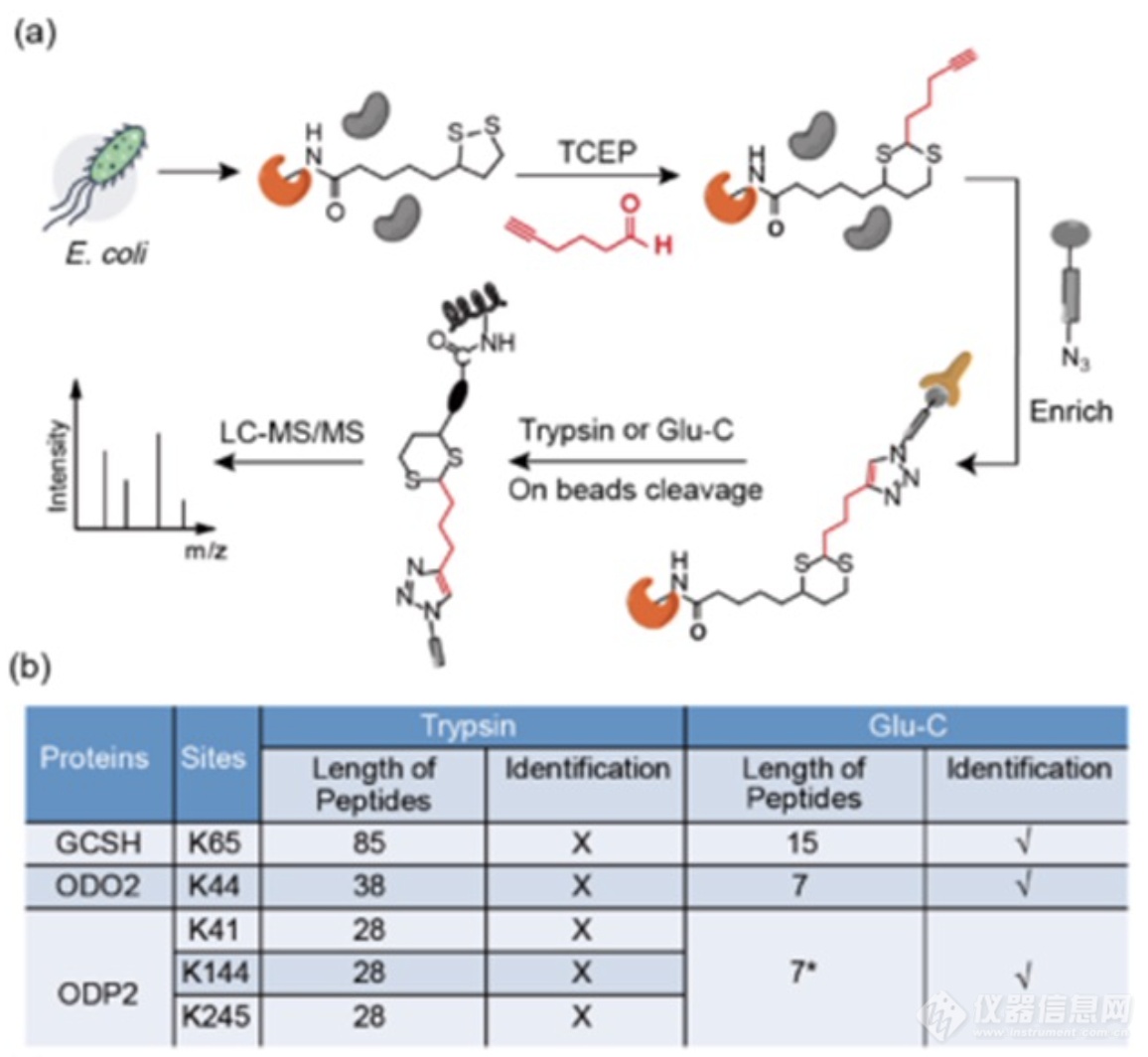
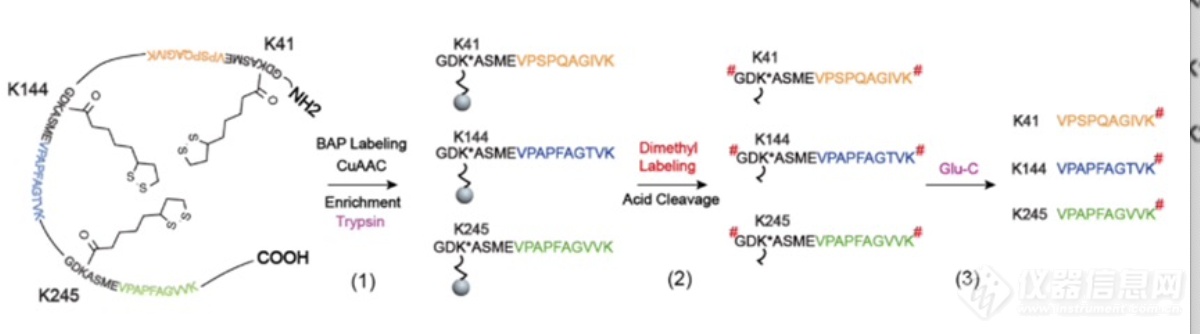
在大肠杆菌中,其中一个蛋白底物二氢硫辛酰赖氨酸乙酰转移酶ODP2上含有三个修饰位点,在Glu-C进行酶切后会产生完全一致的肽段序列。为了能够对ODP2中三个硫辛酰化修饰位点进行区分,作者巧妙地利用修饰肽段下游的序列来代表三个硫辛酰化修饰位点,结合稳定同位素二甲基化定量的方法,开发出一种能够将ODP2上三个硫辛酰化位点进行区分定量的流程。
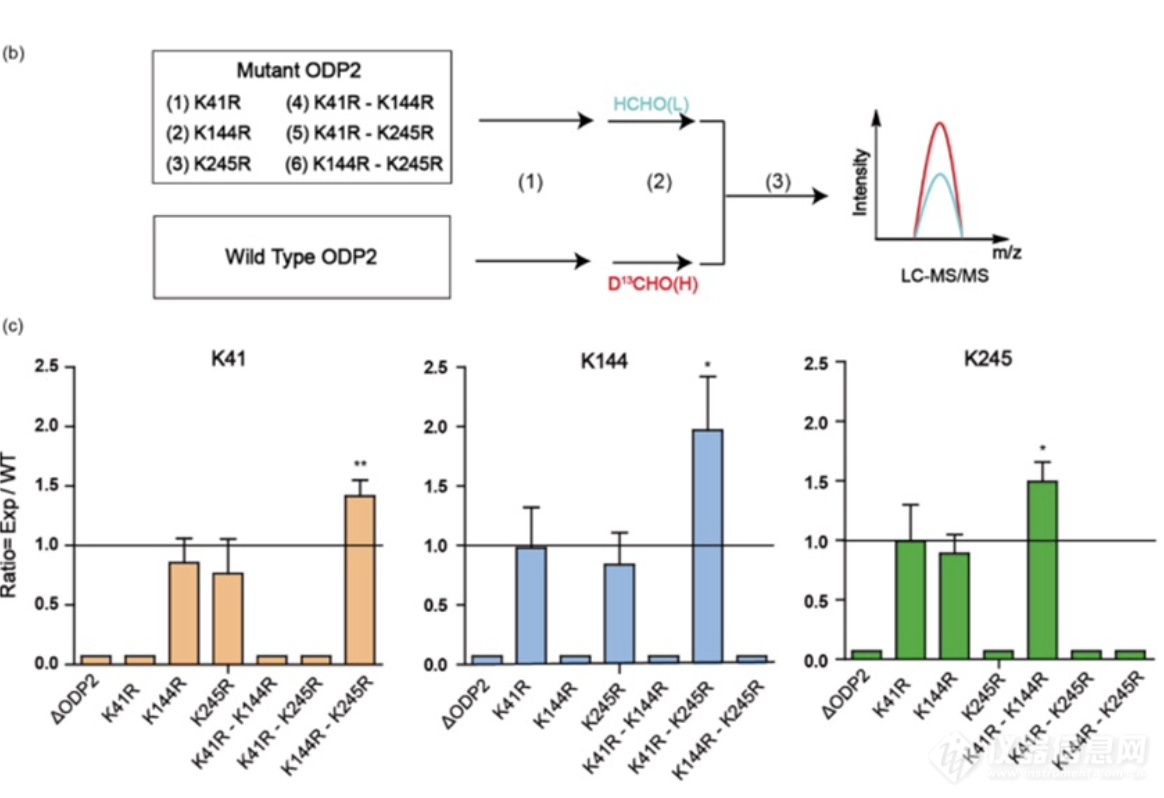
利用发展的大肠杆菌硫辛酰化修饰位点定量策略,本研究对ODP2中三个硫辛酰化修饰任意的单突变和双突变组合菌株中硫辛酰化修饰状态进行分析。实验结果显示,ODP2中三个硫辛酰化修饰位点在体内的调控是相对独立的,并且当体内感受到整体的硫辛酰化修饰降低到一定限度时,会启动一定的补偿调控机制。
作者进一步在大肠杆菌中探究了硫辛酰化修饰从头合成途径(由辛酸转移酶LipB和硫辛酰化合成酶LipA级联介导调控)和硫辛酰化修饰直接合成途径(由硫辛酸蛋白连接酶LplA调控)在硫辛酰化修饰合成过程的重要性。作者对三个硫辛酰化修饰合成酶LplA、LipB和LipA进行敲除,利用开发的位点定量流程对大肠杆菌中所有已知硫辛酰化修饰位点进行定量。实验结果显示,在营养充足的情况下,从头合成途径比直接合成途径起了更重要的作用。同时LplA在辛酸充足的条件下能够发挥与LipB类似的辛酸转移酶的功能。但是相比之下,LipB是体内更为重要的辛酸转移酶。
作者接下来将该定量化学蛋白质组学流程运用到哺乳细胞体系中。作者发现,在人源细胞大多数的硫辛酰化修饰肽段都含有两个酸性氨基酸,这严重影响了质谱正离子检测模式下肽段的检测效率。为了解决这个问题,作者在常规的酸切标签DADPS的结构中引入了一个额外的氨基,发展了新一代酸切割的生物素叠氮标签CY58。
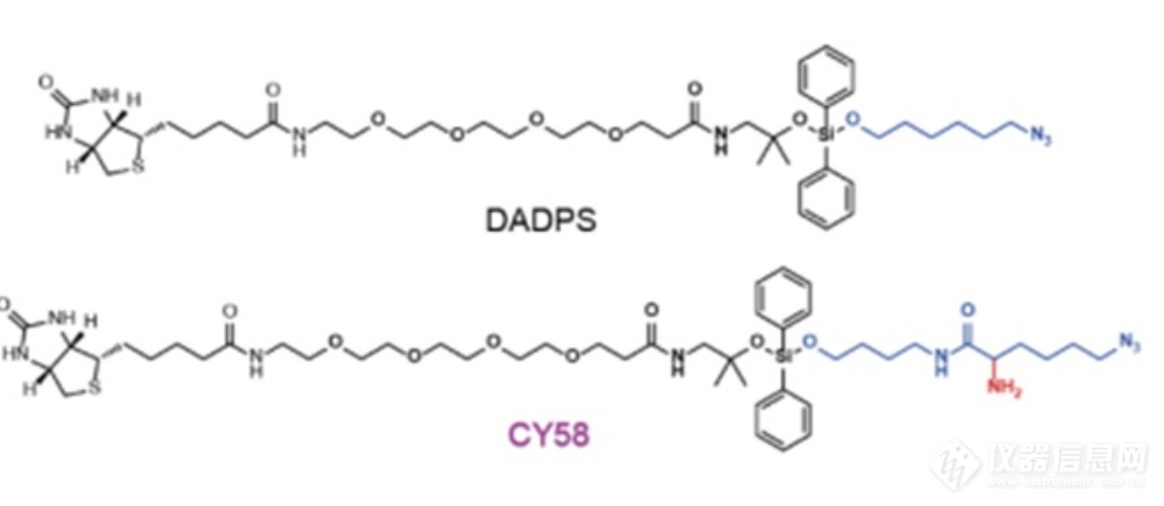
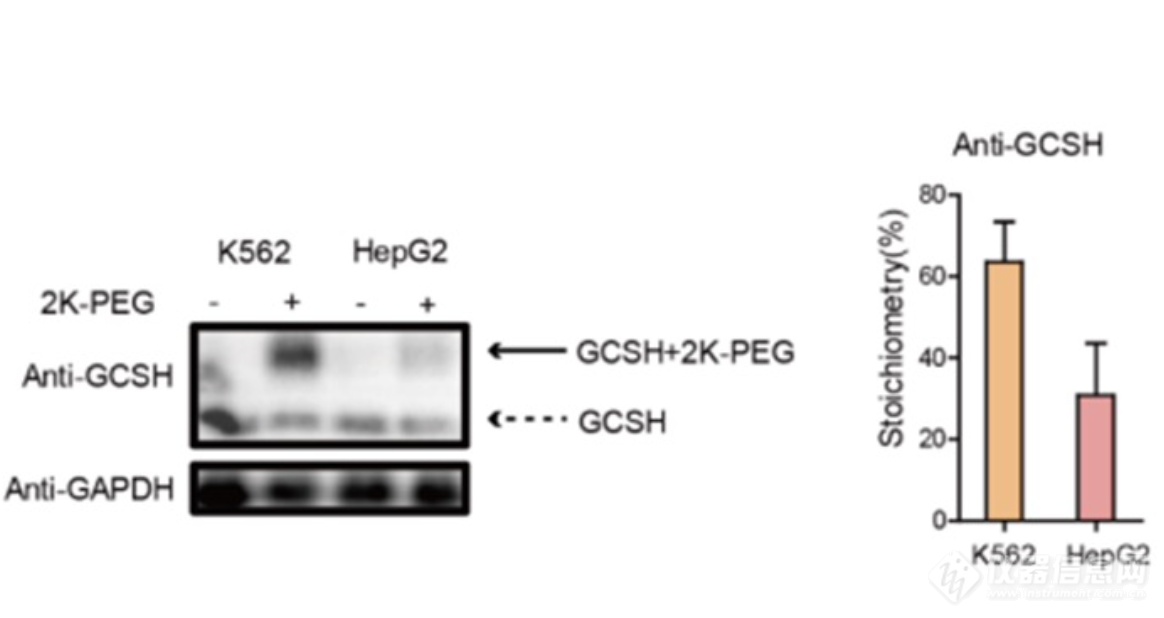
利用新型的电离辅助亲和标签CY58,结合二甲基化标记定量策略,作者成功地实现了对人源细胞中所有已知的六个硫辛酰化修饰位点进行定量。最后,作者利用BAP探针结合质量标签的方法,成功地实现对甘氨酸裂解系统 H 蛋白(GCSH)中硫辛酰化修饰的修饰率进行测量,未来有望进一步在蛋白质组水平上直接检测所有蛋白中硫辛酰化修饰的修饰率。
总之,本工作为组学层面的硫辛酰化修饰位点定量分析提供了强有力的工具,极大地助力了硫辛酰化修饰位点的功能研究。本文的通讯作者为北京大学化学与分子工程学院、北大-清华生命联合中心的王初教授。其指导的化学与分子工程学院2016级博士研究生赖书畅和博士后陈颖博士为本文的共同第一作者。王初课题组杨帆博士,肖伟弟博士和刘源博士等合作者为本课题做出了突出的贡献。该工作得到了科技部、基金委、北京分子科学国家研究中心、教育部生物有机和分子工程重点实验室的经费支持。
来源于:王初课题组
热门评论
最新资讯
新闻专题
更多推荐

















