利用自上而下质谱对蛋白质高阶结构和动力学进行时间分辨表征的微流控平台
进入 #微流控技术进展阅读更多话题内容
导读:作者提出用于蛋白质高阶结构和动态Topdown 分析的芯片设计策略。适用于时间分辨的非变性质谱和HDX质谱,旨在有效电离完整的蛋白质复合物,灵活控制多种反应物流动,并在较大的流速范围精确控制反应时间
大家好,本周为大家分享一篇发表在Analytical Chemistry上的文章,Microfluidic Platform for Time-Resolved Characterization of Protein Higher-Order Structures and Dynamics Using Top-Down Mass Spectrometry [1],文章的通讯作者是北京大学生物医学前沿创新中心的王冠博教授和中国科学院深圳先进技术研究院的门涌帆副研究员。
蛋白质的高阶结构和动力学特性对理解蛋白质的生物学功能和揭示其潜在机制至关重要。自顶向下质谱法(Top-down MS)在完整蛋白水平和肽段碎片水平都能获得结构信息。非变性Top-down MS可以分析蛋白质复合体的结构以及完成亚基鉴定和修饰分析。自顶向下氢/氘交换质谱(Top-down HDX MS)为构象或结合界面分析提供了高空间分辨率,并实现了构象特异性表征。微流控芯片可以为这些质谱工作流程的前端反应提供优越的平台。然而,目前大多数质谱微芯片装置是为Bottom-up或Top-down蛋白质组学设计的。本文中,作者提出了一种用于蛋白质高阶结构和动态Top-down MS分析的芯片设计策略。它适用于时间分辨的非变性质谱和HDX质谱,该设计旨在有效电离完整的蛋白质复合物,灵活控制多种反应物流动,并在较大的流速范围内精确控制反应时间在亚微升/分钟。本文通过对单克隆抗体、抗体-抗原复合物和共存蛋白构象等体系的分析来验证该装置的性能。
TDK-MS(Top-down and kinetic MS)芯片的结构如图1A所示,该方法可以有效电离完整的蛋白质,包括单克隆抗体(mAb)和抗体-抗原复合物(图1 B, C)。
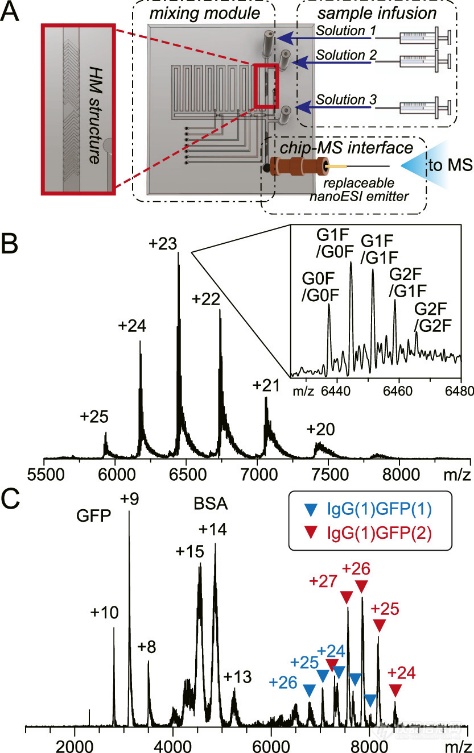
图1. 完整蛋白质和蛋白质复合体在非变性条件下的高效电离
虽然分析蛋白质组合化学计量学和监测构象变化需要保持蛋白质高阶结构和非共价相互作用的完整性,然而为了推导结构信息或在串联MS中展开蛋白质以提高碎裂效率,往往需要不同程度的变性来产生亚复合体,因此变性剂的浓度和变性的时间对变性程度至关重要。本文中,作者采用交错人字微结构(Herringbone microstructure, HM)(图2A, B),并对其性能进行了评估(图2C−E)。如此高的混合效率为进一步微型化芯片混合模块提供了可能。在监测Mb的变性时,作者使用TDK-MS芯片和商用混合三通管平行混合holo-Mb溶液(5 μM)与乙腈(ACN),并比较它们在混合比例变化时的响应(图2F)。TDK-MS芯片在非变性和变性条件之间切换的快速响应通过NIST mAb的变性得到了证明,在向NIST mAb溶液中添加甲酸后,响应时间小于5分钟(图2G)。
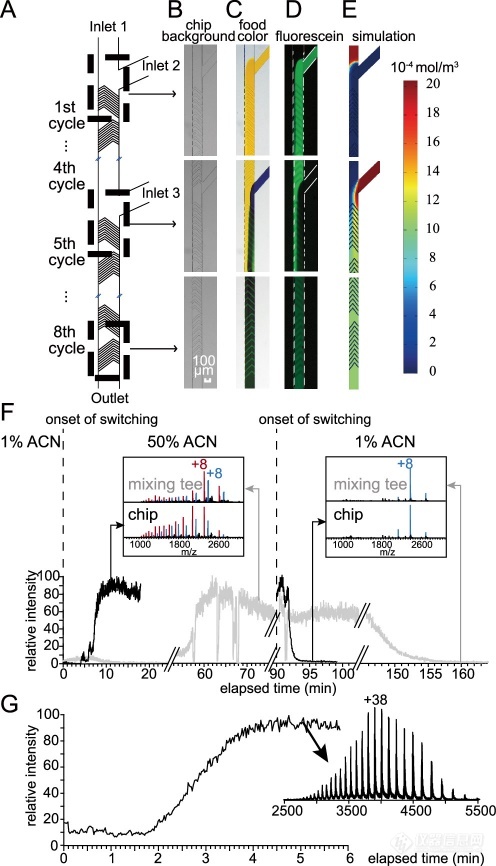
图2. 高效混合和快速响应的流体控制
微芯片的灵活通道设计允许引入独立控制的溶液。例如,尽管酸和有机溶剂都能诱导变性,但这两种变性剂同时存在时,对变性途径的影响是不同的。Mb和Hb是血红素蛋白,其中血红素基团分别非共价连接在1条多肽链和4条非共价组装链上,因此这是研究共存复合体解离动力学和亚基构象变化的理想模型。将5 μM holo蛋白溶液与ACN和FA按一定的混合比例依次混合,可以通过解离产物的出现和蛋白质离子电荷态分布的变化来表征复杂的解离和蛋白质的展开。在固定ACN浓度下,随着FA浓度从0.01增加到0.3% (v/v),依次观察到的主要现象是血红素丢失、apo-Mb展开以及折叠的holo-Mb转化为展开的apo-Mb(图3A)。相比之下,在FA浓度恒定的情况下,当ACN从1增加到50%时,Mb主要表现为血红素损失,只有中等程度的apo-Mb展开,这可能是由于展开的部分迅速聚集(图3B)。
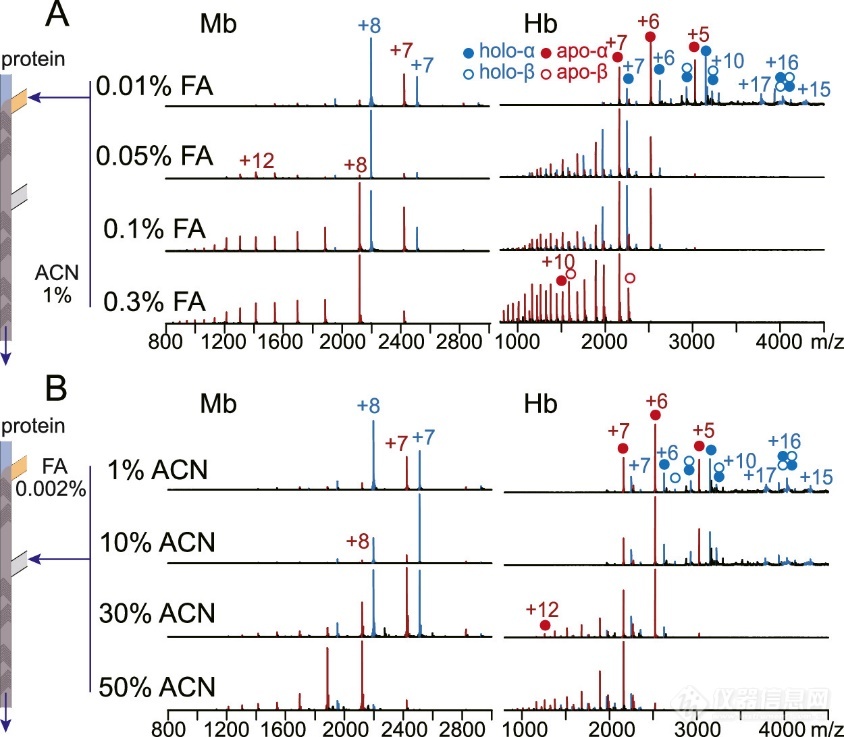
图3. (A)增加FA浓度,固定ACN浓度和(B)增加ACN浓度,固定FA浓度时获得的Mb和Hb的质谱图。
在HDX MS检测中,TDK-MS芯片提供了快速和有效的氘代及淬灭,精确控制HDX反应时间,并在2H-标记形式下高效电离完整蛋白质(图4)。
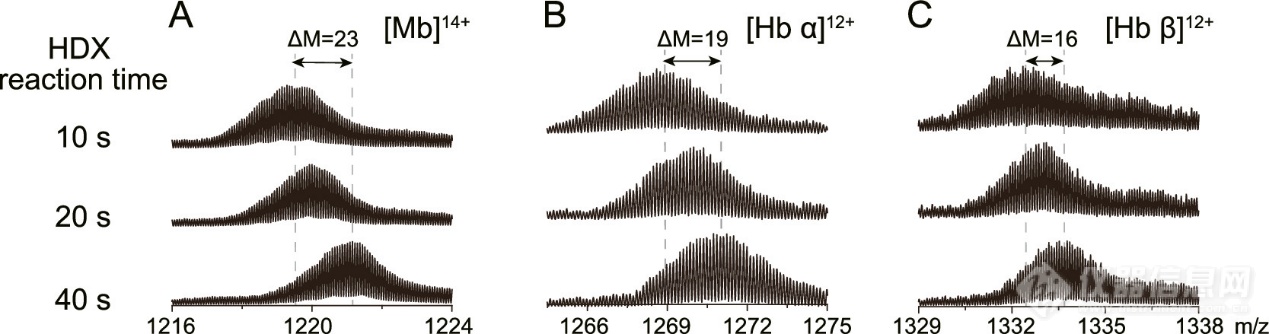
图4. 2H标记完整的(A)Mb、(B)Hb α亚基和(C)Hb β亚基在不同反应时间下的HDX质谱图
由于过大的流速不利于电离效率,并且有可能会增加堵塞或流动中断的风险,因此流速应保持在最佳范围内,这又限制了混合通道中HDX时间的可调节范围,从而影响了HDX动力学分析的灵活性。为了解决这一问题,作者设计了一个具有多个不同长度反应通道的混合模块,在不更换芯片的情况下,除了改变流速外,还可以通过通道切换在更大范围内调整反应时间。在原型芯片中,5个不同长度的通道可以在对蛋白质电离和流动稳定性都最优的流速下,产生从几秒到几分钟不等有效的HDX时间(图5)。
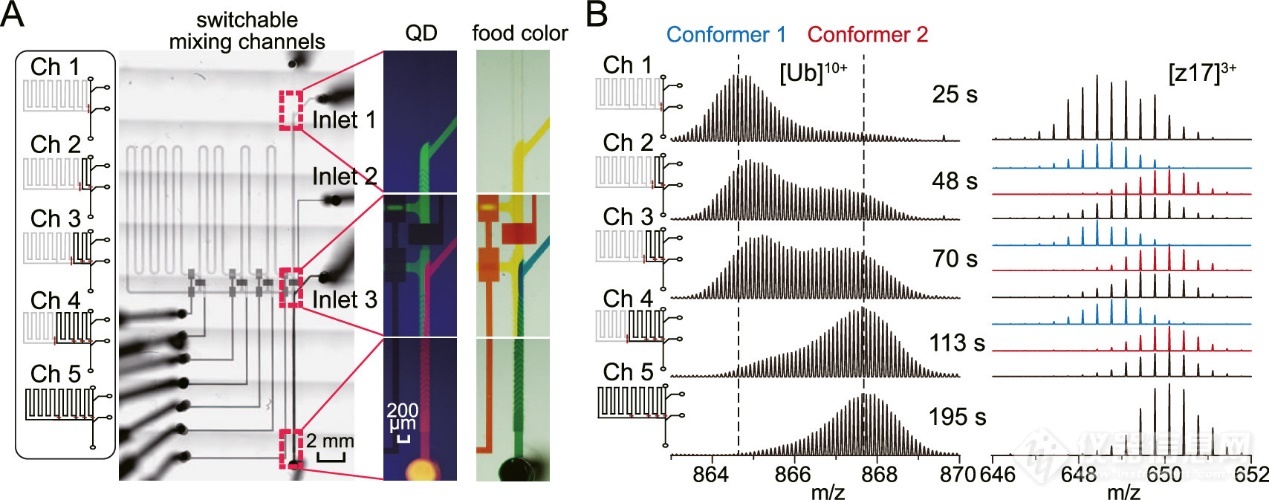
图5. Top-Down HDX MS 分析
本文中作者开发的策略将有利于生物大分子结构的精细分析,并有助于质谱微芯片的方法开发。
来源于:仪器信息网
热门评论
最新资讯
新闻专题
更多推荐