微生物肠道菌群多维度解析助力肿瘤免疫治疗|多组学成果
导读:微生物多组学与肠道菌群研究结合,揭示了微生物在健康和疾病中的作用,推动了对多种疾病的理解和治疗。国家自然基金的支持促进了该领域的发展。
微生物多组学与肠道菌群的结合不仅改变了研究方法,也深刻地影响了我们对健康和疾病的理解。通过分析肠道微生物的组成和功能,可以了解它们在消化、免疫、代谢等方面的作用。这为我们提供了新的思路和方法,用于预防和治疗多种疾病,如肠道炎症、肥胖、自身免疫性疾病等。国家自然基金在这一领域的支持起到了至关重要的作用。通过资助一系列的研究项目,国家自然基金为科研人员提供了宝贵的资源和支持,推动微生物多组学与肠道菌群研究的跨学科合作。这种合作不仅加速了科学的进展,还为我们揭示了微生物对肠道菌群的调控机制、与人体健康的关联等重要发现。
2023年国自然众多中标热点领域中,关于微生物研究的肠道菌群又一次登榜。
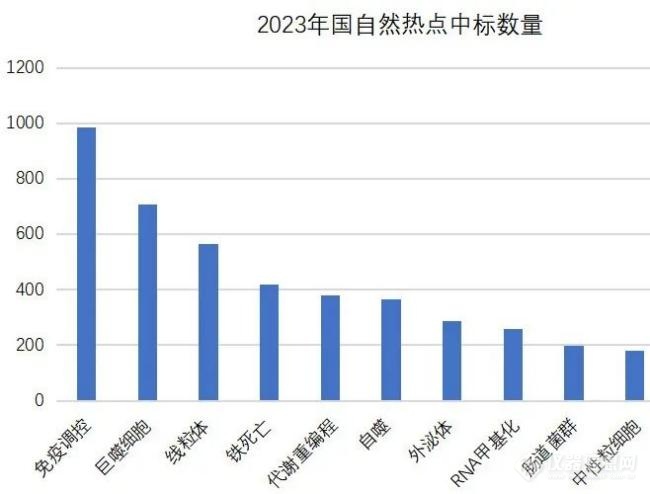
图1 2023年国自然热点中标数量
由于肠道菌群和微生物可以通过扩增子、宏基因组等组学技术进行精准检测和综合分析,并且可以与代谢组学、单细胞转录组学等多个组学技术相结合,这使得该领域的研究内容变得极为丰富。近年来,与肿瘤等重大疾病的发生和发展相关的研究不断涌现,高质量的学术文章持续刷新公众对这一领域的认知。这使得肠道菌群研究领域连续多年稳居研究热榜榜首。
到2024年,国家自然科学基金在肠道菌群领域的资助项目数量预计将进一步增加,持续推动该领域的科研成果蓬勃发展!
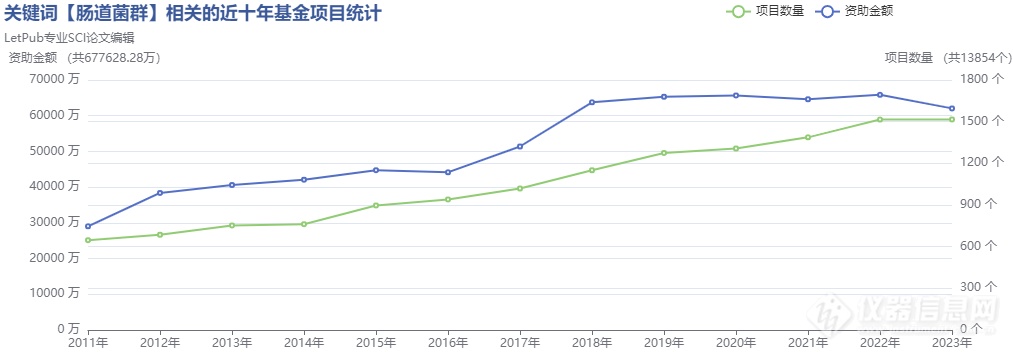
图2 截止2023年肠道菌群领域国自然资助情况统计
新成果分享:
多组学整合揭示人类疾病中宿主基因-微生物组相互作用的模式和特征(扩增子+转录组+代谢组)

题目:Identification of shared and disease-specific host gene–microbiome associations across human diseases using multi-omic integration
发表期刊:Nature Microbiology (IF:28.3)
研究思路总结:
这项研究旨在使用多组学整合方法,探索人类疾病中宿主基因与微生物组之间的关联。研究者收集了患有结直肠癌、炎症性肠病和肠易激综合征的患者的结肠粘膜样本,并分别进行了宿主转录组(208个样本)和肠道微生物组(208个样本)的测序。通过机器学习的方法,研究团队确定了肠道微生物与宿主基因之间的关联模式,既有共享的模式,也有特定于不同疾病的模式。研究结果表明,涉及胃肠道炎症、肠道屏障保护和能量代谢的一组共同的宿主基因和通路与特定疾病的肠道微生物相关。此外,研究还发现,在三种疾病中都有被认为与疾病有关的粘膜肠道微生物(如链球菌)与不同宿主基因途径相关,这表明相似的微生物可以通过调节不同的宿主基因以特定于疾病的方式影响宿主病理生理过程。这项研究的框架可以应用于其他疾病,以发现可能影响疾病结果的宿主基因-微生物组关联。
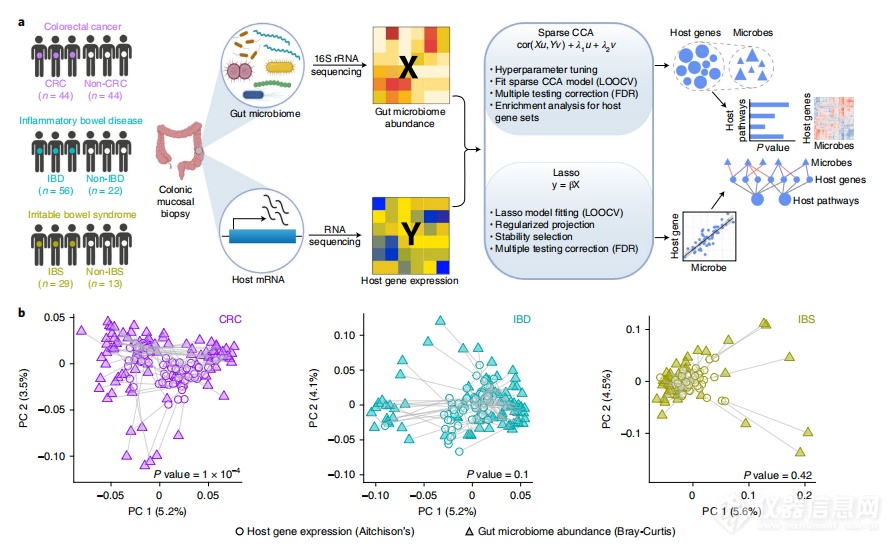
图3 整合CRC、IBD和IBS中的宿主基因表达和肠道微生物群丰度
肠道Parabacteroides merdae 增强支链氨基酸分解代谢以保护心血管健康(微生物组+代谢组)

题目:Gut Parabacteroides merdae protects against cardiovascular damage by enhancing branched-chain amino acid catabolism
发表期刊:Nature Metabolism (IF:20.8)
研究思路总结:
这项研究的主要目标是探讨肠道微生物Parabacteroides merdae在保护心血管健康方面的作用机制。研究发现,通过增强支链氨基酸(BCAA)的分解代谢,该微生物可以保护免疫缺陷动物模型中的心血管组织免受动脉粥样硬化的损害。此外,研究还发现,一种名为GMD的Ganoderma meroterpene衍生物可以通过调节肠道微生物群组成,增加Parabacteroides merdae的丰度,并增强BCAA的降解作用,从而减轻肥胖相关的动脉粥样硬化病变。进一步的研究表明,Parabacteroides merdae通过抑制动脉粥样硬化斑块中的mTORC1信号通路发挥作用。研究结果还显示,患有动脉粥样硬化的个体的肠道微生物组中缺乏Parabacteroides merdae及其关键基因porA的存在。总的来说,这项研究揭示了GMD通过Parabacteroides merdae在肠道中的作用机制,为其在治疗肥胖相关心血管疾病中的潜在疗效提供了机制性的见解。
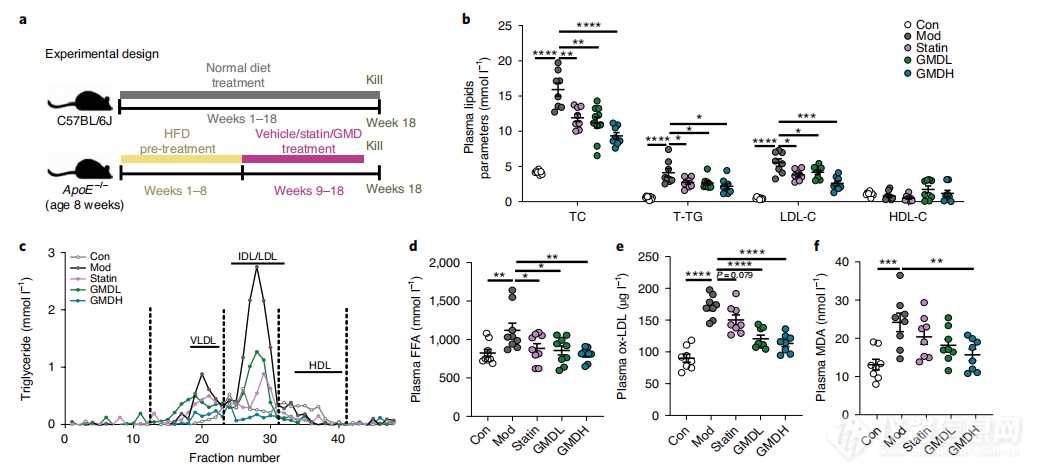
图4 HFD喂养的ApoE−/−小鼠经GMD治疗后,表现出动脉粥样硬化减少
多组学方法揭秘结直肠癌中肠道微生物群和肿瘤免疫状态的决定因素(微生物组+代谢组+转录组+单细胞)

题目:Untangling determinants of gut microbiota and tumor immunologic status through a multi-omics approach in colorectal cancer
发表期刊:Pharmacological Research (IF:9.3)
研究思路总结:
这项研究旨在通过多组学方法探索结直肠癌(CRC)中肠道微生物群和肿瘤免疫状态的决定因素。研究使用了包括微生物组、代谢组、转录组和单细胞RNA测序数据在内的大规模多组学数据,并通过先进的生物信息学方法对其进行了分析和整合。同时,研究还通过将人类的微生物群移植到小鼠模型中,验证了这些发现的临床相关性。研究发现,与健康对照组相比,CRC患者的微生物群组成存在明显差异。研究还开发了一个包含28个生物标志物的机器学习模型,用于CRC的检测,该模型具有较高的准确性和临床适用性。研究还发现了微生物群和已知基因之间的多个显著相关性,提示了肠道微生物群在肿瘤免疫中的潜在作用。进一步分析表明,特定代谢产物在这些微生物群和肿瘤免疫之间起到了重要的传递者作用。通过整合微生物组和代谢组的视角,研究归纳了代表CRC多组学特征的肠道分类学和代谢组特征。此外,从CRC患者中移植的肠道微生物群削弱了对免疫治疗的反应。这些表型与肠道微生物群的改变、免疫细胞浸润以及多条代谢途径密切相关。通过对CRC多组学数据的全面交互作用的研究,可以解释肠道微生物群如何影响肿瘤免疫。因此,研究提出了利用健康供体改变CRC微生物群的策略,以提高免疫治疗的效果。
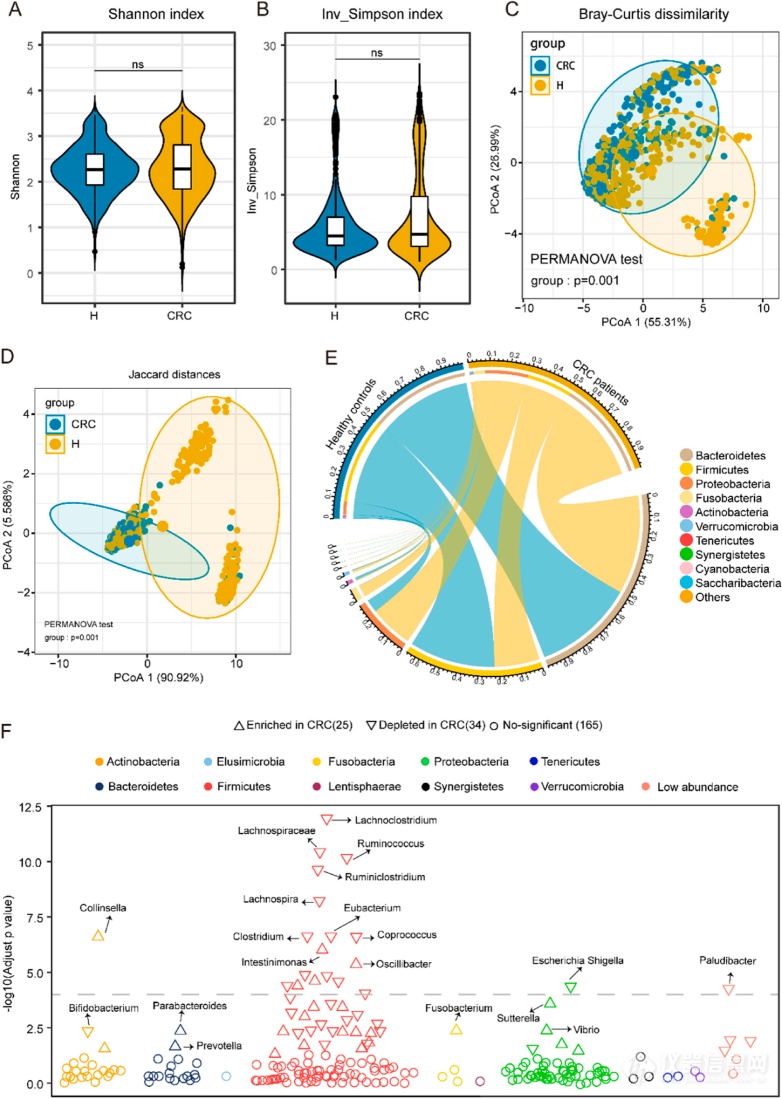
图5 结直肠癌患者肠道微生物多样性和组成的改变
多组学揭示:II型糖尿病与肠道微生物失调、代谢组学和饮食摄入的错综关系(宏基因组+代谢组+蛋白质组+转录组)

题目:Uncovering the relationship between gut microbial dysbiosis, metabolomics, and dietary intake in type 2 diabetes mellitus and in healthy volunteers: a multiomics analysis
发表期刊:Scientific Reports(IF:4.6)
研究思路总结:
这研究的主要目标是探索饮食对II型糖尿病患者和健康志愿者肠道微生物组、代谢组学和血糖稳态之间的关系。研究采用多组学分析方法,结合肠道细菌组、真菌组和代谢物组的数据,以揭示不同组之间的变异源。研究发现高纤维饮食与健康对照组中的代谢产物丙酸盐、U8和2-羟基丁酸的含量显著较低,而3-羟基苯乙酸的含量较高。通过分析各潜在因子与年龄、BMI、饮食和性别之间的相关性,发现潜在因子1与饮食摄入显著相关。进一步分析细菌和真菌属对潜在因子1的影响发现,有9个细菌属(Phocaeicola、Ligilactobacillus、Mesosutterella、Acidaminococcus、Dorea A、CAG-317、Caecibacter、Prevotella和Gemmiger)和1个真菌属(Malassezia furfur)具有较高的因子权重。此外,通过线性回归模型显示,木糖醛具有正权重,丙酸盐、U8和2-羟基丁酸具有负权重。这些结果为了解不同饮食和疾病条件下人体代谢表型受微生物相关变化的影响提供了新的信息。
此外,研究还指出高纤维饮食对维持整体健康至关重要,与降低多种健康状况风险有关。高纤维饮食与控制血糖、心血管健康、体重管理和消化功能等多种健康优势有关。其中,肠道菌群中的Prevotella等细菌通过将膳食纤维转化为有益的短链脂肪酸,对健康状况发挥重要作用。然而,需要进一步研究来全面了解纤维摄入、肠道菌群以及特定细菌分类群(如Prevotella)之间的复杂关系,尤其是在健康和糖尿病治疗的背景下。
总体而言,该研究通过应用多组学方法,探索了饮食对II型糖尿病患者和健康志愿者肠道微生物组和代谢组学的影响,并揭示了微生物失调与异常血糖稳态之间的关联。这有助于加深对疾病过程的理解,寻找生物标志物和高效治疗方法,以及应用精准医学的实践!
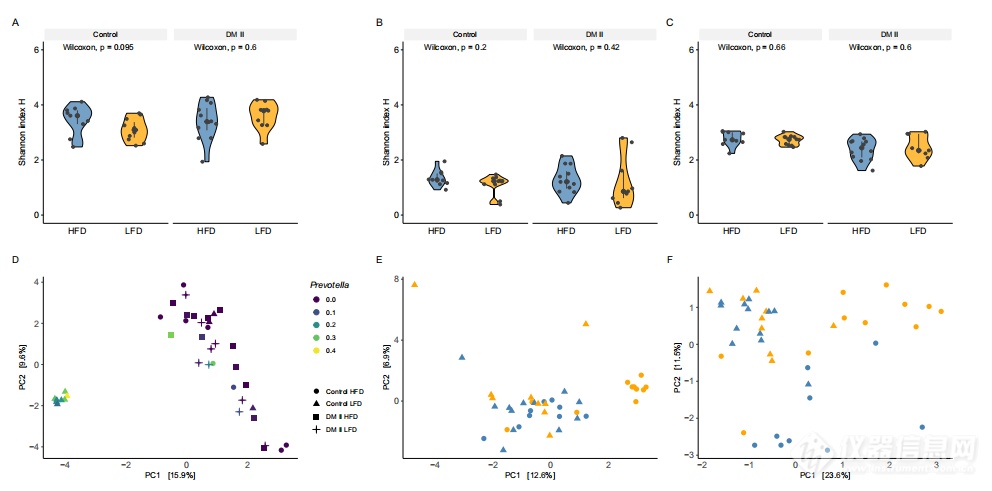
图6 利用香农指数估计的细菌组的阿尔法多样性
总 结
国家自然基金的支持为微生物多组学与肠道菌群的研究带来了巨大的推动力。它不仅为科学家们提供了资源,还促进了学术界与产业界的合作,加速了研究成果的转化与应用。这些努力将有助于改善人类健康,推动精准医学的发展,为我们打开一个全新的健康时代。
让我们为国家自然基金在微生物多组学与肠道菌群研究中的突破和贡献欢呼!期待这一研究领域的进一步发展,带来更多关于微生物与肠道菌群的惊喜和发现!
参考文献
[1] Priya S, Burns M B, Ward T, et al. Identification of shared and disease-specific host gene–microbiome associations across human diseases using multi-omic integration[J]. Nature microbiology, 2022, 7(6): 780-795.
[2] Qiao S, Liu C, Sun L, et al. Gut Parabacteroides merdae protects against cardiovascular damage by enhancing branched-chain amino acid catabolism[J]. Nature Metabolism, 2022, 4(10): 1271-1286.
[3] Zhang S L, Cheng L S, Zhang Z Y, et al. Untangling determinants of gut microbiota and tumor immunologic status through a multi-omics approach in colorectal cancer[J]. Pharmacological Research, 2023, 188: 106633.
[4] Al Bataineh M T, Künstner A, Dash N R, et al. Uncovering the relationship between gut microbial dysbiosis, metabolomics, and dietary intake in type 2 diabetes mellitus and in healthy volunteers: a multi-omics analysis[J]. Scientific Reports, 2023, 13(1): 17943.
来源于:仪器信息网
热门评论
最新资讯
新闻专题