推荐厂家
暂无
暂无





[align=center][size=16px]外泌体综述[/size][/align] 外泌体是直径30-150纳米之间的细胞外囊泡,在疾病发生和进展中起着重要作用。因此,外泌体在早期诊断、靶向治疗等方面均具有很大的潜力。 外泌体生物发生及作用 外泌体的生物发生 1967年,Wolf在人血浆中首次发现一种来源于血小板膜泡的物质,并将其称之为“血小板尘埃”。之后,所有的生物体液以及体外培养的细胞上清中都被检测到含有囊泡。外泌体的生物发生涉及多种机制,这些机制有助于蛋白质和RNA等在细胞间的传递,从而生成具有源细胞特定成分的外泌体。多囊泡体(MVBs)的极限膜向内萌芽形成腔内囊泡(ILVs),等到晚期内体成熟后,MVBs可以与质膜融合,在细胞外空间中释放封闭的ILVs,被释放出去的ILVs称为外泌体。外泌体主要通过两种不同的机制释放,即跨反式高尔基网络释放和诱导释放。Rab家族蛋白,如Rab27a和Rab27b,是外泌体分泌的关键调节剂。除了Rab27a和27b外,其他Rab家族成员Rab35和Rab11也已被证明通过与GTPase激活蛋白TBC1结构域家族成员10A-C(TBC1D10A-C)相互作用来调节外泌体的分泌。研究还表明,癌症抑制蛋白p53能通过调节各种基因的转录(如TSAP6和CHMP4C)来刺激和增加外泌体分泌的速率。 外泌体的作用 外泌体是由细胞释放的纳米级囊泡,存在于不同的生物体液中,如血液、唾液和尿液。这些囊泡携带丰富的“货物”,包括蛋白质、信使RNA(mRNA)和microRNA(miRNA)。1983年,Pan在大鼠网织红细胞中首次观察到内吞囊泡的分泌。1987年,科学家Johnstone将这类囊泡定义为“外泌体”。最初,科学家认为外泌体是由细胞产生的代谢废物。然而,随着对外泌体的研究更加深入,人们逐渐抛弃这一误解。越来越多的研究表明,外泌体参与细胞间通信,是细胞微环境和旁分泌信号的重要组成部分。1998年,L.Zitvogel等人发表了一项关于树突细胞(DCcell)能产生有抗原提呈能力的外泌体的研究,阐明了外泌体含有功能性的MHC-I类II类分子和共刺激因子。2007年,H.Valadi等人的研究证实,细胞之间可以利用外泌体RNA交换遗传物质。这说明了细胞之间可以通过外泌体互相影响,甚至可以将一个细胞的基因强加到另外一个细胞上。2013年,美国科学家JamesE.Rothman、RandyW.Schekman及德国科学家ThomasC.Südhof共同获得当年诺贝尔生理医学奖,以表彰他们发现并阐明了细胞囊泡运输系统及其调控机制。来自癌细胞的外泌体已被证实可以调节癌症细胞生长、增殖、迁移过程,还能影响癌症的化疗耐药。因此,外泌体是理想的可作为非侵入性诊断和预后的生物标志物。 外泌体的分离分析方法 基于对外泌体研究的需要,科学界对外泌体的高效分离、定量和分析方法也在不断尝试和深入。由于样品基质和外泌体理化性质的复杂性,从体液中准确分离外泌体仍存在重大挑战。在过去的几十年里,研究主要使用差分和密度梯度离心、超滤和免疫分离等方法。目前,已有商业外泌体分离试剂盒投入使用。商业试剂盒通过用聚乙二醇或类似成分沉淀囊泡来减少耗时,但是存在非囊泡与外泌体一起共沉淀的弊端,外泌体的常规检测方法仍需向快速、高效、可重复和低成本的方向改进。近年来,基于研究和临床需要,越来越多的分析方法已经被用来分析外泌体。例如,酶联免疫吸附测定(ELISA)、纳米颗粒跟踪分析技术(NTA)、流式细胞术和荧光活化细胞分选(FACS)已成功开发用于外泌体定量。 蛋白质谱分析在外泌体中的应用 外泌体蛋白质组学是对外泌体中的蛋白质进行全面分析,以了解其生物学功能和疾病相关性。外泌体蛋白质组学分析涉及到外泌体的分离纯化、鉴定、数据分析等过程。蛋白质谱是外泌体蛋白质组学研究的手段之一,通过质谱可以获得蛋白质的名称、组成、表达量等信息,进而找到与疾病相关的蛋白质,探索可以用于疾病早期诊断和预后评估的生物标志物。质谱分析具有灵敏度高、通用性强、准确性高等优点,在研究中发挥了重要作用。
大家好,新手科研小白,想求助大家SEC分离外泌体需要采购的仪器有哪些,暂定是用血清外泌体
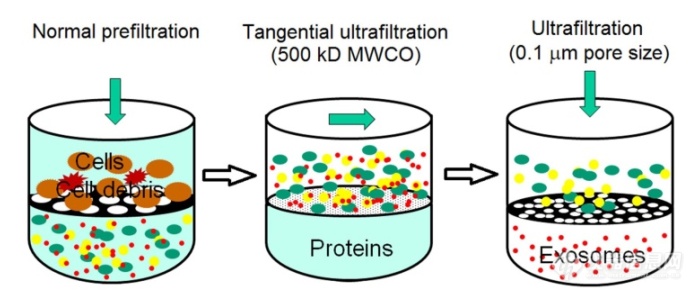
[align=center][font='times new roman'][size=18px][color=#000000]新型[/color][/size][/font][font='times new roman'][size=18px][color=#000000]外泌体分离方法[/color][/size][/font][/align][align=left][font='times new roman'][size=16px]肿瘤细胞来源的外泌体在分子水平上促进肿瘤的进展、侵袭和转移。因此,在探索细胞间信号传导,分析功能分子成分(蛋白质、[/size][/font][font='times new roman'][size=16px]mRNA[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]microRNA[/size][/font][font='times new roman'][size=16px])前需要有效的检测和分离肿瘤源性外泌体的能力,这可能为癌症诊断和预后提供关键信息。[/size][/font][/align][align=left][font='times new roman'][color=#000000]1[/color][/font][font='times new roman'][color=#000000]基于尺寸排阻的外泌体分离技术[/color][/font][/align][align=left][font='times new roman'][size=16px]外泌体是直径在[/size][/font][font='times new roman'][size=16px]30-200 nm[/size][/font][font='times new roman'][size=16px]的囊泡,其尺寸小于绝大部分的细胞外囊泡,因此,基于这一特性,可利用具有限制相对分子量或大小的过滤器来分离外泌体。目前,最常用的基于尺寸的外泌体分离技术就是超滤离心法。该方法是一种基于悬浮颗粒或聚合物大小的外泌体分离技术,小于膜孔径的物质会通过过滤膜,大于膜孔径的物质被截留在膜上。超滤法比[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]速度更快,且不需要特殊的设备,已有研究表明该方法可以成功从[/size][/font][font='times new roman'][size=16px]0.5 mL[/size][/font][font='times new roman'][size=16px]尿液中分离外泌体。[/size][/font][/align][font='times new roman'][size=16px]目前已经开发了一种适合无细胞样品的商用外泌体分离试剂盒,兼具外泌体分离和[/size][/font][font='times new roman'][size=16px]RNA[/size][/font][font='times new roman'][size=16px]提取的功能。如图所示,该试剂盒利用注射过滤器双层膜结构,当样品通过两层膜时,较大的细胞外囊泡(如凋亡小体和微囊泡)被保留在上层膜上,而外泌体捕获在下层膜上。与[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]和外泌体沉淀法相比,超滤法从尿液中获得的外泌体[/size][/font][font='times new roman'][size=16px]RNA[/size][/font][font='times new roman'][size=16px]产量最高。该方法的主要缺点在于分离的外泌体容易堵塞过滤膜,导致分离效率下降。此外,该方法可能会导致囊泡的变形和破裂,影响下游分析的结果。[/size][/font][font='times new roman'][size=16px]另一种基于尺寸的外泌体分离方法是尺寸排除色谱法[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]SEC[/size][/font][font='times new roman'][size=16px])[/size][/font][font='times new roman'][size=16px]。该方法利用多孔固定相将悬浮颗粒和聚合物按照大小进行分类[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]流体动力半径小的物质能够通过孔隙,而流体动力半径较大的物质会被截留在孔隙上。[/size][/font][font='times new roman'][size=16px]此外,[/size][/font][font='times new roman'][size=16px]该方法结合其他方法使用可取得更好的效果[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]例如,与单纯的超滤法或[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]相比,该方法分离的外泌体[/size][/font][font='times new roman'][size=16px]结合[/size][/font][font='times new roman'][size=16px]后续超速离心可以[/size][/font][font='times new roman'][size=16px]提高[/size][/font][font='times new roman'][size=16px]尿外泌体[/size][/font][font='times new roman'][size=16px]的捕获效率[/size][/font][font='times new roman'][size=16px],从而有利于寻找肾脏疾病生物标志物。该方法分离外泌体[/size][/font][font='times new roman'][size=16px]主要[/size][/font][font='times new roman'][size=16px]缺点在于干扰物多[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]孔隙极易堵塞,导致色谱柱重复率低,分离效率较低。[/size][/font][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108012209419773_3887_5111497_3.png[/img][/align][align=center][font='times new roman']图[/font][font='times new roman']1-3[/font][font='times new roman'] [/font][font='times new roman']连续过滤原理图[/font][font='times new roman'][size=13px][68][/size][/font][/align][align=center][font='times new roman']Figure [/font][font='times new roman']1-[/font][font='times new roman']3[/font][font='times new roman'] [/font][font='times new roman']Schematic illustration of sequential filtration[/font][font='times new roman'][size=13px][68][/size][/font][/align][align=center][/align][font='times new roman'][color=#000000]2[/color][/font][font='times new roman'][color=#000000]基于聚合物沉淀的分离技术[/color][/font][font='times new roman'][size=16px]聚合物沉淀[/size][/font][font='times new roman'][size=16px]技术是通过添加水性聚合物使外泌体溶解度或分散性改变,减少外泌体的水合作用,使外泌体沉淀以达到分离的技术。通常使用分子量为[/size][/font][font='times new roman'][size=16px]8000 Da[/size][/font][font='times new roman'][size=16px]的聚乙二醇([/size][/font][font='times new roman'][size=16px]PEG[/size][/font][font='times new roman'][size=16px])与样品共孵育,[/size][/font][font='times new roman'][size=16px]4[/size][/font][font='times new roman'][size=16px]℃过夜后,用低速离心或过滤法分离含有外泌体的沉淀物。目前,已开发了一系列聚合物沉淀试剂盒可用于体液和培养基中外泌体的分离。聚合物沉淀分离外泌体的方法易于使用、回收率高,且不需要专门的设备。该方法的主要缺点在于容易引入蛋白质和聚合物材料等其他污染物,使得提取的外泌体纯度较低。[/size][/font][font='times new roman'][size=14px][color=#000000]3[/color][/size][/font][font='times new roman'][size=14px][color=#000000] [/color][/size][/font][font='times new roman'][size=14px][color=#000000]基于免疫亲和的分离技术[/color][/size][/font][font='times new roman'][size=16px]外泌体磷脂双层膜中含有丰富的蛋白质和受体,如[/size][/font][font='times new roman'][size=16px]CD81[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]CD63[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]TSG101[/size][/font][font='times new roman'][size=16px]、上皮细胞粘附分子等,利用这些受体与配体之间的相互作用,使外泌体与特殊设计的磁性颗粒之间建立免疫亲和作用,可用于外泌体的分离富集。例如,[/size][/font][font='times new roman'][size=16px]Zarovni[/size][/font][font='times new roman'][size=16px]等报道了一种基于微孔板的酶联免疫吸附试验([/size][/font][font='times new roman'][size=16px]ELISA[/size][/font][font='times new roman'][size=16px])用于捕获和定量检测外泌体。尽管与[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]产量相当,但是该方法具有快速、易于使用和与常规设备兼容的优势。该报道继续开发了一种基于磁免疫捕获的外泌体分离试剂盒用于从细胞培养基和生物液中分离外泌体,其质量和纯度均优于其他技术。此外,这种方法对样品的初始体积没有要求,可以很容易地缩小或增大样品容量。而该技术主要缺点在于缺乏最佳的外泌体标志物。此外,随着肿瘤的进展,肿瘤抗原表达和调节的异质性可能导致低估和假阴性,并且有些抗原表位可能被阻断或掩蔽。[/size][/font]

 留言咨询
留言咨询

 400-860-5168转3115
400-860-5168转3115
 留言咨询
留言咨询

 400-860-5168转6140
400-860-5168转6140
 留言咨询
留言咨询