推荐厂家
暂无
暂无
我是做试剂分析的,才做一个月的[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分析,单位只有一台[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]仪,而且还是二十年前的,是北京第二光学仪器厂制造的,自从我接手做[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]后,这几种元素的标准曲线都不成线性,钠、钾、镁做曲线时我用的浓度是0.1ug/ml、0.2ug/ml、0.3ug/ml,0.1ug/ml吸光度值大概都在0.12左右,镁要大些,在0.15左右,0.2ug/ml、0.3ug/ml浓度的标准样品吸光度值往下弯,铜、铅开始的时候我用的浓度:铜是0.4ug/ml、0.8ug/ml、1.2ug/ml,铅是1.0ug/ml、2.0ug/ml、3.0ug/ml,开始时线性很好,特别是铜,那时最低浓度的吸光度值:铜是0.064,铅是0.030,但问题是现在铜、铅线性都不好了,而且吸光度值均增大了,最低浓度的吸光度值分别是(我把铜、铅的浓度均减半):铜是0.074,铅是0.05左右,我不知道是什么原因,望大家多多指教,谢谢。
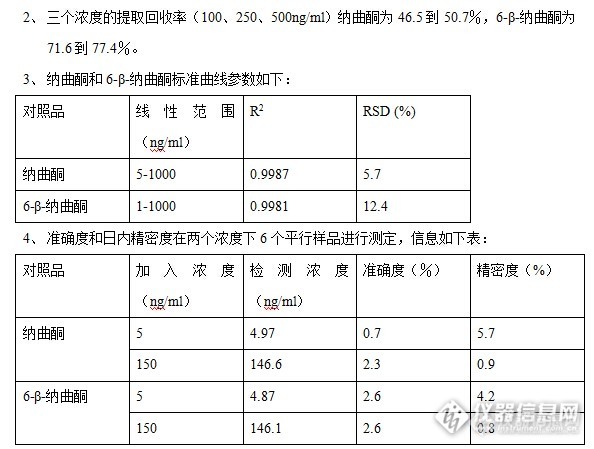
血清中纳曲酮及其代谢物6-β-纳曲酮醇的高效液相色谱分析 纳曲酮是一种阿片受体拮抗剂,其用于酒精中毒治疗及阿片类药物依赖已有几十年的历史,一些临床试验已证明纳曲酮是一种有效的酒精中毒辅助用药。临床已经证明纳曲酮相比安慰剂能够减少嗜酒复发率和对酒精的渴望。服用纳曲酮后经过快速和广泛的肝脏代谢由酶将酮还原为主要代谢物6-β-纳曲酮醇及其他代谢产物:(如下图)http://ng1.17img.cn/bbsfiles/images/2014/12/201412302127_530344_2184412_3.jpg 与纳曲酮相比6-β-naltrexol阿片受体拮抗剂作用较弱,但其仍对于疗效有贡献,因为其在体内浓度甚至高于纳曲酮。纳曲酮及其代谢物大多是以共轭形式存在。在肝硬化及其他严重的肝脏疾病中这种纳曲酮到6-β-naltrexol的代谢会有减少。随着药物治疗临床检测的发展,本次试验意于开发一种纳曲酮到6-β-naltrexol在人体血清中的同时检测手段。材料与方法:纳曲酮、6-β-纳曲酮醇、色谱甲醇纳曲酮和6-β-纳曲酮醇储备溶液制备成含1 mg/ml的甲醇溶液。储备溶液用于制备标准曲线溶液,浓度范围0-1ug/ml, 所有的校准标准,空白和质量控制样品, 均配置在空白血清中;所有缓冲液,制备用去离子水。临床采样:样品来自87个酗酒后的受试者,酗酒者采用双盲实验,设安慰剂对照组和药物治疗组,来评估对酒精依赖的作用。入选标准为18-65岁酒精依赖者。纳曲酮(盐酸纳曲酮)是每天早上50毫克口服,为期三个月。血液样品收集于服药后约2-4小时,空白血清样品采集于第一周、第二周和第八周,并使其凝固,离心(4000转[font=Times New Rom
钾、纳、钙、镁所钾的掩蔽剂,硝酸镧和硝酸铯,对铜、锌、铁、锰的测定有影响吗?






 400-659-9826
400-659-9826
 留言咨询
留言咨询

 400-659-9826
400-659-9826
 留言咨询
留言咨询

 400-860-5168转4730
400-860-5168转4730
 留言咨询
留言咨询