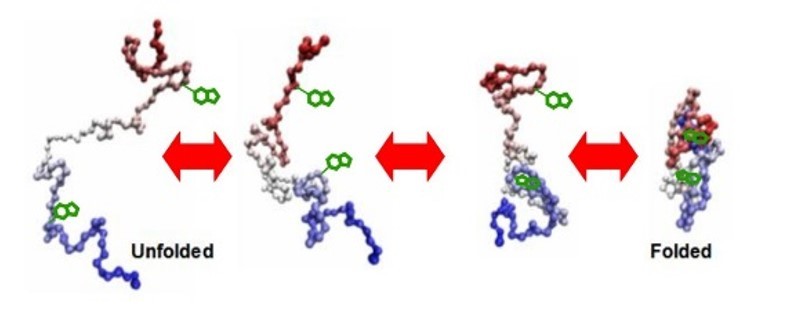
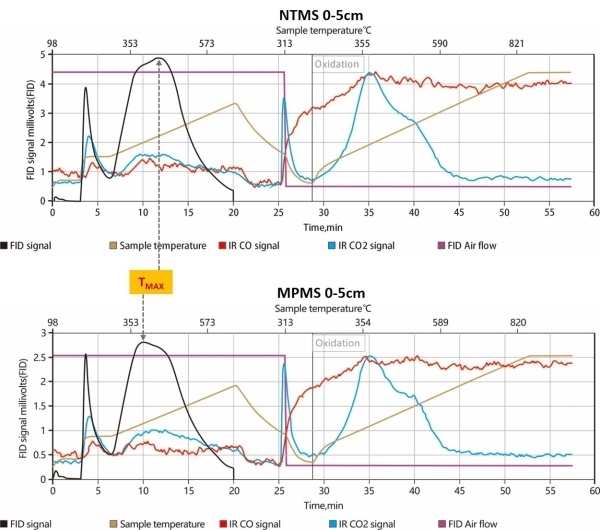
推荐厂家
暂无
暂无




 留言咨询
留言咨询
 留言咨询
留言咨询

 400-860-5168转4887
400-860-5168转4887
 留言咨询
留言咨询

有没有做过乳粉热稳定性试验的? 快来交流一下。
PVC热稳定性怎么测,用什么测试设备?有哪些测试方法?试验结果有什么不同呢?
高强耐热铝合金的热稳定性与疲劳性能研究,,,请各位大神帮忙找找这个可下载的论文,感谢