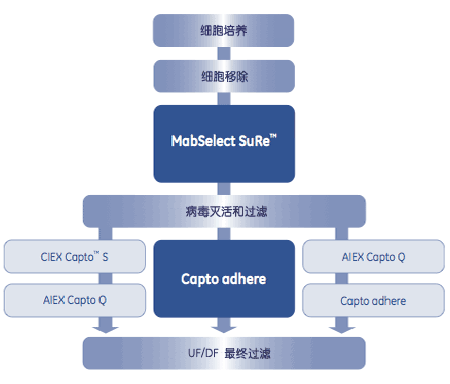
高表达抗体蛋白下游工艺技术进展
p 随着抗体药物上游大规模高效培养技术的飞速发展,抗体蛋白的表达浓度有了大幅度的提高,这给下游纯化工艺带来了巨大的压力。为了突破下游技术瓶颈,整个世界生物制药产业都加大了对下游技术的革新力度,近年来也取得了丰硕的成果。本文就抗体药物的纯化策略、最新技术进展以及技术应用等方面做一个调研,以期能对本部门的相关研究工作有所助益。 br/ /p p 自1997年来,全球抗体药物市场经历了一个快速发展的阶段,总销售额从1997年的3.1亿美元增长到2008年的400亿美元,复合增长率高达55%,而且增长势头还在持续 [1]。国际上通常把年销售额超过10 亿美元的品牌药称为“重磅炸弹”药物,很大一部分抗体药物都已迈入“重磅炸弹”行列。在2008年全球15大药品中,抗体药物占据了1/3,且排名仍在上升,这意味着几乎每种单抗药物的成功开发都代表着巨大的市场前景[2]。受益于此,全球主要的生物制药公司都获利颇丰,可见抗体药物具有巨大的经济价值和社会价值。 br/ /p p 抗体药物生产技术门槛高,需要掌握抗体筛选、抗体重组、高表达细胞株构建和大规模悬浮培养等核心技术,其下游关键技术是长期以来的薄弱之处。哺乳动物细胞表达系统具有活性高、稳定性好等优点,已成为抗体等生物制品最重要的系统之一,为抗体药物的产业化提供可能。目前,国际上该项技术发展较快,已趋成熟,以默克公司为代表的流加培养生产规模达10000L以上,以贝尔公司为代表的灌流培养生产规模达200L以上,蛋白表达浓度为1-10g/L。我国在该技术领域起步较晚,基础较差,但近年来经过努力,已经实现了该项技术的突破,流加培养规模达500L以上,灌流培养规模达100L以上,蛋白表达浓度为0.2-2g/L[2]。 /p p 随着动物细胞表达抗体产品大规模高效培养技术的快速发展,下游纯化工艺越来越成为抗体药物生产中主要的技术瓶颈[3]。因此,如何提高下游工艺的生产效率就成为了抗体药物研发必须解决的问题。本文就国际上高表达抗体蛋白下游工艺的研究进展做一个调研,使本人及同事们能了解国际上的研究成果和发展趋势,以期能对本部门的相关研究工作有所助益。 /p p 1. 抗体药物纯化策略 /p p 每个单抗的等电点、电荷密度、疏水性、糖基化程度等生化性质各不相同。选择单抗的纯化方法,既要了解它们的共性,又要了解它们的个性,从而制定相应的纯化策略(表1)。 /p p 1.1 抗体药物下游工艺一般策略 /p p CHO和NSO等哺乳动物细胞表达系统主要用来生产治疗性单抗,临床剂量大(数十至几百毫克/dose),批产量达公斤级,纯度要求极高。层析技术是抗体分离纯化的核心技术,一般采用经典的三步纯化策略:粗纯-中间纯化-精细纯化。粗纯的主要目的是捕获、浓缩和稳定样品,约80%的下游工艺用Protein A亲和层析进行快速捕获,一步即可达到95%以上的纯度。治疗用抗体一般使用动物细胞大规模高密度无血清悬浮培养进行生产,不仅对终产品的单体含量有严格的规定,还必须去除各种潜在的杂质以满足药品安全的要求,因此在粗纯之后还需要进行中间纯化和精细纯化,去除宿主细胞蛋白(HCP)、宿主DNA、抗体聚集体和变体等,常用的层析技术有离子交换、凝胶过滤、疏水层析等[4]。 /p p 2003 年初,中国SFDA下属的中国药品与生物制品检定所(NICPBP)公布了《人用单克隆抗体质量控制技术指导原则》[5]。生产者除须保证最终抗体产品纯度,还需要验证所用的纯化方法能有效对潜在的污染物,如HCP、免疫球蛋白、宿主DNA、用于生产腹水抗体的刺激物、内毒素、培养液成分、层析凝胶析出成分(脱落的Protein A配基)进行去除 并能有效的去除/灭活病毒。也就是说,在设计下游工艺时,需多角度综合考虑抗体本身的性质、抗体的来源、发酵培养技术、发酵液蛋白浓度、宿主杂质、抗体批间的差异、潜在污染及病毒灭活等问题。此外,治疗用抗体在生产和纯化过程中还会由于糖基化程度不同、蛋白酶作用、以及脱氨基和脱酰胺等反应而产生带电性质不同的多种抗体变体 另外,抗体氧化、聚集和片段化也是常见的降解途径[4]。针对这些变体,一方面,在表达和纯化过程中选择参数(如pH、盐浓度等)时要充分考虑到目标抗体的稳定性 另一方面,应控制细胞培养的条件(DO、渗透压等),同时加快下游分离纯化的速度,最大程度上避免抗体在纯化过程中产生变体,从而保证终产品的均一性和高的比活,也有利于控制终产品的内毒素水平。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/1eb75a7d-0f0f-4f60-8224-a3984ccff0e3.jpg" title=" 表1.png" alt=" 表1.png" / /p p style=" text-align: center " img src=" https://img1.17img.cn/17img/images/201810/uepic/f8ff0f67-6f0b-4295-ab81-05543e5efbd8.jpg" title=" 表2.png" alt=" 表2.png" / br/ strong 表1 单抗特性及纯化策略 /strong /p p 1.2 新型的两步层析技术与纯化工艺整合 /p p 近年来,GE Healthcare公司开发出了新型的亲和捕获介质Mabselect SuRe和混合作用模式的强阴离子交换介质Capto adhere(这两种介质的主要特点将在下文详细介绍)。凭借着MabSelect SuRe的卓越性能以及Capto adhere的复合多除杂功能,使得抗体纯化工艺由经典的三步层析转变为两步层析得以实现。这种新型的两步层析技术的工艺流程是:在细胞培养表达以后,采用0.2-0.45μm的中空纤维膜技术进行澄清,然后用MabSelect SuRe捕获,酸性条件洗脱后直接pH 4.0病毒灭活,澄清过滤后穿透方式上Capto adhere,这一步离子交换之前或之后会有一步20nm纳滤去病毒,最后50K膜超滤浓缩和洗滤进行缓冲液置换。整个工艺如图1,这一工艺平台已经尝试过多个不同的抗体并取得成功(表2),同时很多实验表明这一工艺平台适合多数抗体的生产。有些抗体如果通过优化结果不甚满意, 通过增加一步Capto Q也基本上可以达到要求或是采用Capto S-Capto Q(这两种介质的主要特点将在下文详细介绍)的工艺步骤[4]。 /p p style=" text-align: center " img src=" https://img1.17img.cn/17img/images/201810/uepic/a804fe1c-9660-4ab2-8cc4-177870630ce5.jpg" title=" 图1.png" alt=" 图1.png" style=" text-align: center " / /p p style=" text-align: center " strong 图1 抗体生产两步层析法主导的抗体纯化最新工艺[6] /strong /p p Mabselect SuRe可以达到99%以上的抗体纯度,亲和洗脱峰使用Capto adhere的流穿模式进行精纯:使抗体分子流穿而聚合体、HCP、脱落的Protein A配基等杂质结合在柱上加以去除。这样仅用两步层析就可以得到符合药用级质量要求的高纯度抗体产品,大大缩短了工艺时间,提高了生产效率,同时增加了收率,降低了生产成本。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/3ef7b3a2-9f79-4e74-8a71-6a6cbcbea5ec.jpg" title=" 图2.png" alt=" 图2.png" / /p p style=" text-align: center " strong 表2 两步法用于多种抗体的纯化结果(括号内数值为纯化前)[4] /strong /p p 2. 抗体药物下游技术最新研究进展 /p p 2.1 样品澄清 /p p 2.1.1 中空纤维膜过滤技术 /p p 中空纤维膜是近年来发展起来的新型切向流膜分离技术,与盒式膜包相比,中空纤维膜可以直接处理高固含量和高黏度的粗料液,具有容尘量高、速度快、剪切力小、成本低等优点。目前,中空纤维微滤膜已经广泛用于生物制药的各个领域[7]。 /p p 对于动物细胞培养液,可以将高密度的培养液直接用中空纤维微滤膜(0.22或0.45μm)进行澄清,而无需事先经过离心和预过滤,步骤少,速度快,收率高,成本低。和离心机比较,具有极高的澄清度,因此中空纤维澄清后的细胞培养液可直接Protein A亲和层析进行纯化。 /p p 中空纤维膜澄清细胞培养液的优势有:(1)步骤少,速度快,收率更高(通过有效的洗滤可使样品收率稳定而且高于离心机),同时最大程度上避免抗体降解而影响产品均一性。(2)成本低:不仅省去了连续流高速离心机昂贵的前期投资和运转的日常维护成本,还节省了离心后死端过滤的成本。中空纤维膜物理化学性质稳定,可以通过清洗而反复使用,成本低廉。(3)有利于内毒素控制:中空纤维膜稳定的化学性质可以耐受1M NaOH 40-50℃和氧化剂NaClO的清洗,从而有效去除内毒素 封闭的系统,也更有利于生产过程中内毒素的控制。此外,大部分中空纤维滤柱还可以进行高压灭菌。(4)低剪切力:中空纤维采用低剪切力的开放式流道,不仅可以处理含有高固含量的料液,还避免了蛋白质活性分子在高剪切力下的聚集变性,有利于抗体的稳定。(5)工艺耐用性强:相比死端过滤,中空纤维澄清具有很好的操作灵活性和耐用性,可以通过调整操作参数(流速、TMP)处理不同性质的细胞培养液。(6)易于线性放大:通过维持切向流速、TMP 等参数恒定,方便地进行线性放大,生产规模的处理量可达几千升料液,目前国内销售最大的中空纤维膜过滤系统已达400m2且生产稳定[8]。 /p p 2.1.2 深层过滤介质 /p p 深层过滤采用两种机制去除颗粒。首先是拦截,颗粒由于自身的物理尺寸在过滤器内被截留。它们可能被困在过滤器表面,因此根本没有进入基质,或在通过深层过滤基质的曲径时被俘获(筛选)。颗粒拦截伴随过滤器压差增高,因为它的基质被不断累积的颗粒堵塞。第二种机制是吸附,比过滤器拦截精度更小的颗粒能够从流体中被吸附去除。这种机制是通过深层过滤基质上的净电荷实现的[26]。 /p p 目前应用比较广泛的双层膜深层过滤介质有Millipore公司的Millistak+HC、Sartorius公司的Sartobran-P、Pall公司的Supradisc HP等。Millistak+HC深层过滤介质由纤维素和无机助滤剂(聚丙稀粘合的硅藻土)组成,包裹在聚丙烯外壳内 它由两层全厚度深层滤板(上游一层粗过滤和下游一层精细过滤)组成,附带一层RW01纤维素膜终过滤。Sartobran-P深层过滤介质由醋酸纤维素滤膜、聚丙烯外壳和支撑层组成,加强型的滤膜有良好的机械强度,有利于在反复的过滤和灭菌过程中保持完好无损 采用了折叠膜,在体积小巧的同时还保证了超大的过滤面积。Supradisc HP深层过滤介质由纤维素、硅藻土、带正电荷树脂和聚丙烯组成 也由两层全厚度深层滤板(上游一层粗过滤和下游一层精细过滤)组成。 /p p 2.2最新抗体捕获技术 /p p 2.2.1 MabSelect介质 /p p MabSelect是第一个使用高流速琼脂糖凝胶作为骨架的新型Protein A层析介质,专为大规模抗体纯化而设计,适合快速高效的进行抗体生产和放大,已经成为单抗纯化和放大的标准介质。 /p p MabSelect的特点有:(1)更高的流速和动态载量:Protein A经基因工程改造,C端含一个半胱氨酸,形成一个定向的硫酯键,同时增加了对IgG的有效结合。Protein A和凝胶偶联时采用了全新的单点偶联工艺,降低了空间位阻,因此可以在使用更高流速的条件下增加动态载量:在线形流速为500cm/hr和柱床高度为20cm(停留时间2.4min)的条件下,每毫升MabSelect的动态载量可以达到& gt 30mg IgG。(2)更低的非特异性吸附,抗体纯度更高:Mabselect介质高度亲水性的琼脂糖骨架最大程度上降低了非特异性吸附,使得洗脱峰中杂蛋白和DNA更少,有利于后期抗体的精细纯化。著名的抗体生产商IDEC公司以及R.Hahn的研究显示,Mabselect对CHO细胞HCP的吸附比其它Protein A介质低7倍[9-10]。R.L.Fahrner等的研究显示,Mabselect所得抗体的DNA残留量比其它Protein A介质低30%[11]。(3)更低的Protein A脱落:MabSelect由于通过新型环氧共价交联技术,Protein A的脱落比其它同类介质低,这不仅有利于抗体纯化,还延长了介质的使用寿命,降低了生产成本。(4)更易于工艺的线性放大:通过实验室条件的优化,MabSelect 可以在保持线性流速和上样比例等参数不变的条件下,通过增加柱直径进行线性放大。(5)MabSelect 易于清洗与除菌,寿命更长、更经济:在长期连续的生产中,有效的在位清洗(CIP)有助于延长介质使用寿命,但一般的Protein A介质往往不能耐受NaOH,只能使用高浓度的尿素或盐酸胍进行清洗,效果远不如NaOH且成本非常高。而MabSelect的CIP和除菌程序简单,用很常规、经济的试剂如50mM NaOH+1M NaCl或50mM NaOH+0.5M Na2SO4就可以有效去除沉淀和变性物质 用非离子去污剂或酒精可以去除通过疏水作用结合的物质 用0.1M醋酸和20%酒精可以在位灭菌(SIP)。经测试,Mabselect配合CIP(50mMNaOH+1M NaCl)纯化三百次后,抗体产品纯度与收率不变[12]。 /p p 2.2.2 MabSelect Xtra介质 /p p Mabselect Xtra介质是在Mabselect介质的基础上优化而来,是目前市场上所有的商品化Protein A介质中载量最高的亲和层析介质之一。它除了具有MabSelect介质的全部特点外,还具有载量最高和非特异性吸附更低的特点。 /p p Mabselect Xtra介质使用孔径更大的多孔高流速琼脂糖作为骨架,同时减小介质粒径。这样不仅增加了比表面积和配基密度,还降低了传质阻力,从而有效的增加了动态载量。其动态载量超过41mg/ml,在工艺生产过程中可以有效减少层析柱的体积,从而降低生产成本。R.Hahn的研究显示,Mabselect Xtra对CHO细胞HCP的吸附比其它Protein A介质更是低了近10倍[13]。 /p p 2.2.3 MabSelect SuRe介质 /p p MabSelect SuRe介质也是在Mabselect介质的基础上优化而来,是目前市场上唯一耐强碱的Protein A亲和层析介质,寿命最长,稳定性最好[10]。它除了具有MabSelect介质的全部特点外,还具有以下特点:(1)可以耐受0.1-0.5M NaOH:MabSelectSuRe具有不同于其它Protein A介质的同型四聚体配基-SuRe配基,即使在强碱条件下也不易变性或脱落,可以用高达0.5M NaOH进行CIP和SIP,能有效去除沉淀和变性物质,大大降低了抗体产品被内毒素污染和批间交叉污染的风险,有利于延长介质使用寿命,同时还大大降低了CIP和SIP的成本。(2)更温和的洗脱,避免抗体聚集,提高收率:同型四聚体配基避免了不同配基与抗体Fc段亲和性的差异,也消除了某些域对Fab段的亲和作用,使得洗脱条件更加均一而温和。Mabselect SuRe介质可以用更高的pH进行洗脱,有效避免了抗体在低pH下的聚集,产品纯度和均一性更高,浊度也更低[14]。(3)不同抗体洗脱所需pH差异小:由于消除了对抗体Fab段的亲和作用,使得同一种属亚型的不同抗体分子洗脱所需的条件更接近,有利于平台技术的建立,进一步降低了不同的抗体分离纯化工艺的研发成本。(4)SuRe 配基稳定性更好:SuRe配基对碱和蛋白酶更稳定,纯化过程中脱落更少(& lt 10ppm),有利于后期脱落配基的进一步去除。 /p p 2.2.4 ProSep-vA Ultra介质 /p p ProSep-vA Ultra介质是将自然界非动物性来源的Protein A交联于700Å 的多孔性玻璃珠骨架上,是刚性和不可压缩的介质。ProSep-vA Ultra介质具有如下特点:低反压性 不收缩、不溶胀 高动态载量 极低的Protein A脱落 高重复使用性,标准化的清洗和除菌操作[27]。 /p p 2.2.5 ProSep Ultra Plus介质 /p p ProSep Ultra Plus介质是在ProSep-vA Ultra介质基础上优化而来,也是目前市场上所有的商品化Protein A介质中载量最高的亲和层析介质之一。它除了具有ProSep-vA Ultra介质的全部特点外,还具有载量最高、纯化效率更高、工艺更易于放大、成本更低等特点[28]。 /p p 2.2.6 MEP Hypercel介质 /p p MEP Hypercel复合作用模式介质是一种灵活的层析介质设计,也称之为疏水电荷诱导层析(HCIC),用于捕获和纯化从实验室到生产规模的抗体和各种重组蛋白。MEP Hypercel介质由一个独特的连接4-巯基乙基吡啶(4-MEP)的刚性纤维素骨架组成。纤维素骨架赋予高孔隙率、化学稳定性和低非特异性吸附。平均直径80-100μm,在低反压下有优良的流速特性。MEP Hypercel介质在大规模使用时具有显著优势,基于它的配基结构,可选择性地捕获免疫球蛋白。组合其它传统的方法如离子交换、疏水作用,甚至用在Protein A之后从不同的料液中直接捕获或中度纯化抗体,以增强对宿主DNA、HCP和聚合体的清除。MEP Hypercel介质有助于建立一个简化的工艺流程,节省操作步骤(例如洗滤、超滤等) 预计有更长的使用寿命,因为它可以耐受苛刻的CIP方法(0.5-1M NaOH,30-60分钟接触时间),而所有因素都有利于降低成本[29]。 /p p 2.3最新精细纯化技术 /p p 2.3.1 CaptoFamily系列介质 /p p 新型的Capto S,Q系列介质是以高流速琼脂糖为骨架,同时交联了非常“柔软”的葡聚糖链,这样不仅增加了比表面积,同时降低了传质阻力和空间位阻,使得介质在高流速下的动态载量大大增加,有利于提高生产效率,降低成本。 /p p Capto S,Q系列介质可以装填在直径60cm的工业层析柱中使用高达500cm/h 的流速进行纯化(柱高30cm)。这样不仅有利于工艺放大后大规模层析柱的填装,还大大提高了生产效率,每步层析更短的操作时间也有效避免了抗体分子在分离纯化过程中产生各种变体和聚合体,使得收率更好,终产品的活性更高、性质更均一。 /p p 2.3.2 Captoadhere介质 /p p 为了进一步减少抗体分离纯化步骤,提高特定杂质的去除效率,以满足日益增长的治疗用抗体的生产需要,2007 年初,GE Healthcare公司推出了新型复合作用模式的强阴离子交换介质:Capto adhere介质。Capto adher介质专为治疗用抗体的分离纯化而设计,其配基综合了阴离子交换、氢键和疏水等多种复杂的作用方式,因此对于抗体的聚合体具有非常独特而高效的去除能力。此外,通过有效的实验设计(DoE),流穿模式的Capto adher介质还可以同时有效去除脱落的Protein A配基、HCP、宿主DNA、内毒素和潜在的病毒,并使得结合MabSelect SuRe的抗体两步层析纯化工艺成为现实(表3)。Capto adhere还具有很强的病毒去除能力,如MVM病毒的去除能力可达5.9个Log。目前,新型的两步法抗体层析纯化工艺已经被国内外诸多知名药企广泛用于多种抗体的分离纯化,各项指标均符合治疗用抗体的要求。Capto adher层析还可以和阴离子交换(Capto Q)和疏水层析等结合使用,以达到更高的质量要求[15]。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/282961ea-e704-47d1-aabd-f044e108f59c.jpg" title=" 图3.png" alt=" 图3.png" / /p p style=" text-align: center " strong 表3 两步层析纯化工艺对污染物的去除效果[15] /strong /p p 2.3.3膜层析技术 /p p PALL Life Science公司自10余年前颠覆性地开发出独一无二的层析产品-Mustang膜层析系列产品后,经过不断地技术改造,于近年推出全新Mustang Q XT家族,扩展了膜层析工艺放大产品线。膜层析技术,相对于传统的柱层析,无需层析填料和层析柱等复杂构件,直接通过膜式过滤器,经过简单的过滤环节即可达到纯化目的。Mustang Q以16层超级打褶的聚醚砜过滤膜作为基架,上面偶联了季胺基等功能基团,可以使生物分子流经的时候与功能位点迅速结合,具有高流速和高动态载量等优点。 /p p Sartorius Stedim公司也开发出了一整套膜层析技术,包括Sartobind S,Q,C和D离子交换、Sartobind IDA(亚氨基二乙酸)金属螯合、Sartobind醛、Sartobind环氧基和Sartobind Protein A(重组)等膜层析系列产品。Sartobind在很多蛋白和病毒纯化应用中可以取代传统耗时、繁琐的层析步骤。膜吸附器的快速纯化特点使蛋白分离可以在高流速下获得高收率,较传统柱层析流速最高能提高100倍,达到20-40 CV/min。传统颗粒胶95%以上的结合位点集中在颗粒胶内部。Sartobind膜层析的结合位点是均一地交联到交叉偶联的增强纤维素骨架内0.5-1μm厚的薄层上。大孔结构和快速吸附结合特性使膜吸附器可以忽略扩散时间因素。同时多微孔膜结构不存在传统颗粒胶的孔内扩散问题。在对流情况下,流动相的分子运动只由泵压力决定。因此,膜吸附器具有操作周期极短、流速和处理能力极高的特点[30]。 /p p 与离子交换柱层析相比,离子交换膜层析技术已经被证明利用高动态结合能力吸附大量的生物分子,如病毒、HCP和宿主DNA。最近,阴离子交换膜层析技术已经被作为柱层析技术的替代技术用于Protein A亲和捕获后的mAb中微量污染物的去除[16]。 /p p 2.4终产品的浓缩洗滤 /p p 多维纯化得到的洗脱峰可以用Kvick Lab/Process盒式膜包进行快速浓缩和缓冲液置换。Kvick盒式膜包的优点有:(1)无热原:很多时候,仅用0.5M NaOH 清洗难以彻底去除膜表面的热原。Kvick盒式膜包化学性质非常稳定,可以使用1M NaOH在40-50℃下进行彻底的SIP/CIP,避免最终超滤浓缩时引入热原而影响产品质量。(2)孔径均一、速度快:Kvick盒式膜包孔径更均一,甚至可以使用50-100K的膜包进行抗体浓缩而不漏过,速度更快,大大节省了操作时间。(3)易于线性放大:通过保持流速、TMP等参数恒定,可以直接线性放大到生产规模。 /p p Amicon Ultra系列超滤离心管可以用来进行抗体的快速浓缩、脱盐及缓冲液置换。它具有如下特点:(1)效率高:一步法离心达到25到80倍浓缩。(2)节省时间:垂直结构的膜,避免堵膜,减少浓差极化,可以用超快离心速度极短时间完成 最少10分钟即可完成浓缩、脱盐或缓冲液置换。(3)收率高:独特的反转离心设计,有利于取得最大回收率且避免了人为移液误差 低吸附滤膜和聚丙烯内壳,使回收率高达90%以上。(4)不漏液、无损失:100%完整性测试确保不漏液 独特的死体积设计避免过度离心至干,没有样品损失。(5)广泛的化学相容性:与广泛的溶剂兼容,适用于pH1-pH9,热封膜杜绝了粘合剂和下游溶出物污染。 /p p Vivaspin系列超滤离心管同样是进行蛋白质快速浓缩和缓冲液置换的常用产品。获得专利的垂直膜配合狭长的流道设计,有效地避免滤膜堵塞,提高浓缩速度 同时在浓缩管底部设计有死端结构,确保即使离心时间过长也不会发生样品被甩干的现象。Vivaspin可灵活选用三种不同材质的超滤膜:聚醚砜、三醋酸纤维和Hydrosart。它的另一个特点是有两种回收浓缩液的方法,既可以直接用移液器从浓缩管底部吸取,也可以将浓缩液反转离心到回收管内,加盖密封保存,这两种方法都保证了高回收率。Vivaspin经过一次离心,最高可以将蛋白溶液浓缩300倍。 /p p 2.5终产品的除菌除病毒过滤 /p p 浓缩后的样品,最终经过0.22μm无菌滤器进行除菌过滤。ULTA Pure SG,HC除菌滤器具有过滤速度快、化学稳定性好、载量高和溶出物少等优点,细菌挑战实验表明其除菌能力大于7log。除菌过滤过程的优化主要从三个方面入手:操作过程中过膜压力的控制、过膜流速以及单位膜载量控制,这三个参数优化以后,可以在同种类型、材质的NFF膜上进行线性放大,否则很容易影响收率。 /p p Durapore除菌级亲水性滤膜由亲水性PVDF材料制造,具有可靠的除菌保证以及低蛋白吸附量、低析出、无纤维脱落、广泛的化学兼容性等优点,是常用的除菌滤膜。Durapore 0.22μm亲水性滤膜用于液体除菌或去除微粒,0.1μm亲水性滤膜用于液体中去除微粒、微生物和支原体。装有Durapore亲水性滤膜的滤器有Millipak、Opticap XL、Opticap XLT、筒式滤器和Optiscale等。Millipak滤器独特的堆叠盘状设计使残留量最小并且无颗粒脱落,因此适合于高附加值产品的终端过滤和灌装。Millipak和Opticap XL滤器都有O型圈垫片和软管倒钩连接的上游排气阀和排空阀设计,使操作简单易控。Opticap XL和XLT滤器的结构设计,特别耐高温、高压条件,在除菌过程中提供更高的稳定性和可靠性,同时更易清洗。Optiscale一次性滤器专为小规模工艺筛选和工艺放大所设计,是工艺评估的理想工具。 /p p 目前被广泛应用的生物制品病毒去除的方法是纳米膜过滤。纳米膜过滤有如下优点:(1)针对性强,实用性广:纳米膜过滤只与病毒和目的蛋白的大小有关,无论病毒是否有脂包膜外壳、是否耐热,纳米膜过滤都能将之去除。(2)毒性小,下游污染少:能有效去除杀灭病毒后可能留下的如抗原和核酸蛋白混合物等病毒标志物,有效降低下游污染,是纳米膜的另一特点。大多数病毒灭活处理都使用有毒或致突变的理化试剂,从而必须在使用后从蛋白质溶液中清除,而纳米膜过滤不存在毒性问题,只是在验证中要考虑到滤器浸出物的风险。(3)蛋白活性高,回收率高:纳米膜过滤是在正常条件下的pH、渗透压和温度下进行的温和的生产步骤,其蛋白回收率和活性都很高,通常在90%—95%。基于体外分析、实验研究和临床经验,纳米膜过滤试验都没有显示出蛋白质改变或是新抗原的产生。纳米膜过滤不改变制品特性,这一特点促进了监管机构认可和产品的注册。 /p p 日本Asahi Kasei公司于1989年推出了第一款专门为清除生物制药产品中病毒颗粒而设计的过滤器Planova,由亲水铜铵再生纤维素制成的中空纤维微孔膜,装入聚碳酸酯壳体中。Millipore公司的Viresolve NFP膜是一种复合PVDF膜,过滤盒被设计来从高纯蛋白溶液中移除小型病毒,如B19,蛋白质溶液中,B19的去除量通常& gt 4 log。PALL Life Science公司的Ultipor VF DV50和DV20膜式过滤器可以从生物流体中去除显著数量级的病毒,同时目标蛋白可以很好地通过。滤芯由三层独特的亲水、低蛋白吸附的PVDF滤膜经新月型打褶方式构成,过滤面积大,具有可靠、安全和高流量等特点。Sartorius Stedim生产的Virosart CPV为聚醚砜过滤器,能去除& gt 4 log的PPV和& gt 6 log的逆转录病毒。 /p p 2.5扩张柱床吸附层析技术 /p p 扩张柱床吸附层析技术(EBA)是上世纪九十年代初期进入下游生产,整合了发酵和下游纯化的技术。新一代STREAMLINE Direct扩张柱床设备及介质是EBA技术中最成熟的产品。通过条件优化,STREAMLINE能直接从浑浊的发酵液中捕获目标生物分子,细胞碎片及不吸附的杂质穿过扩张床内悬浮的介质被冲洗掉,将以往澄清、浓缩、捕获等步骤整合为一步,达到粗纯化的效果(图2)[17]。 /p p STREAMLINE的操作过程如下[17-18]:(1)起始:将STREAMLINE介质倒入扩张柱中。(2)平衡:从下向上流的缓冲液,将STREAMLINE柱内的吸附介质悬浮起来,形成稳定的、充分平衡好的扩张床。(3)上样:发酵液带菌体从柱底进入,目标生物产品吸附在STREAMLINE介质上 不吸附的宿主杂质及菌体碎片随液流从柱顶排出。(4)淋洗/穿透:进一步用缓冲液将不吸附的杂质洗掉。(5)洗脱:洗脱液洗脱目标生物产品。(6)CIP/再生:用1M NaOH+1M NaCl进行CIP。整个操作过程如图3所示。 /p p /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/dba748ae-d64e-479c-8fb1-ea738ef437da.jpg" title=" 图4.jpg" alt=" 图4.jpg" / /p p style=" text-align: center " strong 图2 传统纯化工艺与STREAMLINE [17] /strong /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/0f71d1a8-a218-43f5-8c1f-917bd4f432a5.jpg" title=" 图5.png" alt=" 图5.png" / /p p style=" text-align: center " strong 图3 STREAMLINE的基本工作原理和操作过程[18](箭头示液体过柱时的流向) /strong /p p STREAMLINE介质是一系列包裹着石英芯,以琼脂糖为骨架的介质。特殊设计的STREAMLINE扩张柱床可以产生稳定的向上拔的扩张液流,每一颗不同比重的STREAMLINE介质,悬浮在自身重力和扩张升力平衡的位置原地扰动。STREAMLINE技术是稳态扩张,样品流均匀分布整个床体,目标产物吸附均匀,穿透小,回收率高,类似于固定床吸附性层析[19]。 /p p 3. 抗体最新下游技术应用实例 /p p Lonza Biologics公司是全球最大的抗体合同生产商之一,为了开发一个稳定的20000L的抗体生产工艺,其纯化开发部门对多个不同的抗体亲和层析凝胶进行了有效的比较,他们发现Mabselect SuRe的动态载量高、使用寿命最长、Protein A脱落最低,实验数据明确支持放大到1.4m直径的柱子用于20000L培养规模的经济生产[4]。 /p p 德国的Roche公司一种用于肿瘤治疗的单抗已进入临床Ⅲ期。他们将目前几种Protein A介质进行充分的比较之后,选择了高载量、更易于装柱和寿命更长的Mabselect。目的抗体是通过无血清培养的转染的杂交B淋巴细胞表达的IgG1。将过滤后的无细胞上清上样到Mabselect填充的FineLINE柱,直径300cm,柱高20cm,上样的浓度是30mg/ml。洗脱后,洗脱液立即用磷酸钾中和pH值到6.8-7.0,再用凝胶过滤检测,结果表明比活超过90%,纯度在95%以上[20]。 /p p Cytheris公司是法国一家生物制药公司,目前正在研制一种用CHO细胞表达的免疫调节剂(临床Ⅱ期)。原先的工艺采用传统层析法,但不能稳定去除病毒。改进后,在工艺的第一步使用Mustang Q对污染物进行捕获,取得了25%去除率的良好结果 同时对MVM、MLV和Re03三种病毒也达到超过4个Log的滴度降效果,而整个工艺对病毒的去除效率普遍提高了7-11个Log。说明Mustang Q的使用对下游层析起到了很好的保护作用。 /p p 在第五届生物制药工艺优化大会上,Crucell公司介绍了他们对腺病毒(AAV)纯化工艺的摸索。与传统的层析填料相比,Mustang Q膜层析的开放孔道的设计使对病毒的动态载量大大提高30倍左右,回收率在80%以上。用40L的膜层析柱相当于1000L的传统层析柱的效果,节省了验证工作,提高了工艺经济性,十分有利于放大生产。 /p p 德国的Boehringer Mannheim公司生物制药部,用STREAMLINE技术代替传统工艺生产400L CHO细胞培养的Fc融合蛋白,结果样品回收率提高14%,缓冲液减少25%,时间缩短47%[17]。 /p p 世界最大的制药公司-GlaxoSmithKline公司,使用特别设计的BioProcess全自动层析系统和STREAMLINE扩张柱生产药用脂蛋白疫苗,比原工艺产品体积缩小2倍,纯化系数1.5,内毒素减少100倍[17]。 /p p 日本YOSHITOMI公司正在使用多套STREAMLINE 1000系统生产人重组白蛋白,与原生产工艺产品纯度相同,产率提高30%,时间减少一半,年产量为12.5吨[17]。 /p p AVECIA公司重新设计临床Ⅲ期药品生产工艺,选用STREAMLINE技术及SOURCE新型凝胶,生产效率提高12倍,回收率提高1倍[17]。 /p p 2001年,ILEX制药公司的CAMPATH获得FDA批准。该单克隆抗体使用Sartobind Q离子交换层析模块以流穿的方式进行精制,这是膜吸附器首次被批准应用于治疗性蛋白的生产,证明了膜层析技术通过了证实和测试[30]。 /p p 4. 展望 /p p 随着抗体产品上游大规模高效培养技术的进一步发展,实验室规模哺乳动物细胞表达水平可以达到25g/L,如果这一水平能够有效放大到生产,将对下游生产纯化带来更大的压力。所以下游纯化工艺的技术发展也是势在必行。 /p p 以下一些发展方向可能成为下游工艺未来发展的重要关注点:(1)刚性更好、载量更高、耐碱性更好的完全亲水琼脂糖凝胶的开发[4]。(2)优化操作次序,降低缓冲液消耗的更大规模生产线的应用[21]。(3)通过单抗的氨基酸序列预测下游工艺关键参数:亲和层析洗脱pH条件、离子交换层析洗脱pH和盐浓度条件、病毒灭活pH等[22]。(4)下游工艺的成本消耗占全部成本的50-80%,亲和捕获是下游工艺的最关键步骤,通过改进亲和配体,提高捕获能力,节省成本[23]。(5)新型层析系统全程实时控制纯化过程,在线检测HCP、宿主DNA、Protein A等的含量[24]。(6)由于在去除杂质方面的优势,膜层析将会得到飞速的发展,未来工艺甚至可能完全基于膜层析而不是柱层析[25]。 /p p 参考文献 /p p [1] 刘亚明,薛章.生物制药:迎接抗体药物的黄金时代.医药细分子行业研究报告,2009. /p p [2] 陈志南.基于抗体药物的我国生物制药产业化发展前景.2008中国药学会学术年会暨第八届中国药师周论文集,2008. /p p [3]Gail Dutton.Trends in Monoclonal AntibodyProduction.Feature Articles,2010, 30(4). /p p [4]孙文改,苗景赟.抗体生产纯化技术.中国生物工程杂志,2008,28(10):141-152. /p p [5]《人用单克隆抗体质量控制技术指导原则》.NICPBP(中国药品与生物制品检定所),2003. /p p [6]Capto adhere:用于生产单抗的两步纯化操作.GE Healthcare公司技术资料. /p p [7]中空纤维滤柱分离纯化应用集锦.GE Healthcare公司技术资料. /p p [8]中空纤维膜过滤技术在单抗生产中的应用.GE Healthcare公司技术资料. /p p [9]Amersham Biosciences.Downstream Gab’02 Abstracts,Extended Reports from the 2nd International Symposium on DownstreamProcessing of Genetically Engineered Abtibodies and Related Molecules. PortoPortugal,2002,12-14. /p p [10] R.Hahn,R.Schlegel,A.Jungbauer.Comparison of Protein A affinity sorbents.JChromatogr B,2003,790:35-51. /p p [11] R.L.Fahrner,et al. Performancecomparison of Protein A affinity chromatography sorbents for purifyingrecombinant monoclonal antibodies.BiotechnolAppl Biochem,1999,30:121-128. /p p [12] K.Brorson,J.Brown,et al.Identification of protein A media performanceattributes that can be monitored as surrogates for retrovirus clearance duringextended re-use.Journal ofChromatography A,2003,989:155-163. /p p [13] R.Hahn,et al.Comparison of Protein A affinity sorbents Ⅲ,Life time study.J Chromatogr A,2006,1102:224-231. /p p [14] S. Ghose,et al. Antibody Variable RegionInteractions with Protein A: Implications for the Development of GenericPurification Processes. Biotechnol Bioeng,2005,92(6):665-673. /p p [15]用复合配基阴离子交换柱去除单克隆抗体(Mab)的污染物.BioProcessInternational技术资料. /p p [16]利用Mustang Q膜层析从Protein A纯化的单克隆抗体中去除污染. PALL LifeScience公司技术资料. /p p [17]整合发酵和下游纯化的新技术:扩张柱床吸附技术.GE Healthcare公司技术资料. /p p [18]余晓玲,米力,姚西英,陈志南.扩张柱床吸附层析与固定柱床层析纯化单克隆抗体的比较.中国生物工程杂志,2003,23(1):61-64. /p p [19]High-throughput monoclonal antibody purification.GE Healthcare公司技术资料. /p p [20]抗体纯化手册.GE Healthcare公司技术资料. /p p [21]Purification Strategies to Process 5 g/L Titers ofMonoclonal Antibodies. BioPharm International技术资料. /p p [22] T.Ishihara,T.Kadoya.Accelerated purification process development ofmonoclonal antibodies for shortening time to clinic:Designand case study of chromatography processes.J Chromatogr A,2007,1176(1-2):149-156. /p p [23] A.Cecilia,A.Roque,et al.Antibodies and Genetically Engineered RelatedMolecules:Production and Purification.BiotechnolProg,2004,20:639-654. /p p [24] S.Flatman,I.Alam,et al.Process analytics for purification of monoclonal antibodies.JChromatogr B,2007,848:79-87. /p p [25]ProcessChromatography:Five Decades of Innovation.BioPharmInternational技术资料. /p p [26]双层滤板膜堆在单抗工艺上的大规模澄清过滤应用评估.BioProcessInternational技术资料. /p p [27]Affinity Chromatography Media.Millipore公司技术资料. /p p [28]ProSep Ultra Plus ChromatographyMedia.Millipore公司技术资料. /p p [29]MEP Hypercel混合模式层析填料. PALL LifeScience公司技术资料. /p p [30]Sartobind膜层析技术高效的蛋白纯化工具. SartoriusStedim公司技术资料. /p
 留言咨询
留言咨询
 留言咨询
留言咨询
 留言咨询
留言咨询

 400-875-3676
400-875-3676
 留言咨询
留言咨询
 400-605-1688
400-605-1688
 留言咨询
留言咨询

 400-860-5168转2472
400-860-5168转2472
 留言咨询
留言咨询