方案详情文
智能文字提取功能测试中
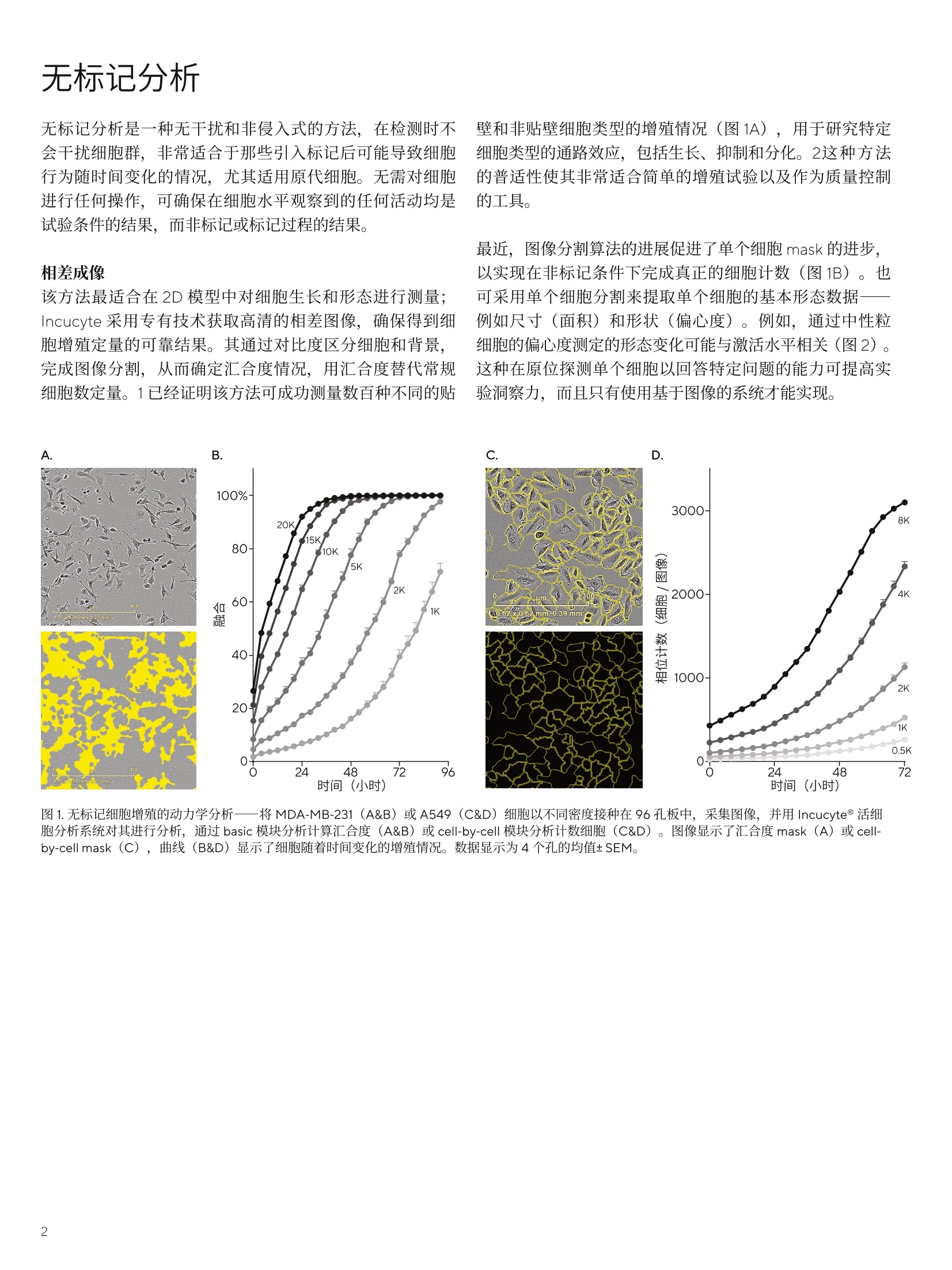
SARTORIUS 明场成像 2020年11月 关键词或短语: 活细胞分析、细胞生长、增殖、细胞形态、类器官、3D细胞模型 采用活细胞分析系统最大限度地洞察细胞生长 引言 监测细胞生长和形态对于大多数生物学事件的研究至关重要。针对特定细胞群的个性化治疗有可能改善一系列疾病疗效的前景,人们对这一领域的兴趣大大增加。然而,与这个看似简单的活动相关的技术挑战还有很多:细胞生长需要时间,这使得实时监测和非侵入式测量,对获得高质量的结果至关重要。活细胞分析系统应运而生,其可以在不干扰细胞生长或形态的情况下,提供可靠、可重复和可比较的有价值的数据信息。活细胞分析系统可实现实时成像、 一体化图像分析和即时数据可视化,对活细胞的行为进行实时量化,长达数天、数周甚至数月。这样就不再需要使用终点法多次检测和分析,可以连续地收集数据,避免遗漏关键生物事件。 该技术的非侵入性使其成为流式细胞术和多功能酶标仪等其他终点检测方法的补充,并可结合使用无标记或荧光标记的方法,扩展到更复杂的应用中。因此,考虑每项实验需要哪些能力变得至关重要。众所周知, Incucyte@系列的活细胞分析系统在该领域处于领导地位,为在工业规模量化细胞随时间变化情况提供一种便捷的方法,为人们提供比从前更深层次的生物机制理解。该白皮书将展示如何利用 Incucyte 系统的活细胞分析能力回答常见的生物学问题,并通过示例讨论在不同的场景中哪些功能提供了最大的洞察力。 无标记分析 无标记分析是一种无干扰和非侵入式的方法,在检测时不会干扰细胞群,非常适合于那些引入标记后可能导致细胞行为随时间变化的情况,尤其适用原代细胞。无需对细胞进行任何操作,可确保在细胞水平观察到的任何活动均是试验条件的结果,而非标记或标记过程的结果。 壁和非贴壁细胞类型的增殖情况(图1A),用于研究特定细胞类型的通路效应,包括生长、抑制和分化。2这种方法的普适性使其非常适合简单的增殖试验以及作为质量控制的工具。 相差成像 该方法最适合在2D 模型中对细胞生长和形态进行测量;Incucyte 采用专有技术获取高清的相差图像,确保得到细胞增殖定量的可靠结果。其通过对比度区分细胞和背景,完成图像分割,从而确定汇合度情况,用汇合度替代常规细胞数定量。1已经证明该方法可成功测量数百种不同的贴 最近,图像分割算法的进展促进了单个细胞 mask 的进步,以实现在非标记条件下完成真正的细胞计数(图1B)。也可采用单个细胞分割来提取单个细胞的基本形态数据-例如尺寸(面积)和形状(偏心度)。例如,通过中性粒细胞的偏心度测定的形态变化可能与激活水平相关(图2)。这种在原位探测单个细胞以回答特定问题的能力可提高实验洞察力,而且只有使用基于图像的系统才能实现。 图1.无标记细胞增殖的动力学分析——将MDA-MB-231 (A&B) 或A549 (C&D)细胞以不同密度接种在96孔板中,采集图像,并用 Incucyte@活细胞分析系统对其进行分析,通过 basic 模块分析计算汇合度(A&B) 或 cell-by-cell模块分析计数细胞(C&D)。图像显示了汇合度 mask (A) 或 cell-by-cell mask (C),曲线(B&D)显示了细胞随着时间变化的增殖情况。数据显示为4个孔的均值±SEM。 -8 图2.无标记的细胞形态学评估。新鲜分离的人中性粒细胞(PMN)接种在含 CXCL8 的 Matrigel'M 预包被板上,采用 Incucyte@活细胞分析系统收集图像。采用 cell-by-cell分析软件对图像进行分析,以实现单个细胞图像分割处理,并实时细胞形态变化的量化。图像显示,在 CXCL8处理(A) 后, PMN从紧密的球状变为扁平、拉长的形态。细胞形态变化通过偏心度来量化,同时发现细胞面积也有类似变化发生。细胞偏心度呈现CXCL8浓度依赖性增赖(B)。数据显示了4个不同供体的平均反应,处理后1小时的 EC50 值为 0.63nM (C)。 对3D结构的多细胞模型研究需要明场成像。与2D单层模型相比,这些3D 细胞模型更能代表和预测体内条件,可提供更多体内相关性和转化性的观察结果。例如,细胞球体越来越多地被用于肿瘤研究,因为其可显示出与真正的癌症更相似的生理特点,包括类似的形态学、细胞存活率提高和低氧性核心,这些都有助于揭示对于癌症生长至关重要的驱动因素,并识别确定新的治疗靶点。3 随着细胞模型从简单的单层细胞发展到更先进的多细胞3D模型,有必要研发基于明场成像的专业分析技术,以解释不同试验体系之间的差异。例如,需要在单个z平面上增强自动聚焦和成像,才能获取生长在圆底板中单球体的图像,这是一种越来越常见的肿瘤模型。另外,,:生长在细胞外基质上的多球体可更好地捕获肿瘤微环境,这就要求明场条件下更深的景深,.1以提高图像质量。 最近,嵌入MatrigelM液滴的类器官也被引入作为细胞模型。这些类器官分散在不同的乙轴平面上,因此,需要乙轴扫描来确定具体位置,并允许图像分割。所有这些采集模式产生的2D表征可以被 mask 和量化,以给出3D结构的特征,这是测定生长和形态所必需的(图3)。 明场成像对于研究各个阶段的细胞生长都特别有帮助,如肿瘤形成过程以及细胞相互作用。采用活细胞分析成像可直观地监测球体大小随着时间的变化,而不会破坏组织培养物,并有助于了解有丝分裂过程中细胞生物量的积累。也可将明场和相位成像结合起来,对球体形态学、生长和缩小进行无标记研究。相位成像可提供定性信息,而明场成像可提供动力学定量和细胞依赖性生长速率评估的方式。 Time (hours) 图 3.3D 结构的明场成像。示例显示了 MDA-MB-231细胞形成的单球体明场图像,A549 细胞作为多球体培养物接种在 Matrigel上,以及嵌入在Matrigel 胶滴中的小鼠胰腺类器官。mask 以黄色显示,以用来定量细胞增殖随时间的变化。定量结果如曲线图所示。 理想情况下,细胞和细胞群的研究均不要标记,然而并非所有生物研究均可用此方法解决。因此,另一个常见的方法是用荧光标签标记细胞特征。我们可以用荧光染料标记细胞,这是一种简单、短期的方法,但随着细胞分裂的发生,荧光信号会随着时间的推移而减弱;或者我们可以选用一种稳定长期的方法,如稳定表达荧光蛋白(例如GFP),则需要转导等复杂的细胞操作;此外荧光标记抗体可用于混合细胞群中特定细胞的表面蛋白进行选择性标记。 将荧光标记与活细胞成像结合,通过提供可视化监测,实现细胞计数和汇合度监测,对特定刺激处理的细胞反应进行分析,这也是肿瘤研究中的一项常见技术。4.5 细胞标记,无论是用荧光染料进行标记,还是通过转导荧光蛋白进行标记,均可在建立共培养模型之前进行。标记技术的选择取决于实验的持续时间和转导的方便程度。对于实验超过48小时的长期监测,建议使用转导荧光蛋白标记,而原代细胞的转导通常比较有挑战性。 单独细胞的标记 荧光标记可有力地验证之前所述的无标记技术,反之亦然,无标记技术对于确认潜在的荧光探针是否对细胞无干扰,并优化细胞培养的实验至关重要。例如,已经通过比较一系列野生型和标记细胞的生长速率验证了 Nuclight@ Lentivirus试剂和 Nuclight Rapid 快速标记试剂,通过对比无标记情况下大批量不同细胞类型的生长速率,证实这些试剂不会影响细胞增殖,因此非常适合各种活细胞成像的应用。 一旦建立了共培养体系,识别每种细胞类型有助于测定细胞特异性的效应。例如,多重测定可用于揭示谷氨酰胺酶抑制剂在三阴性与生长因子受体阳性乳腺癌细胞共培养中的选择性抑制作用,如图4所示。 Time (hours) Time(hours) 图4.在共培养前荧光标记细胞。将相同数量的 AU565-Nuclight green 细胞和 MDA-MB-231-Nuclight Near IR 细胞接种到96孔板中,并用谷氨酰胺酶抑制剂 CB-839(1pM)处理。之前已经证明三阴性细胞(例如MDA-MB-231)对这种化合物敏感。使用 Incucyte 活细胞分析系统中,持续四天采集相差和荧光图像。绿色和Near IR 荧光(A)的图像显示,在正常情况下,两种细胞类型均会增殖,而在CB-839情况下, Near IR 细胞明显减少。随着时间进展, AU565细胞生长受到极轻微的影响(B),而MDA-MB-231细胞增殖明显受到抑制(C)。此外还发现,与MDA-MB-231细胞相比, AU565细胞生长速率较慢。 在混合培养中有效标记细胞亚群对于识别和了解不同群体至关重要。虽然可以在混合之前分别在两个不同的细胞群中进行标记,但在某些情况下,样品本身已经是异质的,需要使用免疫细胞化学(ICC) 方法进行标记。这种技术使用了荧光标记的抗体,可以根据特定蛋白或抗原的表达来识别细胞亚群。然而,标准的 ICC通常要求对细胞进行固定,使用终点法分析,仅能得到一个时间点的单张图像,还需要将来自不同样品孔的数据进行合并,以建立时间进程图像。 不幸的是,每个样品孔间的培养成分或者细胞汇合度的微小差异都可能会引入数据误差,进而导致错误的结论。活细胞ICC可用于识别混合培养中的特定细胞群,使人们对细胞过程(如细胞生长)有更深入的了解。其可用于评价细胞之间的相互作用并研究复杂的共培养模型,例如,个特定蛋白表达水平的变化,这些可以与细胞功能和形态联系起来,为结果提供生理学背景(图5)。采用无标记分析方法测定细胞面积,并将捕获的 ICC数据与各种形态学变化联系起来。 图5.用抗体荧光探针标记混合培养物。将 PBMC 接种在96孔板上,用a-CD3Ab 和IL-2激活,并使用α-CD71-Fabfluor-488 或α-CD4-Fabfluor-488进行荧光标记。使用 Incucyte 活细胞分析系统采集图像,并使用 cell-by-cell 模块进行分析。在O小时 (A)和120小时 (B)CD71(绿色荧光强度) vs. 细胞面积的密度图。注意,120 h 后细胞面积和绿色荧光强度显著增加。细胞激活后, CD71+细胞的比例发生动态变化(C),但CD4+细胞的比例没有变化。 将多种无标记和基于荧光的成像方法结合起来,可以使用户从复杂的分析系统(例如共培养)中获得更多的信息,动态的免疫细胞和癌细胞之间的相互作用就是一个很好的例子。活细胞分析系统可以获得比以往更多的细节,产生有价值的纵向数据,,1以了解细胞之间的相互作用和过程,例如免疫细胞激活和免疫细胞杀伤肿瘤。 这些额外的数据有助于寻找治疗疾病更好、更有效的方法。将这些技术与活细胞分析方式结合对于深入监测生物学事件很有价值,例如,在很长一段时间内通过各种途径(吞噬作用和胞葬作用)清除靶细胞。67可通过相位成像和明场成像直观观察到荧光下降,从而确认结果的准确性。 靶细胞: 效应细胞: Ramos Nuclight Orange CD8-Fabfluor-488 Overlay Images shown at 48h,T:E1:3 B..1Fluorescence Protein C. Phase Label Free Count D. Subset Identification 96 联合使用无标记和荧光分析对免疫细胞杀伤进行定量分析。靶细胞 Ramos Nuclight Orange, 与用α-CD8-Fabfluor-488 标记的 PBMC 共培养。图像显示橙色靶细胞与免疫细胞共培养,其中一个亚群被标记为绿色,这意味着 CD8的表达(A)。 Ramos 细胞橙色荧光(B)随时间的定量变化显示了激活的 PBMC 对靶细胞的杀伤。通过 cell-by-cell 软件进行无标记分析,定量免疫细胞总数(C),并显示激活的免疫细胞数量增加情况。使用分类工具,还可以识别和分析绿色的 CD8+T细胞亚群,表明激活引起该群细胞随时间而增加(D)。 虽然研究细胞生长看起来是一项简单的任务,但随着试验系统中的细胞模型变得越来越复杂,并涉及多种细胞类型,测定不同亚群的生长变得越来越重要。即使在最简单的细胞系统中,由于存在不同的细胞、不同的细胞周期阶段和其他的遗传和表型,导致高度异质性。当您还考虑到细胞培养中的年龄相关的变化和细胞可塑性变化时,该系统将会变得更加复杂。活细胞分析是一个强大的解决方案,可以更快、更深入、更高通量地提供对生物学事件的新见解,从细胞凋亡、免疫细胞杀伤、神经突生长和吞噬作用,到3D肿瘤球生长和活性等各种应用场景。这为研究人员提供了实验设计新方法,用来解决之前无法解决的问题。活细胞分析监测细胞行为随着时间的变化,增加了动力学测量数据的潜力,而不再受单一时间点终点分析的影响,简化了各种应用的实验操作流程,包括细胞健康和活性、免疫学和免疫肿瘤学、细胞疗法和神经科学。可以预见,随着人工智能和机器学习能力的不断增强,未来将有可能在细胞层面实现更深入的理解。 使用活细胞分析系统,任何用户都可以动态地了解其细胞模型的健康、形态、运动和功能,并能够实时、全天候地对细胞类型特异性和时间依赖性的生物活动进行分析。这使得我们可以研究更加复杂的细胞间相互作用,并能对同一组细胞样品同时进行多重测定。这种对细胞健康和运动的持续监测,再加上其广泛的基于细胞表型的分析,使人们能够在一系列细胞类型中获得新的理解,从增殖的肿瘤细胞到免疫细胞或原代细胞,在广泛的应用中加速发现。至关重要的是, Incucyte 独特的技术结合细胞非干扰试剂,可确保细胞培养不受外界影响,并获取高质量的结果。 ( 参考文献 ) 1. Miettinen,T., Kang,J.,Yang, L. and Manalis, S., 2019. Mammalian cell growth dynamics in mitosis. eLife, 8. 2. Szemes, M., Melegh,Z., Bellamy,J.,Greenhough, A., Kollareddy, M.,Catchpoole,D. and Malik, K., 2020. A Wnt-BMP4Signaling Axis Induces MSX and NOTCH Proteins and Promotes Growth Suppression and Differentiation inNeuroblastoma. Cells,9(3), p.783. ( 3. Han, K., Pierce, S., Li, A., Spees, K., Anderson,G., Seoane, J.,Lo, Y., Dubreuil, M., O livas, M ., K amber, R., Wainberg, M., Kostyrko, K., K elly, M., Yousefi, M., Simpkins, S., Yao,D., Lee, K . , Kuo, C., Jackson, P., Sweet-Cordero, A., Kundaje, A., Gentles, A., Curtis, C., Winslow, M . and Bassik, M., 2020. CRISPR screens in cancer spheroids iden t ify 3D growth-specific vulnerabilities. Nature,580(7801), p p .136-141. ) ( 4. Velazquez, E., B rindley, T., Shrestha,G., Bitter, E ., Cress,J. , Townsend, M., Berges, B.,Robison, R., W eber,K. and O'Neil l , K., 2020. Novel monoclonal antibodies against thymidine kinase 1 and their potential use for the immunotargeting of lung, breast and colon cancer cells. Cancer Cell International,20(1). ) 5. Harkonen, K., Oikari, S., Kyykallio, H., Capra,J., Hakkola, S., Ketola, K., Thanigai Arasu, U., Daaboul,G.,Malloy, A., Oliveira, C.,Jokelainen, O.,Sironen, R., Hartikainen,J. and Rilla, K., 2019. CD44s Assembles Hyaluronan Coat on Filopodia andExtracellular Vesicles and Induces Tumorigenicity of MKN74 Gastric Carcinoma Cells. Cells, 8(3), p.276. ( 6. Randzavola, L . , Strege, K., Juzans, M., Asano, Y., Stinchcombe,J.,Gawden-Bone, C., Seaman, M., Kuijpers, T. and G riffiths, G., 2019. Loss of ARPC1B impairs cytotoxic T lymphocyte maintenance and cytolytic activity.Journal of Clinical Investigation, 129(12), pp.5600-5614. ) 7. Dennen, K., Gordon, N. and Kleinerman, E., 2020. Exosomal communication by metastatic osteosarcoma cells modulatesalveolar macrophages to an M2 tumor-promoting phenotype and inhibits tumoricidal functions. Oncolmmunology,9(1), p.1747677. 销售与服务联系方式 服务热线400 920 9889|800 820 9889邮箱 lab.cn@sartorius.com 更多联系信息,请访问 www.sartorius.com.cn 赛多利斯(上海)贸易有限公司上海市浦东新区盛荣路 388 弄百佳通产业园3号楼, 7-11层, 200120电话 +86 21 6066 6100 技木规格如有变更,恕不另行通知。赛多利斯保留最终解释权和修改权。版本06|2021 洞察细胞生长,他是真的香!Overview白皮书《采用活细胞分析系统最大限度地洞察细胞生长》展示如何利用Incucyte系统的活细胞分析能力更快、更深入、更高通量地提供对生物学事件的新见解,从细胞凋亡、免疫细胞杀伤、神经突生长和吞噬作用,到3D 肿瘤球生长和活性等各种应用场景。这为研究人员提供了实验设计新方法,用来解决之前无法解决的问题。活细胞分析监测细胞行为随着时间的变化,增加了动力学测量数据的潜力,而不再受单一时间点终点分析的影响,简化了各种应用的实验操作流程,包括细胞健康和活性、免疫学和免疫肿瘤学、细胞疗法和神经科学。Incucyte® 活细胞分析系统可以预见,随着人工智能和机器学习能力的不断增强,未来将有可能在细胞层面实现更深入的理解。使用活细胞分析系统,任何用户都可以动态地了解其细胞模型的健康、形态、运动和功能,并能够实时、全天候地对细胞类型特异性和时间依赖性的生物活动进行分析。至关重要的是,Incucyte独特的技术结合细胞非干扰试剂,可确保细胞培养不受外界影响,并获取高质量的结果。无标记分析- 相差成像该方法最适合在2D模型中对细胞生长和形态进行测量;Incucyte采用专有技术获取高清的相差图像,确保得到细胞增殖定量的可靠结果。 - 明场成像采用活细胞分析成像可直观地监测球体大小随着时间的变化,而不会破坏组织培养物,并有助于了解有丝分裂过程中细胞生物量的积累。与2D 单层模型相比,这些3D 细胞模型更能代表和预测体内条件,可提供更多体内相关性和转化性的观察结果。细胞荧光标记- 单独细胞的标记荧光标记可有力地验证之前所述的无标记技术,反之亦然,无标记技术对于确认潜在的荧光探针是否对细胞无干扰,并优化细胞培养的实验至关重要。- 混合培养物中的细胞标记活细胞ICC可用于识别混合培养中的特定细胞群,使人们对细胞过程(如细胞生长)有更深入的了解。- 复杂共培养活细胞分析系统可以获得比以往更多的细节,产生有价值的纵向数据,以了解细胞之间的相互作用和过程,例如免疫细胞激活和免疫细胞杀伤肿瘤。Download eBOOK下载《采用活细胞分析系统最大限度地洞察细胞生长》全文点击下载即刻获取数据结果抢先看无标记细胞增殖的动力学分析——将MDA-MB-231(A&B)或A549(C&D)细胞以不同密度接种在96孔板中,采集图像,并用Incucyte®活细胞分析系统对其进行分析,通过basic模块分析计算汇合度(A&B)或cell-by-cell模块分析计数细胞(C&D)。图像显示了汇合度mask(A)或cell-by-cell mask(C),曲线(B&D)显示了细胞随着时间变化的增殖情况。数据显示为4个孔的均值± SEM。3D 结构的明场成像。示例显示了MDA-MB-231 细胞形成的单球体明场图像,A549 细胞作为多球体培养物接种在Matrigel™ 上,以及嵌入在Matrigel 胶滴中的小鼠胰腺类器官。mask 以黄色显示,以用来定量细胞增殖随时间的变化。定量结果如曲线图所示。在共培养前荧光标记细胞。将相同数量的AU565-Nuclight green 细胞和MDA-MB-231-Nuclight Near IR 细胞接种到96 孔板中,并用谷氨酰胺酶抑制剂CB-839(1 μM)处理。之前已经证明三阴性细胞(例如MDA-MB-231)对这种化合物敏感。使用Incucyte 活细胞分析系统中,持续四天采集相差和荧光图像。绿色和Near IR 荧光(A)的图像显示,在正常情况下,两种细胞类型均会增殖,而在CB-839 情况下,Near IR 细胞明显减少。随着时间进展,AU565 细胞生长受到极轻微的影响(B),而MDA-MB-231 细胞增殖明显受到抑制(C)。此外还发现,与MDA-MB-231 细胞相比,AU565细胞生长速率较慢。
关闭-
1/8

-
2/8
还剩6页未读,是否继续阅读?
继续免费阅读全文产品配置单
德国赛多利斯集团为您提供《细胞中监测检测方案(高内涵成像)》,该方案主要用于其他中物理指标检测,参考标准《暂无》,《细胞中监测检测方案(高内涵成像)》用到的仪器有赛多利斯 Incucyte® SX5 活细胞分析仪。
我要纠错
推荐专场
相关方案





 咨询
咨询



