

〓疯子哥〓
第1楼2008/01/14
R0是每对供受体之间的一个常数,代表能量转移的效率为50%时的距离。R0称为Förster 临界距离,由下列公式计算:
κ2表示偶极子方向因子(范围从0-4;当供体和受体的排列是随机时κ2=2/3)
QYD表示在没有受体时供体的量子产量
n表示折射系数
J(λ)表示光谱重叠积分
J(λ)
其中: EA=受体淬灭系数 FD =总荧光强度中供体荧光强度部分
图1:FRET光谱重叠积分示意图
能量转移发生在供体受体距离在0.5-10nM之间。供受体分子之间存在电荷-电荷库仑力作用,激发态的供体对于受体的作用是偶极子-偶极子的电动力学空间作用。如果条件具备:供受体的激发谱、吸收谱相互重叠,供体的量子产量和受体的吸收系数适当、方向合适就极有可能发生能量转移。能量转移的速率和供受体的距离有函授关系(与距离达到六次方的倒数成比例)能量转移后供体回到基态、光子发射可能性减少,供体的激发态寿命减短,受体可因受激发而发出光子,尽管起初是由供体激发的,我们检测到的荧光光谱却是由受体发出的。
〓疯子哥〓
第2楼2008/01/14
我们可以从能量转移的速率和效率得到许多信息:可以知道供受体的距离很近(约0.5-10nM),得到距离的数量,有时能得到它们的方位关系。一般地每一对供受体可被分别考虑,每对都由于其特殊的距离和方位和光谱特征而表现出其能量转移的可能性,这就使我们能直接掌握分子的结构、空间构象变化和结合反应。如果我们观察的是一个分子集合,我们得到的是对应于相关参数分配的光谱信息。这种光谱参数分配能提供分子构象分配情况信息。能量转移是一个时间依赖过程,我们能够得到的有关发生在能量转移和荧光衰减时间数量级、分子运动和分子转动的动力学信息,这个数量级可以是皮秒到毫秒数量级。这是一个非常广的时间区段,可以灵活地选择生色团。在所有荧光技术中,FRET的独特性就在于此。
在多数情况下,供体与受体染料是不同的,FRET的可以通过对供体的荧光淬灭和受体的敏化荧光的产生来检测。当供体和受体是相同的染料时,可通过荧光的去极化来检测。因为R0是受环境影响的,在实际中具体的实验条件下它的值是可变化的。不产生荧光的受体比如dabcyl和QSY染料的优势在于能够减少可能由受体本身直接产生的荧光背景的干扰。对于相互作用的分子之间的FRET分析往往受到供受体荧光素各组分之间的相互影响并影响FRET的效率。比如:如果所有的供体都与一个受体结合了,供体荧光寿命就随两者距离的改变而呈一次幂变化。但在一种混合状态,有不同的供受体距离或有未结合的供体得到的是荧光寿命衰减的多次幂变化,未发生作用的分子对FRET的效率产生影响。。高的FRET效率和低的相互作用分子浓度可导致一个错误推论认为在供体受体之间有小的或没有相互作用。如果蛋白相互作用的细胞内定位空间大小超出了显微成像的分辨率,那么我们获得的是一种平均值,也会导致对生物效应的错误解释16。多光子显微技术尤其是双光子技术比共聚焦显微镜更有优势。使用近红外激发光引起探针荧光素的非线性吸收,因而激发光在聚焦镜平面的强度被限制在一个小的剂量范围内,荧光淬灭和光对样品的损伤大大减少,对于光敏感的样品的观察也成为可能。
用FLIM(fluorescence lifetime imaging microscopy)是一种较新的检测FRET的方法2。
FLIM技术有两种:时间域(time-domain)和频率域(frequency-domain)。①、时间域是短的脉冲光激发样品,荧光信号强度作为时间的函数。最新的TCSPC(time –correlated-single-proton-counting )技术与多光子激发系统的结合使得分辨率达到在组织和细胞内飞升(femto-litre)的水平。TCSPC的原理:样品被脉冲的激光重复激发,而每次脉冲激发的能量远不能引起一个光子发射。光子检测器能启动定时器,并在下一次脉冲到来时停止计时此过程反复重复,就得到了荧光衰减的直方图。TCSPC被认为比较费时间,但TCSPC以其近乎理想的计数效率和低的激发光剂量(减少荧光淬灭和毒性作用)以及高的时间分辨率而优于现有的其他方法。在计数速度为1MHZ时,获得10000个光子花20毫秒,一个128*128像素的图象在3分钟内完成,这样得到的信躁比要比那些靠牺牲分辨率来提高速度或为了缩短时间而牺牲信躁比要更优越。②、频率域原理:样品被强度调制的激发光激发,激发光的频率和样品荧光寿命的倒数成比例。这时荧光的发射频率与调制的频率一致,时间变化和解调也与激发光一致,可用来计算荧光寿命。这种技术被广泛应用在远场和共聚焦显微技术上。
生物科学的一个巨大挑战就是决定组成生物结构的分子或超分子的空间距离和分布,许多的生物现象是发生在相互作用分子的界面上,能够告诉我们有关分子相互作用的技术对我们非常重要。一旦相互分离的的目标空间排列被明确、距离和相互的方向明确了,我们就更能确信地提出生物结构是如何发挥作用的设想并证实它。对于空间关系的了解也使我们能更好地解释动态现象,知道了一部分结构的空间位置帮助我们进一步提出一些分子间相互作用的具体的问题。FRET被广泛应用的原因是它提供了分子间的距离、方向(定位)和动力学特征的信息,更好地回答有关分子距离数量级的问题。
〓疯子哥〓
第3楼2008/01/14
FRET的应用:
⑴、可用于研究蛋白质以及蛋白复合体的结构和空间构象与布局
Xing J用FRET研究了肌凝蛋白亚结构(A S1)内部的运动情况5。他们把DABMI连接于CYS374上,作为受体荧光素,再用两种不同的荧光素IAEDANS和MIANS先后标于SH1和SH2上。在紧张态的AS1中,当用MIANS作为供体荧光素时,SH1和SH2两个位点的距离大致相等(45À),而加入ADP和Vi(orthovanadate)后,CYS374和SH1的距离缩短了7-8A,而SH2与CYS374的距离未见变化。当以AEDANS作为能量供体荧光素时得到类似的结果。结论为MgADP和Vi导致了SH1向肌动蛋白的位点运动而SH2对于S1相对饱和的激动位点不敏感而不发生相对运动。
Yin Luo4等人用FRET结合几何分析手段研究了兔子骨骼肌肌钙蛋白的四级结构和IN1-INC二聚体内(TN1)上的突变CYS133相对于INC 上九个突变CYS的定位情况,分别就钙离子存在和不存在两种情况进行比较,用(1,5-IAEDANS)作为荧光供体,DAB-MAL或DDP-MAL为荧光受体通过FRET测量CLYS133和每个INC上的突变CYS残基的距离,再用数学方法处理INC晶体结构数据和FRET测量值,得到各CYC残基在IN中的定位。该结果对于揭示IN1在IN复合体中的定位以及IN的功能有很大的提示作用。
Erickson JW6等用FRET确定在转导蛋白上鸟苷酸结合位点(α-T)的赖氨酸残基与CGMP磷酸二脂酶γ亚基(γ-PDE)构象敏感位点的半胱氨酸残基(68残基)的位置关系。半胱氨酸残基(68残基)在γ-PDE的位点对于有活性或失活的α-T的结合敏感而引起构象改变。这一点被实验所证实:将α-T-GDP复合体加入被对环境敏感的探针(MIANS)标记的γ-PDE亚基能引起MIANS荧光的增强,而氟化铝使α-T-GDP激活后再结合到γ-PDE时会导致MIANS荧光的淬灭。氟化铝引起的MIANS-γ-PDE的荧光变化的时间和α-T的内部荧光的变化相一致,而这一时间也对应于α-T活性空间构象变化的时间。这些结果提示活化状态的α-T亚结构导致了临近的γ-PDE的半胱氨酸残基(68残基)结合位点的空间结构的变化。
Christoph Biskup14等用confocal和streak照相机观察了钠离子通道亚单位之间的关系。钠离子通道在可兴奋组织可形成动作电位,它由一个孔状的α亚基和β亚基组成α亚基能单独发挥功能。人心肌的钠离子通道β1亚基仅仅对α亚基有轻微影响,它帮助提高峰电位的强度以及加速从失活状态恢复。峰电位的强度的增加提示β1亚基导致了质膜上通道的密度增加,可以猜想α亚基在向质膜转运的过程是在早期已经和β1亚基结合。为了证实这个猜想,他们用了能提高FRET效率的方法:固定模式的激光、共聚焦显微镜和streak照相机。两个亚单位分别用兰色和黄色荧光蛋白标记,在人的胎肾细胞(HEK293)表达。内质网膜的通道亚基之间的FRET表明两亚单位在到达质膜之前就已经结合了。该方法能同时测量供体和受体的荧光的衰减并提供了测量FRET效率的有效方法。
〓疯子哥〓
第4楼2008/01/14
⑵、研究蛋白质的折叠
蛋白质折叠是一个非常繁杂的过程,因为它涉及到大量的途径来将无数去折叠构象连接成为唯一的天然构象。在用实验方法来探索各个途径所占比例的漫长过程中,FRET已经能够测量自由状态的单分子蛋白折叠的表面自由能特征,这些数据在分子集合是难以得到的。
受体/配体相互作用。Benjamin Schuler15等将一个绿色供体染料和一个红色受体染料连接在冷休克蛋白(CspTm)(来源于超嗜温细菌Thermotoga maritime)的氨基和羧基端的半胱氨酸残基上。选择该蛋白是因为它的高度稳定性,能够承受结构方面的干扰以及它的在分子集合实验中的热力学和动力学行为的简单性。如果一个折叠好的CspTm被激光照射,被激发的供体染料将能量快速传递给受体染料,因为它们的间隔仅仅1纳米,大部分光子由受体发出。当加入化学变性剂后蛋白去折叠,导致供体和受体的平均距离变大,能量转移变小,被受体发射的光子减少。为了使结果量化,由两种不同长度的标记相同染料的多聚脯氨酸螺旋作为控制系统,在供体和受体之间构成了固定的间隔,使染料之间的距离不因变性而变化,其他的参数和实验组的参数一样变化。通过相关参数的比较处理,得到去折叠的多肽重新形成构象的时间限度和折叠自由能障的高度限制,结果与简单的统计模型一致。如图2所示:
〓疯子哥〓
第6楼2008/01/14
图2:示意图:用荧光供体(Alexa488)和荧光受体(Alexa594)标记的蛋白和多聚脯氨酸螺旋a:折叠的CspTm ,含66个氨基酸残基(蛋白资料来自Protein Data Bank) b:去折叠的CspTm c: (Pro)6; d: (Pro)20蓝色的激发光激发绿色供体染料,后者把能量转移给红色的受体染料。在每种模式中,FRET的效率E和距离R的函数关系用兰色的曲线表示,供体和受体染料的距离的分配概率P用红色曲线表示。
⑶、免疫测定
免疫分子之间的相互作用和各种免疫现象可结合FRET加以研究,如利用抗原与抗体、补体与抗体、CD分子之间的特异结合可发挥FRET的优势,目前FRET在免疫方面的应用已有很多。Morrison LE22等用长寿命供体和短寿命受体、脉冲激光以及电子门控检测器将受体射线中来源于能量转移的部分和来源于吸收激发光的部分分开。理论方程表明提高与激发脉冲相关的积分延搁能大大加强来源于能量转移的部分。人免疫球蛋白IgG Fab'的抗体被标记上pyrenebutyrate而IgG Fab'被藻红素(B-phycoerythrin)标记,在氮激光的激发下,溶液中产生了从pyrenebutyrate到B-phycoerythrin 的FRET,受体荧光检测用0和20纳秒两种积分延搁,在三个系列的免疫测定中,当用20纳秒积分时测量时,受体荧光中来源于能量转移的部分和来源于吸收激发光的部分的比率增加了9-15倍,实验数据和理论预测基本一致。
〓疯子哥〓
第7楼2008/01/14
⑷、单分子间相互作用
如何得到单分子之间作用的信息?FRET作为一种有效的工具已经应用的这方面的研究。Ha T21等用FRET来探讨两个单分子之间的相互作用。他们用近场扫描显微镜观察单个的供体和单个的受体得到双色图象,并得到用短DNA分子连接的供体和受体荧光素的发射光谱。光裂解动力学用于研究FRET的出现和效率。经典的测算分子集合能量转移的方程改变为单分子测算。与分子集合测量不同的是单分子水平的动力学事件是可以用单对FRET来观察的,因为该结果并不为分子集团的随机平均化所消除。对于发生在纳米尺度的象旋转、位置变化或构象变化等现象可以用单对FRET来研究。
⑸、核酸的结构与空间构象
Xiaowei Zhuang19等人用FRET研究了单分子的四膜虫嗜热核酸酶的催化作用和折叠。用染料标记并且表面固定的核酸酶在功能上和未加以修饰的核酸酶没有区别。能够观察到从酶中心开始的双链docks 和 undocks的可逆折叠过程的单分子时间轨迹,并能确定折叠速度常数和转变态的特征。很难在分子集合出现和在分子集合水平衡量的docked态的全部折叠过程、中间折叠态以及折叠的多条途径都被观察到了,除此之外又发现了一种折叠常数为1/秒的新的折叠途径
TomaszHeyduk Eua Heyduk12 用FRET检测序列特异的DNA结合蛋白的活性。两个DNA片段各构成大约一半蛋白结合位点的DNA链,分别用供体荧光素和受体荧光素标记。两片段有短的互补区可供退火连接。互补区的长度和片段的浓度都保持在一定水平使自发的退火连接非常少,在没有蛋白出现时无能量转移的发生。当结合蛋白出现时,它对于全段的DNA的高亲和力将促使两片段连接,特异蛋白—DNA复合物出现,供体和受体荧光素因而靠近发生高效的FRET信号。如图3所示:
图3: A 、DNA特异结合蛋白与DNA序列设计示意图 B、蛋白结合位点的几种可能的拼接方式(小方框和小圆圈分别表示荧光的供体和受体)
〓疯子哥〓
第8楼2008/01/14
FRET已经被用于研究一系列荧光标记的结合到大肠杆菌DNA聚合酶1 Klenow 片段的DNA和引物的单链构象20。DNA片段被tetramethylrhodamine (TMR)所修饰作为FRET的受体,荧光供体由双突变KF得到,。模板引物的设计允许探针在蛋白和DNA复合体的位置随着引物链的扩展(加入脱氧三磷酸核苷酸引起)而变化。TMR受体探针占据了模板引物的七个位置(五个在单链区,两个在双链区)。每个位置的FRET效率由受体出现和消失的荧光发射峰的积分计算得到。结果表明FRET效率呈正弦变化,其周期为大约10个碱基对,这和用简单的螺旋结构模型得出的方程相符合。该数据支持DNA模板引物的单链部分在结合到KF后就变成螺旋构型的结论。
⑹细胞内离子浓度及动力学特征描述:
Alsushi Miyawakl 7 等用荧光素指示钙离子在细胞内的分布情况。他们把突变的兰色GFP、钙调蛋白、钙调蛋白的结合蛋白M13和增强的GFP串联融合,并称之为cameleons。钙离子的结合可以使钙调蛋白掩盖M13的模序而增强了位于两侧的GFP之间的FRET。突变的钙调蛋白可调节对钙离子的亲和力,从而能测量自由钙离子的浓度变化(10-8-10-2M)。在用携带适当定位信号的CDNA转染的HELA细胞内,钙离子在胞质、胞核、内质网内的动力学特征也可描述:内质网内的钙离子浓度在安静下是60-400M,而当钙动员时为1-50M。FRET还是蓝GFP标记的钙调蛋白和黄GFP标记的M13之间可逆作用的指示器。所以在GFP突变体之间的FRET可以检测单个活细胞内钙离子的定位以及异源蛋白二聚化的情况。
如图4所示:
图4:cameleons的结构示意图,说明了GFPs 之间的FRET是怎么测量Ca2+的,其中GFPs用用灰色的圆柱体表示
〓疯子哥〓
第9楼2008/01/14
用FRET研究钙离子在细胞内的分布的方法最近有新的进展:如用串联融合的兰色荧光蛋白(CFP)、CaM、肌凝蛋白轻链激酶的CaM结合肽(MLCKp)和黄色荧光蛋白(YFP)。当增加溶液中的自由钙离子浓度时,CaM结合钙离子而将 MLCKp包掩,这种空间结构变化导致了两个突变的GFP的距离接近而增强了FRET。钙离子的信号作用的开始和结束可以在细胞的内质网等特殊结构观察到。这种方法又有人加以改进进一步提高了荧光发射动力学范围(定义为最大发射速率/最小发射速率)。Kevin Truong 8等人构建了另一种钙离子指示器:YC6.1。将ckkp(CaM-dependent kinase kinase)融合于CaM的N端与C端之间起到代替CaM linker的作用。Ckkp含有一个α螺旋和发卡样Loop结构,使得与CaM的作用更加紧密。该融合体的结构为:CFP-CaM的N端片段(N-CaM)-Gly-Gly—Ckkp--Gly-Gly- CaM的C端片段YFP,使得CaM的N端C端的距离减小为40À以下,使FRET的效率显著增加。
〓疯子哥〓
第10楼2008/01/14
如图5所示: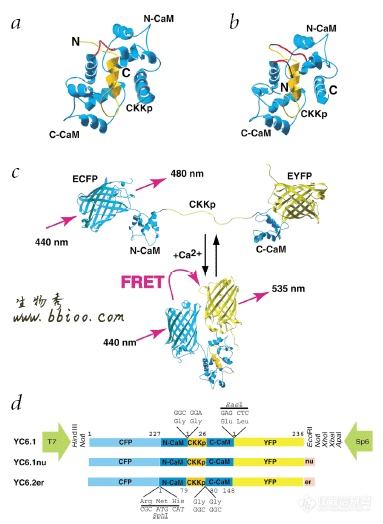
图5: YC6.1的结构示意图:a该图表示CaM(兰色)和Ckkp(橙色)结合,CaM的linker域(红色)和Ckkp的N-末端和C-末端靠近。CaM的linker域(氨基酸残基75-82)连接CaM Ca2+结合域的N-末端(N-CaM)和C-末端(C-CaM)。b Ckkp通过两个甘氨酸linker(黑色)被插入到CaM残基79和80之间,两个原来的CaM的linker(75-79)和(80-82)(红色)仍然保留在融合结构中,形成(N-CaM)-GG-Ckkp-GG-(C-CaM)融合蛋白。c 用卡通的形式表示了YC6.1的结构如何从未结合Ca2+状态变化为结合Ca2+状态的,在后一种状态两个GFP突变体的距离接近而发生了FRET。d 表示了YC6.1的基因结构。