

︶ㄣ青蟲CC
第1楼2008/11/24
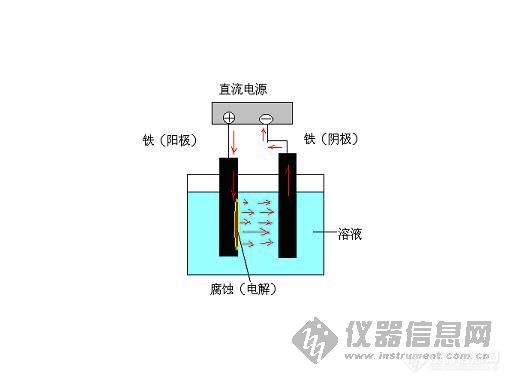
12.实际中有钢铁发生“电解腐蚀”的实例吗?
以钢铁为材料的基础设施(钢结构、混凝土中钢筋、地下管线等) ,不仅可能发生电解
腐蚀,而且有时是大范围、严重性的问题。典型的是城市有轨电车、地铁所发生的类似腐蚀。采用直流电源驱动的地列车, 其轨道是电流回路。 当轨道与大地绝缘不足或局部绝缘失效时,就会有电流流入大地(通常叫做“漏散电流”或“杂散电流” ) 。图 12-1 是“漏散电流”或“杂散电流”腐蚀的示意图。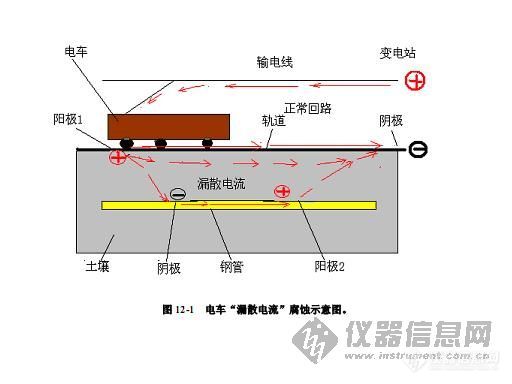
由 图 12-1 可以看出, 由变电站所提供给车辆的直流电流, 正常情况下是通过导线 (轨)和铁轨完成回路的(正常回路) 。当有电流漏入地下时,若附近没有更便捷的路径,部分漏散电流流经土壤又进入电位较负的铁轨、最终回到电源负极。这样,在铁轨漏电的部位就成为阳极(阳极 1)而遭受电解腐蚀(该部位与电位较负的部位构成电解电池) ;当附近有更便捷的路径时(如有一根与轨道平行的钢管) ,那么,漏散电流可进入钢管,并沿钢管行进,在适当部位由流经土壤又进入电位较负的铁轨、最终回到电源负极。这样,在电流流出钢管的部位(阳极 2)便遭受电解腐蚀(该部位与铁轨电位较负的部位构成电解电池) 。 与图 12-1 所示典型的“电解电池”作比较,可以看出,漏散电流所造成的“电解电池” ,表面看来似乎有别于典型的“电解电池” ,但实质是一样的,即凡是电流由金属流出到介质中的部位(这里发生金属失去电子变为离子)作为阳极而腐蚀,而电流由介质流入金属的部位便是“电解电池”的阴极。这是判别“电解电池”腐蚀和漏散电流腐蚀的简易而重要原则。 除有轨电车、地铁以外,直流电气火车、直流输电系统,工业直流电解系统、直流电焊系统等,都可能对基础设施、建筑物、管道、电缆等造成漏散电流腐蚀危害。
13.腐蚀发生在阳极,而阴极是不腐蚀的,如果能够把想保护的金属变为阴极,不就可以达到使其不腐蚀的目的了吗?
这真是一个绝妙的想法,一语道破了“阴极保护”的基本原理。所谓“阴极保护” ,就
是使将整个被保护对象成为阴极(另外附设一个阳极) 。正因为阴极是不腐蚀的,所以能够实现“保护”的目的。对于钢铁而言, “阴极保护”是最重要、最普遍应用的防护技术之一