

工农兵
第1楼2009/10/23
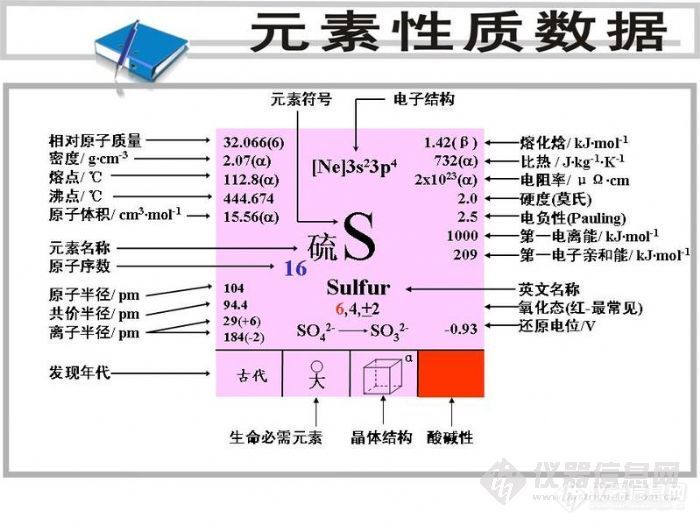
元素类型:非金属
发现过程:古代人类已认识了天然硫。硫分布较广。
单质物理性质:
通常为淡黄色晶体,它的元素名来源于拉丁文,原意是鲜黄色。单质硫有几种同素异形体,菱形硫(斜方硫)和单斜硫[1]是现在已知最重要的晶状硫。它们都是由S8环状分子组成。
密度 熔点 沸点 存在条件
菱形硫(S8) 2.07克/立方厘米 112.8℃ 444.674℃ 200℃以下
单斜硫(S8) 1.96克/厘米3 119.0℃ 444.6℃ 200℃以上
硫单质导热性和导电性都差。性松脆,不溶于水,易溶于二硫化碳(弹性硫只能部分溶解)。无定形硫主要有弹性硫,是由熔态硫迅速倾倒在冰水中所得。不稳定,可转变为晶状硫(正交硫),正交硫是室温下唯一稳定的硫的存在形式。
化学性质:
化合价为-2、+2、+4和+6。第一电离能10.360电子伏特。化学性质比较活泼,能与氧、金属、氢气、卤素(除碘外)及已知的大多数元素化合。还可以与强氧化性的酸、盐、氧化物,浓的强碱溶液反应。它存在正氧化态,也存在负氧化态,可形成离子化合物、共价化合成物和配位共价化合物。
生理作用:
半胱氨酸、蛋氨酸、同型半胱氨酸和牛磺酸等氨基酸和一些常见的酶含硫,因此硫是所有细胞中必不可少的一种元素。在蛋白质中,多肽之间的二硫键是蛋白质构造中的重要组成部分。有些细菌在一些类似光合作用的过程中使用硫化氢作为电子提供物(一般植物使用水来做这个作用)。植物以硫酸盐的形式吸收硫。无机的硫是铁硫蛋白的一个组成部分。在细胞色素氧化酶中,硫是一个关键的组成部分。
工业和发电厂燃烧煤释放出来的大量二氧化硫在空气中与水和氧结合形成硫酸,它造成酸雨降低水和土壤的pH值,对许多地区的自然环境造成巨大破坏。
元素来源: 重要的硫化物是黄铁矿,其次是有色金属元素(Cu、Pb、Zn等)的硫化物矿。天然的硫酸盐中以石膏CaSO4·2H2O和芒硝Na2SO4·10H2O为最丰富。可从它的天然矿石或化合物中制取。火山口处存在大量硫磺。
元素用途:
硫在工业中很重要,比如作为电池中或溶液中的硫酸。硫被用来制造火药。硫也是生产橡胶制品的重要原料。硫还被用来杀真菌,用做化肥。硫化物在造纸业中用来漂白。硫还可用于制造黑色火药、焰火、火柴等。硫代硫酸钠和硫代硫酸氨在照相中做定影剂。硫又是制造某些农药(如石灰硫黄合剂)的原料。硫酸镁可用做润滑剂,被加在肥皂中和轻柔磨砂膏中,也可以用做肥料。
医疗上,硫还可用来制硫黄软膏医治某些皮肤病,等等
工农兵
第2楼2009/10/23
元素辅助资料:
硫在自然界中存在有单质状态,每一次火山爆发都会把大量地下的硫带到地面。硫还和多种金属形成硫化物和各种硫酸盐,广泛存在于自然界中。
单质硫具有鲜明的橙黄色,燃烧时形成强烈有刺激性的气味。金属硫化物在燃烧时产生的气味可以断言,硫在远古时代就被人们发现并使用了。
在西方,古代人们认为硫燃烧时所形成的浓烟和强烈的气味能驱除魔鬼。在古罗马博物学家普林尼的著作中写到:硫用来清扫住屋,因为很多人认为,硫燃烧所形成的气味能够消除一切妖魔和所有邪恶的势力,大约4000年前,埃及人已经用硫燃烧所形成的二氧化硫漂白布匹。在古罗马著名诗人荷马的著作里也讲到硫燃烧有消毒和漂白作用。
中西方炼金术士都很重视硫,他们把硫看作是可燃性的化身,认为它是组成一切物体的要素之一。我国炼丹家们用硫、硝石的混合物制成黑色火药。
不论在西方还是我国,古医药学家都把硫用于医药中,我国著名医生李时珍编著的《本草纲目》中,将到硫在医药中的运用:治腰肾久冷,除冷风顽痹寒热,生用治疥廯。
硫磺的广泛应用促进了硫磺的提取和精炼,随着工业的发展,硫在制取硫酸中起着关键作用,而硫酸就是工业之母,无处不需要它。1894年出生在德国的美国工业化学家弗拉施创造用过热水的方法,将硫从地下深处直接提取出来。
世界上每年消耗大量的硫,其中一部分用于制造硫酸,另一部分用于橡胶制品、纸张、硫酸盐、硫化物等的生产,还有一部分硫用于农业和漂染、医药等。
1789年法国化学家拉瓦锡发表近代第一张元素表,把硫列入表中,确定硫的不可分割性。18世纪后半页,德国化学家米切里希和法国化学家波美等人发现硫具有不同的晶形,提出硫的同素异形体。
硫在地壳中的含量为0.048%
工农兵
第3楼2009/10/23
硫的化学性质
1.氧化性
与金属单质反应:铜→硫化亚铜;铁→硫化亚铁;铝,钠等金属
往往将其氧化为较底价态
特性:银与硫摩擦生成硫化银;汞与硫研磨生成硫化汞
与非金属反应:2S+C→CS2;S+H2→H2S
与其他的还原剂:S+Na2SO3→Na2SO3S(Na2S2O3)(学名;硫代硫酸钠)
2.还原性:S+O2→SO2
3.既氧化又还原:
3S+6KOH加热→2K2S+K2SO3+2H2O (歧化反应)
常用方程式
3S + 6OH = 2S+ SO3 + 3H2O 条件:加热
S+ H2O= HS+ OH 水解反应
3S + 2Al + 6H2O == 2Al(OH)3↓ + 3H2S↑
S + 2Fe== 2Fe + S↓
SO2 + Ca+ 2ClO + H2O == CaSO4↓ + HClO + H+ Cl (少量SO2)
2SO2+ Ca+ 2ClO + 4H2O ==CaSO4↓ + 2Cl+ 4H+ SO4 (足量SO2)
SO2+ 2Fe3+2H2O==2Fe+SO4+4H
SO2 + 2HCO3== SO3+ CO2↑ + H2O
SO2 + 2OH= SO3+ H2O
SO2 + OH = HSO3
SO2 + Br2 + 2H2O == 2Br+ 2H + SO4
SO2 + I2 + 2H2O == 2I + 2H + SO4
SO2 + H2O2== 2H + SO4
3SO2+ 2NO3 + 2H2O == 3SO4 + 2NO↑ + 4H
SO2+ ClO + H2O == 2H + Cl+ SO4
SO2+ 2H2S == 3S↓ + 2H2O
SO2+ H2O== H2SO3
5SO2 + 2MnO4 + 2H2O == 2Mn+ 5SO4+ 4H
SO3 + 2H== SO2↑+ H2O
SO3 + H2O ==HSO3 + OH
SO4 + Ba== BaSO4↓
SO4 + 2H+ Ba + 2OH== BaSO4↓+ 2H2O( NaHSO4溶液中加Ba(OH)2,使溶液呈中性)
SO4 + H+ Ba+ OH== BaSO4↓+ H2O (NaHSO4溶液中加Ba(OH)2,使Ba全部沉淀)
S2O3 + 2H== S↓ + SO2↑ + H2O
工农兵
第4楼2009/10/23
硫在氧气里燃烧的现象:剧烈燃烧,发出热量,发出明亮的蓝紫色火焰,生成有刺激性气味的气体
硫与氧气燃烧会生成二氧化硫。
化合物
许多有机物难闻的味道来自於它们所含有硫化氢之类的化合物。这些化合物有一股特别的臭鸡蛋味道。硫化氢的溶液是酸性的,与金属反应形成金属的硫化物。铁的硫化物在大自然中很常见,被称为黄铁矿。有趣的是黄铁矿有半导体的特性。方铅矿是硫化铅,也是第一种被发现的半导体。
聚合的氮化硫有金属特性,尽管它不含任何金属,这个复合物还显示特别的电学和光学特性。让熔化的硫速凝可以获得无晶态的硫,伦琴绕射显示其中含有由八个硫原子组成的环。这种硫在室温下不十分稳定,它渐渐恢复为晶体状态。
其它重要的硫的化合物有:
连二亚硫酸钠:Na2S2O4,是一种强有力的还原剂
亚硫酸:H2SO3,是二氧化硫在水中的溶液。亚硫酸和亚硫酸盐是有力的还原剂。二氧化硫的其它产物包括焦亚硫酸离子(S2O5)
硫代硫酸物:S2O3,是氧化物。硫代硫酸氨有可能可以代替氰化物来洗金
过硫酸:H2S2O8,
连二硫酸是H2S2O6,及其盐
连多硫酸:H2SnO6,n可以从3一直到80
硫酸盐:是硫酸的盐
硫化物:是硫与其它元素的化合物
过氧甲酸是三氧化硫与浓的过氧化氢的反应物
硫氰酸盐是硫氰离子(SCN)的化合物
硫氰碳化合物:(SCN)2
二硫化碳
同素异形体
斜方硫(菱形硫): Dolomite Rhombic sulfur
化学式:S8
是硫由二氧化碳结晶而得之紧密的黄色晶体,融点112.8度。
单斜硫:Monoclinic sulphur
化学式:S8
融化硫於部份凝固後,倒出多馀液体,剩下无数之针形晶体即为单斜硫,融点119.2度
弹性硫: Plastic sulphur
化学式:S8
为沸腾之硫注入冷水所得之软黏体,有弹性
工农兵
第5楼2009/10/23
同位素
硫有18种同位素,其中四种是稳定的:S-32(95.02%)、S-33(0.75%)、S-34(4.21%)和S-36(0.02%),除35S外,其它放射性同位素的半衰期都很短。硫-35由宇宙射线射击空气中的氩-40而导致,其半衰期为87天。
硫化物沉淀时根据温度的不同S-34的含量少许不同。假如在一个矿物中硫化物和碳酸盐同时存在的话,那麼根据碳-13和硫-34的含量可以推算出矿物形成时矿水的pH值和氧的逸度。
在森林生态系统中,硫酸盐主要来自空气,少量来自矿物的风化。其中硫的同位素的不同含量可用来确定它们的来历
注意
在接触二硫化碳、硫化氢和二氧化硫时要非常小心。
二氧化硫可以在肺中与水结合成亚硫酸,亚硫酸可以导致肺出血和窒息。
硫化氢毒性非常高,甚至高于氰化物。虽然硫化氢的味道一开始非常强烈,但人的嗅觉很快就被它压抑了。因此受害人有可能未察觉它的存在。