

老好人
第1楼2009/10/26
2 材料
主要仪器及设备
LRH-250-Z型振荡培养箱(广东医疗器械厂)
HH-B11电热恒温培养箱 (上海跃进医疗器械厂)
FA1004A电子天平(上海天平仪器厂)
台式高速冷冻离心机(德国Eppendorf公司)
立式高速冷冻离心机(日本三洋公司)
KS-600型超声波细胞破碎仪(宁波经济技术开发区科生仪器厂)
78HW-I型恒温磁力搅拌器(杭州仪表电机厂)
PHS-3C型pH计(上海雷磁仪器厂)
752型紫外可见分光光度计(上海第三分析仪器厂)
DYY-2C型电泳仪(北京六一仪器厂)
SP Sepharose Fast Flow离子交换层析(美国Amersham Biosciench 公司)
GDS-8000凝胶成像系统(法国Vilber Lourmat 公司)
DL-CJ-IND超净工作台(北京市东联哈尔仪器制造有限公司)
-80℃低温冰箱(丹麦HETO BIOTECH公司)
5L发酵罐(浙江东方生物工程设备技术公司)
TH-梯度混合仪(上海精科实业有限公司)
HL-200B恒流泵(上海精科实业有限公司)
BSZ-160F电脑自动部份收集器(上海精科实业有限公司)
AP-01P无油隔膜真空泵(天津奥特赛恩斯仪器有限公司)
300ml超滤杯(上海摩速科学器材有限公司)
2.4 主要溶液
(1)PBS缓冲液
(2)包涵体洗涤液
(3)包涵体溶解液
(4)复性液I
(5)复性液II
(6)复性液III
(7)复性液Ⅳ
(8)复性液Ⅴ
(9)染色液:
(10)脱色液
(11)6×非还原性上SDS-PAGE样缓冲液
(12)5×还原性SDS-PAGE蛋白电泳样品缓冲液
(13)49.5%丙烯酰胺
(14)16.5% 分离胶(15 ml)
(15)4% 浓缩胶(6 ml)
(16)Gel Buffer
(17)电极缓冲液
(18)Bradford储存液
(19)Bradford工作液
(20)LB培养基
老好人
第2楼2009/10/26
3 方法
3.1诱导表达
3.2 重组蛋白的分离纯化
3.2.1 诱导表达菌体的破碎
培养液经诱导表达后,离心收集菌体,用超声buffer重悬,磁力搅拌20 min,使菌体分散均匀。冰浴中超声破菌(3秒/次,间隔9秒),使用Bradford法测蛋白浓度,直至浓度不再增加。
3.2.2 包涵体的分离、洗涤和制备
超声破碎的菌液,将悬浊液离心弃上清,沉淀即为包涵体,用PBS缓冲液洗涤沉淀后再使用包涵体洗涤液洗涤三次,洗涤过程在冰浴中充分搅拌,将悬浊液在离弃上清,所得沉淀即为制备好的包涵体,分析包涵体纯度。
3.2.3 包涵体的溶解
包涵体溶解于包涵体溶解液,称重沉淀,用变性剂缓冲液溶解沉淀,冰浴中搅拌离心,收集上清。电泳检测。
3.2.4 重组蛋白的复性
3.2.4.1采用尿素梯度透析复性法对包涵体复性
采用尿素梯度透析复性法对包涵体复性,将上述上清液加入透析袋,调整蛋白质浓度透析后。分别收集上清和沉淀,进行电泳分析。
3.2.4.2采用稀释复性法对包涵体复性
稀释复性进行电泳分析。
3.2.5 SP Sepharose F.F 阳离子交换层析分离纯化重组蛋白
采用离子交换层析法,将复性后的样品用超滤浓缩后,离心将上清进行层析,上样于SP-Sepharose Fast Flow凝胶过滤层析柱,分别进行分步洗脱。并收集样品进行电泳分析。
3.3重组蛋白透析
收集含有目的蛋白浓度,纯度均较高的样品超滤。并收集样品进行电泳分析。
3.4重组蛋白冷冻干燥保存
将透析后的样品进行冷冻干燥成为粉状进行保存。
3.5 纯化产物的鉴定
使用Bradford法测纯化产物的总蛋白浓度。目的蛋白浓度=产物的总蛋白浓度×产物的纯度。并计算目的蛋白回收率。
老好人
第3楼2009/10/26
4. 结果
4.1包涵体的洗涤和溶解
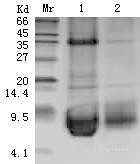
包涵体经洗涤后溶解于包涵体溶解液,离心收集上清,经电泳检测可知,通过洗涤包涵体可以除去一些杂蛋白,包涵体纯度得到一定的提高。 (如图 1)

老好人
第5楼2009/10/26
5讨论
本实验在基因克隆表达包涵体的基础上进一步分离纯化目的蛋白,将基因工程菌发酵液经离心浓缩后,可用机械研磨、超声波处理法使细菌裂解,然后离心收集沉淀即为包含体。为了除去包含体上粘附的杂质,如膜蛋白或核酸,应用洗涤液洗涤包含体,实验结果表明包涵体不纯净时对复性蛋白产生重要影响,因此在复性前洗涤包涵体是十分必要的。
5.1 重组蛋白质的复性
包涵体的复性一直是影响蛋白质生物活性收率的关键点,为了得到具有天然构象的蛋白质和产生正确配对的二硫键,必须去掉过量的变性剂和还原剂,使多肽链处于一个氧化性的缓冲液中。这可通过稀释法把变性溶解的蛋白质直接加入到复性液中,也可通过透析或凝胶过滤法完全去掉变性剂和还原剂。
5. 1.2蛋白质浓度的影响
正确折叠的蛋白质的得率低通常是由于多肽链之间的聚集作用。蛋白质的浓度是促使蛋白质聚集的主要因素。折叠中间体在高浓度下产生的聚集通常是由于它们表面上暴露的疏水基团的相互作用而产生。折叠过程与蛋白质的浓度无关 。本实验复性液的蛋白获得较好的复性效果,复性后蛋白稳定性较高。
5.1.3 pH 和温度的影响
复性液的pH 值必须在7.0 以上,这样就可以防止自由硫醇的质子化作用影响正确配对的二硫键的形成,最适宜的复性pH 值一般是8. 0~9. 0。不同的蛋白质复性有其最适宜的复性温度。
5.2重组蛋白的分离纯化
对所得蛋白样品进行紫外光谱扫描,实验结果表明,经过离子交换可以有效地去除杂蛋白,而且离子交换层析可以处理大量的蛋白样品,适合于规模生产纯化。但是将层析后样品分别收集后超滤透析处理后电泳检测表明发现仍有杂蛋白的存在,可能为离子交换层析条件仍然不完善,需要进一步实验摸索其最佳条件,如对离子交换层析的洗脱梯度及pH强度等因素设定需要摸索得到最佳条件。
5.3蛋白的保存
本实验目的蛋白在不同的温度生物活性变化不同,本实验通过透析方法除去蛋白溶液的盐离子从而达到最终纯化效果后,分装进行冷冻干燥保存。
这就是我的一些实验积累和心得~希望大家多多来支持哦~~
beileilei
第11楼2009/11/30
写的不错,受益匪浅,不过有几个问题有些迷惑
1、你既然是用6M盐酸胍溶的包涵体,透析复性时为何要用尿素梯度稀释复性而不用盐酸胍梯度稀释复性呢?你的尿素浓度改变的确实很慢,但是你突然改变盐酸胍的浓度,蛋白难道不会沉淀吗?
2、你采用的稀释复性法是将复性液一下加入到包涵体溶解液里,这点我不太认同,我觉得应该反过来,应将包涵体溶解液分次(一次5~10ml)分时(每隔2~4h)加入到复性液里,这样可以避免折叠中间体与变性蛋白的结合与聚集。
3、最后请教你一下,我手头有一个蛋白55kD左右,pI8.5,带有His-Tag,如果采用稀释复性的话复性液pH值调到多少合适?你说要>7.0,但是离8.5太近又会导致蛋白沉淀。