05.rar
05.rar平凡人
第1楼2009/12/03
5.1 滴定分析中化学平衡
四大平衡体系: 四种滴定分析法:
酸碱平衡 酸碱滴定法
配位平衡 配位滴定法
氧化还原平衡 氧化还原滴定法
沉淀平衡 沉淀滴定法
1 酸碱平衡(双箭头号打不出,以等号取代了)
酸 = 共轭碱 + 质子
HF = F - + H+
H2PO4- = HPO42- + H+
H6Y2+ = H5Y+ + H+
NH4+ = NH3 + H+
通式: HA = A + H+
酸碱半反应
例: HF在水中的离解反应
半反应: HF = F- + H+
半反应: H+ + H2O = H3O+
总反应: HF + H2O = F- + H3O+
简写: HF = F- + H+
酸碱反应的实质是质子转移
2 酸碱反应类型及平衡常数
一元弱酸(碱)的解离反应
平凡人
第6楼2009/12/04
4 质子条件式
物料平衡 (Material (Mass) Balance):
各物种的平衡浓度之和等于其分析浓度。
电荷平衡 (Charge Balance):
溶液中正离子所带正电荷的总数等于负离子所带负电荷的总数(电中性原则)。
质子平衡 (Proton Balance):
溶液中酸失去质子数目等于碱得到质子数目。
物料平衡
各物种的平衡浓度之和等于其分析浓度。
质量平衡方程(MBE)
例:2X10-3 mol/L ZnCl2 和 0.2 mol/L NH3
[Cl-] = 4X10-3 mol/L
[Zn2+] +[Zn(NH3) 2+] +[Zn(NH3)22+] +[Zn(NH3)32+] +[Zn(NH3)42+] = 2X10-3 mol/L
[NH3] +[Zn(NH3) 2+] +2[Zn(NH3)22+] +3[Zn(NH3)32+] +4[Zn(NH3)42+] = 0.2 mol/L
电荷平衡
溶液中正离子所带正电荷的总数等于负离子所带负电荷的总数(电中性原则)。
电荷平衡方程(CBE)
Na2C2O4水溶液
[Na+] + [H+] = [OH-] + [HC2O4-] + 2[C2O42-]
质子平衡
溶液中酸失去质子数目等于碱得到质子数目。
质子条件式(PBE)
(1) 先选零水准 (大量存在,参与质子转移的物质), 一般选取投料组分及H2O
(2) 将零水准得质子产物写在等式一边,失质子产物写在等式另一边
(3) 浓度项前乘上得失质子数
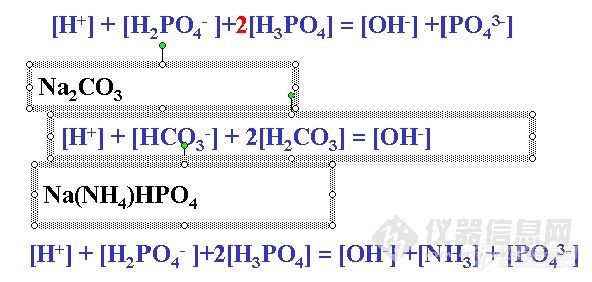
例:Na2HPO4水溶液
零水准:H2O、HPO42-