

Cyclotron
第1楼2010/06/18
18F-FDG的质量指标
18F-FDG是载于美国药典的第一个PET放射性药物,这里按照美国药典制订的关于18F-FDG的质量要求,对18F-FDG的质量指标进行简要介绍。
① 放射性核纯度
核杂质来源:对于不同的18F生产方法,可能产生不同的杂质同位素。以20Ne(d,α)18F反应生产的18F-F2的质量较高,可能的杂质同位素是寿命很短的钠和氖,在加工过程中会逐渐衰变,并在合成期间消失。
以18O-H2O为靶材料,通过18O(p,n)18F反应生产18F-F-,其放射性核纯度需要严格的控制,因18F-F-的质量不仅决定最终产品的核纯度,而且还影响亲核取代的反应性。随着18O-H2O的丰度下降,通过16O(p,α)13N反应生成13N的量增加。另外,来自靶窗箔膜和因箔膜材料改变产生的阳离子型放射性核素杂质也是较有影响的因素[28]。因此,建议用阴离子交换柱来固定吸附18F-F-。
核纯度的测定:有两种方法可以进行核纯度的鉴定。其一是利用锗半导体多道γ谱仪测量法进行测定,其γ谱出现一个0.511MeV的主光电峰。在检测中,可能出现一个1.022MeV的总峰,这取决于源的几何条件和探测器效率。其二是半衰期测定法,即取一定剂量的18F-FDG溶液,测定其放射性活度,并记录测量时间,然后以一定的时间间隔进行连续测定5个半衰期内18F-FDG溶液的放射性活度,以时间为横坐标,放射性活度的对数为纵坐标作图,得到斜率k<0的直线,由此直线上的任何两点可计算得半衰期,并求得在t=0时的总放射性活度,与原始总放射性活度相比,从而求得18F的核纯度。18F的核纯度大于99.8%。
Cyclotron
第2楼2010/06/18
化学纯度
除了合成前体三氟甘露糖(Mannose triflate)和3.4.6-三乙酰-D-葡萄糖醛(TAG)的纯度影响最终18F-FDG的化学纯度外,合成方法和反应条件也显著影响18F-FDG的化学纯度。因此在市场购买前体时,尽量选用色谱级试剂。
在氨基聚醚Kryptofix 2.2.2(Kry2.2.2)催化法中,必须在最终产品中控制有机溶剂和Kry2.2.2的含量。利用AG50树脂可以除去Kry2.2.2。元素分析、质谱和色谱已用于测定极微水平的Kry2.2.2。硅胶板-TLC法是目前分析Kry2.2.2最实用的方法,最低检出限量为0.025mg/ml,展开剂为甲醇-30%氨水(9:1 V/V)或0.1%三乙胺甲醇溶液,用碘显色,并与50μg/mL标准Kry2.2.2的层析斑点比较,要求2-18F-FDG注射液所呈现斑点的大小及明暗度不能超过标准溶液。
在亲核或亲电取代法中会产生2-18F-FDG的差向异构体2-[18F]氟-2-脱氧-D-甘露糖(18F-FDM)(图)。特别以亲电取代法产生2-18F-FDG时,所选择的底物、亲电氟化试剂、反应溶剂对2-18F-FDG和2-18F-FDM的构成比例有很大的影响。 表列举了以TAG为底物进行2-18F-FDG生产时亲电氟化试剂和反应溶剂对2-18F-FDG和2-18F-FDM的构成比例的影响。
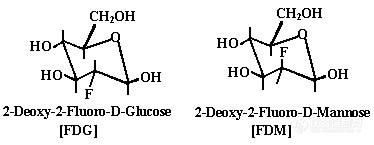
2-18F-FDG和2-18F-FDM的结构
表 亲电氟化试剂和反应溶剂对2-18F-FDG和2-18F-FDM的构成比例的影响
Cyclotron
第3楼2010/06/18
放射化学纯度
除含有2-18F-FDG外,可以通过放射分析方法来鉴定未反应的[18F]氟化物、部分乙酰化的[18F]氟-脱氧葡萄糖衍生物或[18F]氟标记化合物。要求2-18F-FDG的放射化学纯度大于95%。
放射性-HPLC法:该法是快速而准确的方法,容易对放射性杂质进行有效的分离并进行定量测定。测定时同样以85%乙腈水溶液为流动相,流速为1ml/min,层析柱为反相氨基柱,用放射性探测器进行检测,要求放射化学纯度大于95%。但使用反相氨基柱,由于拖尾效应,2-18F-FDG与[18F]氟化物的分离不理想。因此,在乙腈水溶液洗脱的反相氨基柱法中,为了起排代作用,在洗脱液中加入一定量的NaF,才能有效地将[18F]氟化物分离并从该柱上洗脱下来。另外,也可用Dionex PA100阴离子交换柱,用0.1mol/L NaOH作为洗脱剂,该法能使[18F]氟化物、葡萄糖、2-18F-FDG以及部分水解的糖实现分离。
TLC法:取适量注射液和标准2-19F-FDG溶液分别点于硅胶薄层层析板上,用95%乙腈水溶液为展开剂进行展开,直到溶剂移到层析板长度的约3/4处,取出并干燥,然后用适当的放射性测定法测定放射性分布。或在已展开的层析板上喷2N H2SO4溶液并在110℃下显色10min,以确定FDG的Rf值。其2-18F-FDG的Rf值应与标准2-19F-FDG的Rf值一致,约为0.4。
Cyclotron
第4楼2010/06/18
比活度
比活度(Specific activity)可以通过合成时引入合成系统的氟化物的量来确定。用不加载体的18F-F-的亲核取代法进行18F-FDG合成时,比活度能达到270Ci/μmol。在亲电取代合成的情况下,靶气体中的载体氟将会限制比活度,而此时比活度是靶气体中氟的浓度、靶体积和靶气体压力的函数。载体量依靶设计参数而定,通常可能在0.01~0.02mmol之间变化,在这样的条件下,可能得到的比活度在20~400GBq/mmol(0.54~8Ci/mmol)之间变化,这时18F-FDG所含葡萄糖量在100~300μmol范围。虽然18F-FDG-PET显像对其比活度的要求并不严格,但在质量报告中应列出比活度值,也可用放射性浓度(MBq/ml)代替。
Cyclotron
第5楼2010/06/18
物理与生物学指标
对于正电子显像剂的细菌学、内毒素、pH值、等渗性和稳定性等物理与生物学指标也有严格控制的质量参数。这些质量参数的保证主要在于按适当的生产工艺流程操作,并保证产品符合药典的要求。
一般性状:本品应为无色或淡黄色澄明溶液。
细菌学检查:由于大多数正电子放射性药物半衰期短,许多药物对热不稳定,因此,灭菌过程是通过0.22μm无菌过滤器来实现的,并收集在无菌的带盖玻璃小瓶中。生产系统在生产用于人体的放射性药物前,其灭菌的有效性必须通过合格职业人员采用合格流程独立的予以证实,并且必须至少有三次证明是生产无菌无热原产品的。依其放射和生产特性,本品可在无菌检查完成之前放行使用。
在常规的18F-FDG生产中,应每月进行一次细菌学抽样检查。送检时取双份1 ml常规生产的18F-FDG注射液,分别用2管营养肉汤增菌培养液培养72h,观察结果应无细菌生长。
Cyclotron
第6楼2010/06/18
细菌内毒素检查:细菌内毒素不能通过加热和过滤除去,因此,在生产流程中所应用的水溶液、试剂和实验器材等均要求无热原。在18F-FDG生产过程中,酸水解过程是除去热原的一个有效的过程,因为在pH<1时, 在80℃以上加热10min,即可相当有效地破坏热原。
热原试验按中华人民共和国药典2000年版进行。取装有0.1ml鲎试剂溶液的试管4支,其中2支各加入0.1ml 18F-FDG注射液作为试验管,1支加入0.1ml内毒素工作标准液作为阳性对照管,另一支加入0.1ml细菌内毒素检查用水作为阴性对照管,混匀后在37℃水浴中保温60min。观察结果应为鲎实验阴性,定量测定其内毒素含量每mL不得超过175EU/V(EU为内毒素单位,V为在有效期限时总剂量的最大体积)。