几种测蛋白质含量的实验
考马斯亮蓝染料结合比色法测定蛋白质含量的原理和操作方法。
【实验原理】
考马斯亮蓝G-250是一种染料,在游离状态下呈红色,最大吸收峰在465nm。当它与蛋白质结合后变成深蓝色,最大吸收峰变为595nm。蛋白质含量在1-1000μg范围内,蛋白质-染料复合物在595nm处的吸光度与蛋白质含量成正比,故可用比色法测定。
蛋白质-染料复合物具有很高的吸光值,因此大大提高了蛋白质测定的灵敏度,最低检出量为1μg蛋白。染料与蛋白质结合迅速,大约为2分钟,结合物的颜色在1小时内稳定。所以本法操作简便,快速,灵敏度高,稳定性好,是一种测定蛋白质含量的常用方法。
【实验材料】
1.实验器材
721型分光光度计;试管;移液管;容量瓶。
2.实验试剂
(1)标准蛋白质溶液:称取10mg牛血清白蛋白,溶于蒸馏水中并定容至100ml,制成100μg/ml的溶液。
(2)考马斯亮蓝G-250试剂:称取 100mg考马斯亮蓝G-250,溶于50ml 95%乙醇中,加入85% (m/v) 的磷酸100ml,最后用蒸馏水定容到1000ml。此溶液可在常温下放置一个月。
(3)样品溶液:配制约50μg/ml的牛血清白蛋白溶液作为样品。
【实验方法】
1. 绘制标准曲线
取6支干燥洁净的大试管,编号,按下表加入试剂。
管号
1 2 3 4 5 6
标准蛋白溶液(ml)
蒸馏水(ml)
考马斯亮蓝G-250试剂(ml)
蛋白质含量(μg)
|
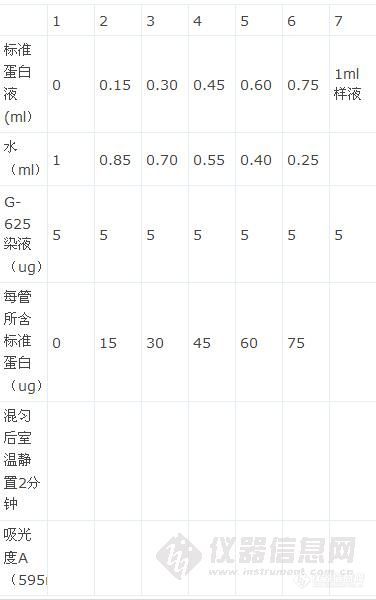
上述试剂加完后,混匀,室温静置2min,以第1管为对照,在595nm处比色,读取各管吸光值,以牛血清白蛋白含量为横坐标,以吸光值为纵坐标,绘制标准曲线。
2. 样品测定
准确吸取1.0ml样品溶液于一支干燥洁净的试管中,加入考马斯亮蓝G-250试剂5ml,摇匀,室温静置2min, 以标准曲线1号管为对照,在595nm处比色,记录吸光值。
【实验结果】
根据样品的吸光值从标准曲线上查出样品的蛋白质含量。
凯氏定氮法的原理和操作技术。
【实验原理】
凯氏定氮法用于测定有机物的含氮量,若蛋白质的含氮量已知时,则可用此法测定样品中蛋白质的含量。
当蛋白质与浓硫酸共热时,其中的碳、氢两元素被氧化成二氧化碳和水,而氮则转变成氨,并进一步与硫酸作用生成硫酸铵。此过程通常称为“消化”。但是,这个反应进行得比较缓慢,通常需要加入硫酸钾或硫酸钠以提高反应液的沸点,并加入硫酸铜作为催化剂,以促进反应的进行。
消化完成后,在凯氏定氮仪中加入浓碱,可使消化液中的硫酸铵分解,游离出氨,借助水蒸汽蒸馏法,将产生的氨蒸馏到一定量、一定浓度的硼酸溶液中,硼酸吸收氨后,氨与溶液中氢离子结合,使溶液中的氢离子浓度降低,指示剂颜色改变,然后用标准无机盐酸滴定,直至恢复溶液中原来的氢离子浓度为止。根据所用标准盐酸的量可计算出待测物中的总氮量。
蛋白质的含氮量为16%,即1克蛋白质中的氮相当于6.25克蛋白质,用凯氏定氮法测出的含氮量乘以6.25,即得样品中蛋白质的含量。
【实验材料】
1.实验器材
微量凯氏定氮仪 1套;50ml凯氏烧瓶 4个;移液管;锥形瓶;试管;小玻璃珠
2.试验试剂
(1) 浓硫酸;30%氢氧化钠溶液;2%硼酸溶液;标准盐酸溶液(0.01mol/L)。
(2) 粉末硫酸钾—硫酸铜混合物 :K2SO4与CuSO4·5H2O以3:1配比研磨混合。
(3)混合指示剂(田氏指示剂):由50ml 0.1%甲烯蓝乙醇溶液与200ml 0.1%甲基红乙醇溶液混合配成,贮于棕色瓶中备用。
(4) 样品溶液:配制3mg/ml的牛血清白蛋白溶液作为样品。
【实验操作】
1.安装凯氏定氮仪。
2.消化:取4个50ml凯氏烧瓶并标号,各加1颗玻璃珠,在1号及2号瓶中各加样品1ml,催化剂(K2SO4- CuSO4·5H2O)200 mg,浓硫酸5 ml。注意加样品时应直接送入瓶底,而不要沾在瓶口和瓶颈上。在3号及4号瓶中各加1 ml蒸馏水和与1、2号瓶相同量的催化剂和浓硫酸,作为对照。在通风橱内进行消化。
在消化开始时应控制火力,不要使液体冲到瓶颈。待硫酸开始分解并放出SO2白烟后,适当加强火力,继续消化,直至消化液呈透明淡绿色为止。撤掉火力,冷却至室温。
3.蒸馏:
(1)蒸馏器的洗涤:用水洗涤干净微量凯氏定氮仪,在蒸汽发生器中加入用几滴硫酸酸化的蒸馏水和几滴甲基红指示剂,用这样的水蒸气洗涤凯氏定氮仪。约15分钟后,在冷凝器下端倾斜放好装有硼酸-指示剂的锥形瓶,继续蒸汽洗涤2分钟,观察锥形瓶内的溶液是否变色,如不变色则证明蒸馏装置内部已洗涤干净。移走锥形瓶,停止加热,打开夹子。
(2)蒸馏:取下棒状玻塞,用吸管吸取消化液,细心地插到反应室小玻璃杯的下方,塞紧棒状玻塞。将一个含有硼酸和指示剂的锥形瓶放在冷凝器下方,使冷凝器下端浸没在液体内。取30%的氢氧化钠溶液10ml放入小玻璃杯中,轻提棒状玻璃塞使之流入反应室(为了防止冷凝管倒吸,液体流入反应室必须缓慢)。尚未完全流入时,将玻璃塞盖紧,向玻璃杯中加入蒸馏水约5ml。再轻提玻璃塞,使一半蒸馏水慢慢流入反应室,一半留在玻璃杯中作水封。加热水蒸汽发生器,沸腾后夹紧夹子,开始蒸馏。氨气进入锥形瓶,瓶中的酸溶液由紫色变成绿色。变色时起记时,再蒸馏5分钟。移动锥形瓶,使硼酸液面离开冷凝管约1 厘米,并用少量蒸馏水洗涤冷凝管口外面,继续蒸馏1分钟,移开锥形瓶,用表面皿覆盖锥形瓶。蒸馏完毕后,须将反应室洗涤干净,再继续下一个蒸馏操作。待样品和对照均蒸馏完毕后,同时进行滴定。
4.滴定:用0.01mol/L的标准盐酸溶液滴定各锥形瓶中收集的氨量,硼酸指示剂溶液由绿色变淡紫色为滴定终点。
【实验结果】
其中:
A为滴定样品用去的盐酸溶液平均ml数;
B为滴定对照液用去的盐酸溶液平均ml数;
C为所取样品溶液的ml数。
比色法蛋白质定量
蛋白质通常是多种蛋白质的化合物,比色法测定的基础是蛋白质构成成分:氨基酸(如酪氨酸,丝氨酸)与外加的显色基团或者染料反应,产生有色物质。有色物质的浓度与蛋白质反应的氨基酸数目直接相关,从而反应蛋白质浓度。
比色方法一般有BCA,Bradford,Lowry 等几种方法。
Lowry 法:以最早期的Biuret 反应为基础,并有所改进。蛋白质与Cu2+反应,产生蓝色的反应物。但是与Biuret 相比,Lowry 法敏感性更高。缺点是需要顺序加入几种不同的反应试剂;反应需要的时间较长;容易受到非蛋白物质的影响;含EDTA,Triton x-100,ammonia sulfate 等物质的蛋白不适合此种方法。
BCA(Bicinchoninine acid assay)法:这是一种较新的、更敏感的蛋白测试法。要分析的蛋白在碱性溶液里与Cu2+反应产生Cu+,后者与BCA形成螯合物,形成紫色化合物,吸收峰在562nm波长。此化合物与蛋白浓度的线性关系极强,反应后形成的化合物非常稳定。相对于Lowry法,操作简单,敏感度高。但是与Lowry法相似的是容易受到蛋白质之间以及去污剂的干扰。
Bradford 法:这种方法的原理是蛋白质与考马斯亮兰结合反应,产生的有色化合物吸收峰595nm。其最大的特点是,敏感度好,是Lowry 和BCA 两种测试方法的2 倍;操作更简单,速度更快;只需要一种反应试剂;化合物可以稳定1小时,方便结果;而且与一系列干扰Lowry,BCA 反应的还原剂(如DTT,巯基乙醇)相容。但是对于去污剂依然是敏感的。最主要的缺点是不同的标准品会导致同一样品的结果差异较大,无可比性。
BCA蛋白质定量检测试剂
在蛋白质的表达纯化,结构和功能的研究工作中,蛋白质的定量随处可见。但是,什么是理想的蛋白质定量方法?如何准确、快速的对蛋白质进行定量,对于不同的样本,如何选取相应的蛋白质定量试剂和方案?如何避免实验中引入的其它物质对蛋白质定量的干扰,PIERCE为这一切提供了可以信赖的解决方案。
PIERCE的BCA(bicinchoninic acid)蛋白质检测试剂是当前比Lowry法更优越的专用于检测总蛋白质含量的产品。该方法以快速灵敏、稳定可靠且对不同种类蛋白质变异系数甚小而深受专业人士的青睐。其中MicroBCA产品可检测到0.5μg/ml的微量蛋白,是目前已知的最灵敏的蛋白质检测试剂之一。
【实验原理】
大多数蛋白质分子结构中含有芳香族氨基酸(酪氨酸和色氨酸)残基,使蛋白质在280nm的紫外光区产生最大吸收,并且这一波长范围内的吸收值与蛋白质浓度的成正比,利用这一特性可定量测定蛋白质的含量。
紫外吸收法可测定0.1-0.5mg/ml的蛋白质溶液,此操作简便,测定迅速,不消耗样品,低浓度盐类不干扰测定。因此,此法在蛋白质的制备中广泛应用。 此法的缺点是:(1)对于测定那些与标准蛋白质中酪氨酸和色氨酸含量差异较大的蛋白质,有一定的误差;(2)若样品中含有嘌呤,嘧啶等吸收紫外线的物质,会出现较大的干扰。
【实验材料】
1.实验器材
试管及试管架;50毫升容量瓶 2只;移液管;紫外分光光度计。
2.实验试剂
(1)标准蛋白质溶液:精确配制2mg/ml的酪蛋白溶液。
(2)样品溶液:配制约0.5mg/ml的酪蛋白溶液作为未知样品溶液。
【实验操作】
1. 绘制标准曲线
取7支试管按下列各表加入各试剂:
管号
试剂
0
1
2
3
4
5
6
标准蛋白质溶液(ml)
0.0
0.5
1.0
1.5
2.0
2.5
3.0
蒸馏水(ml)
8.0
7.5
7.0
6.5
6.0
5.5
5.0
蛋白质浓度(mg/ml)
0.000
0.125
0.250
0.375
0.500
0.625
0.750
试剂加完后摇匀,在紫外分光光度计上,于280nm处以0号管为对照,分别测定各管溶液的光密度值。以光密度为纵座标,标准蛋白溶液浓度为横座标,绘制出标准曲线。
2. 测定未知样品
取样品溶液4毫升,加蒸馏水4ml混匀,在280nm下测定其光密度值。
【实验结果】
根据样品溶液的光密度值,在绘制好的标准曲线图中查出样品溶液的蛋白质含量。
实验原理】
蛋白质中含有酪氨酸和色氨酸残基,能与Folin-酚试剂起氧化还原反应。反应过程分为两步,第一步:在碱性溶液中,蛋白质分子中的肽键与碱性铜试剂中的Cu2+作用生成蛋白质-Cu2+复合物;第二步:蛋白质-Cu2+复合物中所含的酪氨酸或色氨酸残基还原酚试剂中的磷钼酸和磷钨酸,生成蓝色的化合物。该呈色反应在30分钟内即接近极限,并且在一定浓度范围内,蓝色的深浅度与蛋白质浓度呈线性关系,故可用比色的方法确定蛋白质的含量。进行测定时要根据蛋白质浓度的不同选用不同的测定波长:若蛋白质含量高时(25-100μg)在500nm波长处进行测定,含量低时(5-25μg)在755nm波长处进行测定。最后根据预先绘制的标准曲线求出未知样品中蛋白质的含量。
Folin-酚试剂法操作简便,灵敏度高,样品中蛋白质含量高于5μg即可测得,是测定蛋白质含量应用得最广泛的方法之一。 此法的优点是:操作简单,迅速,不需特殊仪器设备,灵敏度高,较紫外吸收法灵敏10—20倍,较双缩脲法灵敏100倍,反应约在15min内有最大显色,并至少可以稳定几个小时。其不足之处就是此反应受多种因素干扰。在测定时应排除干扰因素或做空白试验消除。
【实验材料】
1.实验器材
100毫升容量瓶 2只;移液管 1毫升4支,5毫升2支;721型分光光度计。
2.实验试剂
(1) Fo1in-酚试剂甲:将lg碳酸钠溶于50ml 0.lmol/L氢氧化钠溶液中,再把0.5g硫酸铜(CuSO4·5H2O)溶于100m1 1%酒石酸钾(或酒石酸钠)溶液,然后将前者50ml与后者lml混合。混合后1日内使用有效。
(2)Folin-酚试剂乙:在1.5L容积的磨口回流瓶中加入100g钨酸钠(Na2WO4·2H2O)、25g钼酸钠(Na2MoO4·2H2O)、700ml蒸馏水、50ml 85%磷酸及100ml浓盐酸,充分混匀后回流10h。回流完毕,再加150g硫酸锂、50ml蒸馏水及数滴液体溴,开口继续沸腾15分钟,以便驱除过量的溴,冷却后定容到1000ml。过滤,如显绿色,可加溴水数滴使氧化至溶液呈淡黄色。置于棕色瓶中暗处保存。使用前用标准氢氧化钠溶液滴定,酚酞为指示剂,以标定该试剂的酸度,一般为2mol/L左右(由于滤液为浅黄色,滴定时滤液需稀释100倍,以免影响滴定终点的观察)。使用时适当稀释(约1倍),使最后浓度为lmol/L酸。
(3)标准蛋白质溶液:用分析天平精密称取牛(或人)血清白蛋白100毫克,用少量蒸馏水完全溶解后,转移至100毫升容量瓶中,准确稀释至刻度,使蛋白质浓度1mg/ml。
(4)样品溶液:配制约0.5mg/ml的酪蛋白溶液作为未知样品溶液。
【实验操作】
1. 绘制标准曲线
取7支试管,按下表分别加入各试剂
试剂 管号
0
1
2
3
4
5
6
标准蛋白质溶液(ml)
0.0
0.1
0.2
0.3
0.4
0.5
0.6
蒸馏水(ml)
1.0
0.9
0.8
0.7
0.6
0.5
0.4
Fo1in-酚试剂甲(ml)
5
5
5
5
5
5
5
摇匀,室温下放置10分钟
Fo1in-酚试剂乙(ml)
1
1
1
1
1
1
1
各管加入Fo1in-酚试剂乙后,立即摇匀,放置30分钟后比色,在500nm处记下各管光密度,以0号管为对照,以光密度为纵坐标,标准蛋白质溶液浓度为横坐标,绘制标准曲线。
2. 测定未知样品:取2支试管,分别准确吸取1毫升样品溶液,各加5毫升Fo1in-酚试剂甲,摇匀,室温放置10分钟后,再各加1毫升Fo1in-酚试剂乙,立即摇匀,放置30分钟,在500nm处测定光密度值。
【实验结果】
根据未知样品溶液的光密度值,在绘制好的标准曲线图中查出样品溶液中的蛋白质含量

