

电位分析法
一、电化学基础知识
lilongfei14
第1楼2011/12/24
测得的电动势就是这支待测电极的标准电极电位。用符号jo表示。
原电池电极间的最大电位差称为原电池的电动势。
二、电位法测定PH值
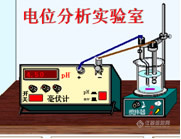
测定pH的工作电池示意图
lilongfei14
第2楼2011/12/24
KCl溶液浓度 0.1mol/L 1mol/L 饱和
j甘汞(V) +0.3338 +0.2800 +0.2415
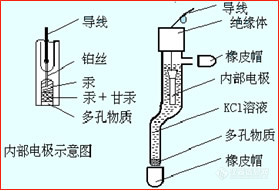
2、指示电极:测定pH值的指示电极为玻璃电极。它是最早的一种离子选择电极。
[说明]:它的主要成份是由特殊成份的玻璃制成的薄膜,膜厚约50cm,在玻璃泡中装有pH值一定缓冲溶液(通常为0.1mol/L HCl溶液)其中插入一支银-氯化银电极。
玻璃电极中内参比电极的电位实恒定的,与被测溶液的PH值无关。
 玻璃电极
玻璃电极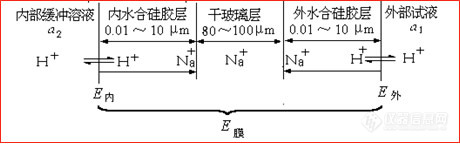
玻璃电极
lilongfei14
第3楼2011/12/24
[上面公式的说明]:玻璃电极是膜电极的一种。膜电极具有容许某些离子而限制某些离子进出膜的表面的特性。
Na2O 22 这种玻璃的结构是由固定的带负电荷的硅酸晶格组成。
CaO 6 特殊玻璃 在晶格中存在较小的,但活动力较强的正离子,主要是
SiO2 72 钠离子,溶液中的氢离子能进入硅酸晶格中里代替钠离
子的点位,溶液中的负离子,被带负电硅酸晶格排斥,
二价或多价离子也无法进入晶格。当玻璃膜泡在水中:
︱ ︱
H+ + M+ -OSi — —SiO- H+ + M+
外部溶液 表面点位 被H+交换 | 点位 H+ Na+ | Na+ | 点位 H+ Na+ | 内部溶液 表面点位 被H+交换 |
一个浸泡好的玻璃电极示意图 |
lilongfei14
第4楼2011/12/24
产生电位差。电位差的存在影响H+在两相间相互扩散的速度,最后形成扩散平衡,建立了平衡的相界电位。
因此,可以通过测定膜电位,即可求出膜外溶液氢离子的活度,这就是用玻璃电极测定溶液PH值的理论根据。
[Na玻璃] pH 1 ~ 9范围内,电极响应正常;
pH <1 pH读数偏高,误差在0.1pH单位以内,“酸差”;
pH > 10 pH读数偏低,“碱差”或“钠差”,H+浓度过低造成的;
[Li玻璃] 1 ~ 14 pH ,钠差大大降低了。
缺点:强度较差,pH大于14也有碱差。
[玻璃电极的优点]:①测定结果准确,在pH 1 ~ 9范围内使用最佳。
②不受溶液氧化剂或还原剂存在的影响。
③可用于有色的,浑浊的或胶态溶液PH测定。
[玻璃电极的缺点]:①容易破碎。
②须不时用已知pH值缓冲溶液核对。
三、电位滴定法