

1.背景
2017年3月,首次进口非特化妆品管理由审批改备案工作在上海浦东新区率先试点施行。今年3月,在上海浦东新区试点基础上,国务院决定在天津、辽宁、浙江、福建、河南、湖北、广东、重庆、四川和陕西的10个自贸区,推广复制浦东新区经验,扩大首次进口非特化妆品备案试点工作。2018年11月,国家药品监督管理局发布了一则关于在全国范围实施进口非特殊用途化妆品备案管理有关事宜的公告(2018年第88号),该公告指出在2018年11月10日起,首次进口非特殊用途化妆品由现行审批管理和自贸试验区试点实施备案管理,调整为全国统一备案管理,国家药品监督管理部门不再受理进口非特殊用途化妆品行政许可申请。本文将从法规文件,流程与要求,新备案模式与传统注册比较等几个方面进行解析。
2.“备案制”全面推开内容详解
2.1与进口非特化妆品备案相关的法规文件汇总
* 关于在全国范围实施进口非特殊用途化妆品备案管理有关事宜的公告(2018年第88号);
* 关于在更大范围试点实施进口非特殊用途化妆品备案管理有关事宜的公告2018年第31号;
* 关于明确浦东新区试点实施进口非特殊用途化妆品备案检验报告要求等有关事宜的通知〔2017〕72号;
* 关于在上海市浦东新区开展进口非特殊用途化妆品备案管理试点工作有关事项的公告(2017年第7号);
* 上海市浦东新区进口非特殊用途化妆品备案管理工作程序(暂行)2017年第10号;
* 关于印发化妆品行政许可检验管理办法的通知82号;
* 关于印发化妆品中可能存在的安全性风险物质风险评估指南的通知国食药监许339号;
* 关于印发化妆品行政许可申报受理规定的通知国食药监许856号;
* 关于印发化妆品产品技术要求规范的通知国食药监许454号
2018年第88号指出申请进口非特殊用途化妆品备案的进口化妆品生产企业,应当参照原食品药品监管总局发布的《关于发布上海市浦东新区进口非特殊用途化妆品备案管理工作程序(暂行)的公告》(2017年 第10号)相关要求,进行境内责任人授权、备案系统用户名称注册、产品备案信息报送、备案信息凭证打印等相关工作。
关于进口非特殊用途化妆品检验报告、境内化妆品企业委托境外企业生产等有关事宜,参照原食品药品监管总局办公厅《关于明确浦东新区试点实施进口非特殊用途化妆品备案检验报告要求等有关事宜的通知》(食药监办药化管〔2017〕72号)执行。
2.2进口非特化妆品备案流程与要求
在以前,进口非特化妆品审批事权归国家食药监总局,企业每进口一种新化妆品,都要到北京提交材料,并等待专家审评。由审批改为备案管理后,审批时限由以往3个月左右缩减为5个工作日。这意味着,首次非特进口备案试点以来,国外产品在国内的上市时间平均提前了两个半月。那弱化了事前审批流程,服务企业,便利消费者,但是否意味着对产品质量的要求有所降低?答案是否定的,甚至要求更高了,接下来就具体看看备案流程与要求。
2.2.1进口非特化妆品备案流程
第一步(形式审查):
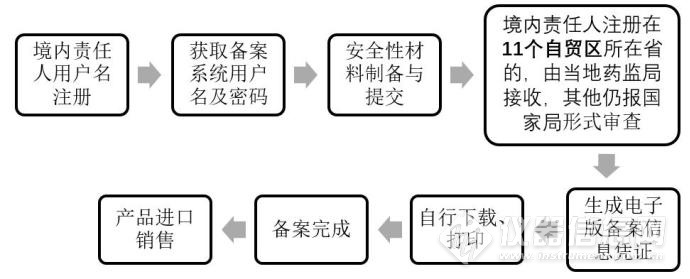
第二部(技术审评):
2.2.2进口非特化妆品备案申请资料(见表1)
表1
| 序号 | 提交材料名称 | 要求 |
| 1 | 进口非特殊用途化妆品备案申请表 | 申请表在线填报后打印纸质申请表,并按要求签名、盖章。内容应完整、清楚,不得涂改 |
| 2 | 产品中文名称命名依据 | 产品中文名称应当符合《化妆品命名规定》、《化妆品命名指南》的要求。 1)命名依据中应提供申报产品的商标名、通用名(含使用目的或使用部位)、属性名具体含义的解释。约定俗成的、习惯使用的化妆品名称可省略通用名、属性名。 2)产品中文名称中若有表明产品物理性状或外观形态以及含颜色、色号、气味、适用发质、肤质或特定人群等内容的,应加以解释。 3)产品中文名称中若使用具体原料名称或表明原料类别词汇的,应加以解释。 4)产品中文名称中的修饰、形容词或必须使用外文字母、符号等的,应加以解释。 5)需标注产品中文名称的汉语拼音名。 |
| 3 | 产品配方 | 产品配方要求参照《关于印发化妆品行政许可申报受理规定的通知》(国食药监许〔2009〕856号)附件《化妆品行政许可申报资料要求》第十四条、第二十六条执行。 |
| 4 | 产品质量安全控制要求 | 应包括在原产国执行的产品质量安全控制要求(外文版及中文译文)及产品符合《化妆品安全技术规范》(2015年版)要求的承诺。 |
| 5 | 产品包装图片 | 产品原包装(含产品标签、产品说明书)图片;拟专为中国市场设计包装的,需同时提交产品设计包装(含产品标签、产品说明书)。 |
| 6 | 产品生产工艺简述 | 提供的生产工艺简述应包括工艺流程简图,工艺简述应能简明扼要地反映产品的实际生产过程,包括操作步骤、各步骤中涉及的原料等。产品配方中所有原料应在生产工艺中列出,原料名称应与产品配方一致。工艺简述应与工艺简图相符。 |
| 7 | 产品技术要求 | 参照《关于印发化妆品产品技术要求规范的通知》(国食药监许〔2010〕454号)要求编制。 |
| 8 | 化妆品行政许可检验机构出具的检验报告及相关资料 | 1)产品检验要求参照《关于印发化妆品行政许可检验管理办法的通知》(国食药监许〔2010〕82号)执行。 2)检验报告要求参照《关于印发化妆品行政许可申报受理规定的通知》(国食药监许〔2009〕856号)附件《化妆品行政许可申报资料要求》第十八条执行。 |
| 9 | 产品中可能存在安全性风险物质的有关安全性评估资料 | 参照《化妆品中可能存在的安全性风险物质风险评估指南》(国食药监许〔2010〕339号)执行。 |
| 10 | 化妆品适用原料及原料来源符合疯牛病疫区高风险物质禁限用要求的承诺书 | 参照《卫生部卫生监督中心关于要求对进口化妆品提交承诺书的公告》执行。 |
| 11 | 产品在生产国(地区)或原产国(地区)生产和销售的证明文件 | 生产和销售证明文件要求参照《关于印发化妆品行政许可申报受理规定的通知》(国食药监许〔2009〕856号)附件《化妆品行政许可申报资料要求》第二十一条、第二十四条执行。 |
| 12 | 境外生产企业生产质量管理的相关证明材料 | 相关证明材料包括质量管理体系或良好生产规范的证明文件或符合生产企业所在国(地区)法规要求的化妆品生产资质的证明文件。证明文件应由认证机构或第三方出具或认可。无法提交原件的,可提交复印件,复印件应由中国公证机关公证或由我国使(领)馆确认;所载明的生产企业名称和地址应与所申报的内容完全一致。 |
| 13 | 有助于备案的其他资料 | 参照《化妆品行政许可申报受理规定》(国食药监许〔2009〕856号,可能有助于备案的其他资料。 |
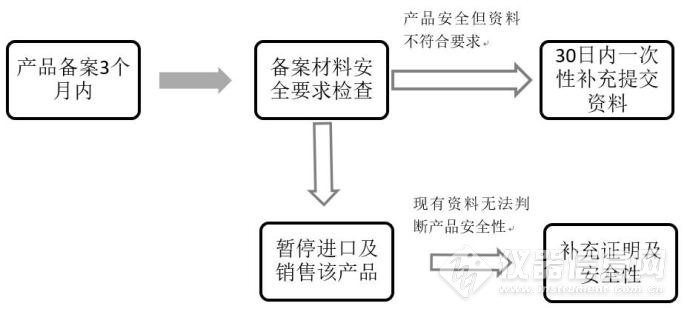
由以上可以看出,“备案制”与许可申报所需要的资料是一样的,只是在监管模式有了改变,药品监管部门在产品备案后组织对备案资料的监督检查,必要时进行现场检查。发现备案资料不符合要求,但不影响产品安全性判断的,应当要求境内责任人于30日内补充提交相关资料;发现依据现有资料无法判断产品安全性的,应当告知境内责任人补充提交相关资料,并在确认备案资料符合要求前暂停进口及销售该产品;发现存在违法情形或产品质量安全问题的,监管部门将依法予以查处,并对相关产品进行责令下架、召回处理。
2.3新备案模式与传统注册比较(见表2)
表2
| 项目 | 新备案模式 | 传统注册 |
| 审核制度 | 备案制 | 行政许可申报 |
| 接收窗口
| 境内责任人注册在11个自贸区所在省的,由当地药监局接收,其他仍报国家局 | 国家药监局
|
| 授权申请
| 国外申请人授权在华公司作为境内责任人 | 国外申请人授权在华公司作为在华申报责任单位 |
| 在华公司责任
| 负责产品进口和经营,并承担产品质量安全责任 | 仅负责产品行政许可
|
| 批准或备案凭证编号格式 | 国妆网备进字(境内责任人所在省份简称)+四位年份数字+六位顺序编号 | 国妆备进字J+四位年份数字+四位编号
|
| 批准或备案凭证 | 未知
| 4年
|
| 许可或者备案凭证
| 形式审查通过后备案系统自动生成电子版备案信息凭证供企业自行下载打印 | 技术审查通过后发放行政许可批件证书
|
由上表看出,新备案模式与传统注册最大的差异体现在备案流程或许可及境内责任人的要求。新备案模式最大优势体现在企业通过资料形式审查后就可以获得备案号进行进口销售。国家局行政许可要求在通过所有形式和技术审查后才能获得许可号进行进口销售。两者相比,前者更利于企业将产品快速投放市场。但在资料要求上,两者几乎保持一致。可见,境内责任人的出现,实际上是为了境外化妆品生产企业和我国监管部门,以及消费者之间,架起一座桥梁,更切实督促企业落实主体责任和社会责任。另外,根据现行规定,无论是进口非特化妆品还是国产非特化妆品,均未设置备案有效期。但是,未设置备案有效期并不意味着一次备案,终生有效。”据悉,国家药监局正起草《非特殊用途化妆品备案管理办法》,将会对已备案产品提出年报制度要求,企业定期通过网上备案平台填报产品的生产进口、上市销售、不良反应监测等情况。未履行报告义务的产品备案信息将会被清理,避免网上备案平台出现“僵尸产品”堆积现象。
3.总结
将首次进口非特化妆品调整为全国统一备案管理,改事前“点头”为事后“摇头”,首次进口非特化妆品备案管理时代。试点期间,全国范围内已经有近3000种首次进口非特化妆品完成备案。其中,上海浦东自贸区试点时间较长,试点一年多来,完成备案进口产品已达2500余个。广东、四川、浙江等省也已有进口产品完成备案。最近,上海市,浙江省,广东省等各个地方药监局相续出台进口化妆品非特备案办事指南,企业可以根据指南进行备案工作。此次88号文件,官方名义是“贯彻国务院落实简政放权和证照分离的改革的要求”,实际意义是“适应化妆品行业发展需要”将进口品和国产品带到了同一起跑线。