HPLC测定不同来源山药中腺苷和脱氢表雄酮的含量
山药(Dioscoreae Rhizoma)是薯蓣科植物薯蓣(Dioscorea opposita Thunb.)的干燥块茎,具有补脾养胃、生津益肺、补肾涩精的功能,是国家卫生部公布的药食两用的中药。然而在2015版《中国药典》一部中只收载了性状、鉴别、检查和浸出物等项目,缺少含量测定项指标,不足以对山药质量进行全面有效的控制。DHEA是人体肾上腺素的一种,国内外研究已经证实,DHEA对预防和治疗心血管疾病、增强免疫力、延缓衰老等均有一定效果,是山药中的重要活性成分之一。另外,腺苷具有舒张血管、降低血压、减慢心律、抑制血小板聚集、松弛血管平滑肌等生理活性。
长期以来,由于对山药品种的评价和改良工作进展缓慢,目前仍然存在山药种植品种杂乱,缺乏综合性优良的品种。因此,本研究对包括野生山药在内的不同来源山药中的腺苷、DHEA含量进行测定,旨在为山药质量标准建立提供参考依据,也为山药品种驯化和选育提供一定的研究基础。
1 仪器和试药
LC-20AD高效液相色谱仪,配备紫外可见检测器(日本,岛津公司);ME204电子天平(德国Mettler Toledo公司),KQ-E型超声波清洗器(昆山市超声仪器有限公司)。
脱氢表雄酮标准品(阿拉丁,批号为H1408213),腺苷标准品(中国食品药品检定研究院,批号为110879-200202);甲醇为色谱纯,水为娃哈哈纯净水,其他试剂均为分析纯。山药样品采自河南省温县山药种植基地。
2 方法与结果
2.1标准储备溶液的制备
精密称取腺苷对照品6.61 mg置25 mL容量瓶中,加15 %甲醇溶解稀释至刻度,摇匀,配制成浓度为264.40 μg·mL-1的腺苷标准品储备溶液。精密称取DHEA对照品7.62 mg置50 mL容量瓶中,加甲醇溶解稀释至刻度,摇匀,配制成浓度为152.40 μg·mL-1的DHEA标准品储备溶液。
2.2样品的处理
2.2.1 腺苷样品的处理
取本品粉末(过3号筛)约1.0 g,精密称定,置具塞锥形瓶中,精密加入15%甲醇l0 mL,密塞,摇匀,称定质量,超声处理30 min,放冷,再称定质量,用15%甲醇补足减失的重量,12000 r·min-1离心15 min,取上清液,0.45 μm微孔滤膜滤过,取续滤液作为供试品溶液。
2.2.2 DHEA样品的处理
取本品粉末(过3号筛)约3.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇l5 mL,密塞,摇匀,称定质量,超声处理1 h,放冷,再称定质量,用甲醇补足减失的重量,摇匀,0.45μm微孔滤膜滤过,取续滤液作为供试品溶液。
2.3 色谱条件
2.3.1 腺苷色谱条件:色谱柱:Aglient Extend XDB C18柱(4.6 mm×250 mm,5 μm);流动相:磷酸盐缓冲液(pH6.5) -甲醇(94:6,v/v);流速:1 mL·min-1;柱温:30 °C; 检测波长:260 nm;进样量:10 μL。HPLC图见图1。
2.3.2 DHEA色谱条件:色谱柱:Welch Ultimate XB-C18柱(4.6 mm×250 mm,5 μm);流动相:甲醇-水(62:38,v/v);流速:0.6 mL·min-1;柱温:30 °C; 检测波长:204 nm;进样量:10 μL。HPLC图见图2。
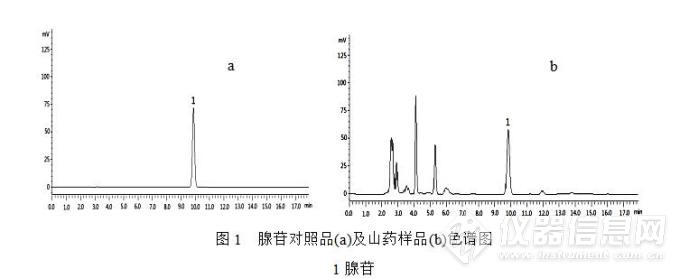
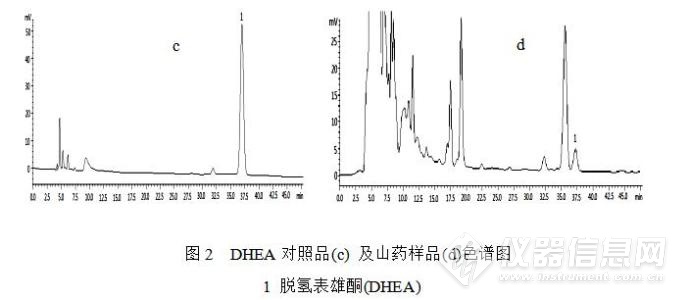
2.4标准曲线的绘制
精密吸取腺苷标准品储备溶液0.5,1,3,5,8,10 mL分别置于10 mL量瓶中,加甲醇定容至刻度,摇匀,按上述色谱条件进样,以峰面积值 Y为纵坐标,腺苷浓度X为横坐标绘制标准方程为:Y=34197.2 X+25515.1,r=0.9999,表明腺苷在13.22 ~ 264.40 μg·mL-1浓度内与峰面积线性关系良好。
精密吸取DHEA标准品储备溶液1 mL置于10 mL量瓶中,加甲醇定容至刻度,摇匀,得15.24 μg·mL-1的DHEA使用溶液。分别精密吸取DHEA使用溶液0.5,1,3,5,8,10 mL置于10 mL量瓶中,加甲醇定容至刻度,摇匀,按上述色谱条件进样,以峰面积值 Y为纵坐标,DHEA浓度X为横坐标绘制标准方程为:Y=13042.7 X-1836.3,r=0.9999,表明DHEA在0.76 ~ 15.24 μg·mL-1浓度内与峰面积线性关系良好。
2.5 重复性试验
取同一供试品粉末6份,精密称定,按“2.2”项下方法处理,按“2.3”项下色谱条件测定峰面积。结果腺苷和DHEA峰面积的RSD分别为1.87 %和1.91 % (n=6),表明方法重复性良好。
2.6 精密度试验
精密吸取同一供试品溶液10 μL,按上述色谱条件连续进样6次,测定腺苷、DHEA峰面积值,其RSD分别为0.92 %和1.03 % (n=6),表明仪器及进样精密度良好。
2.7 稳定性试验
精密吸取同一供试品溶液,室温放置,分别在0,2,4,8,12,24,48 h进样分析。测定腺苷、DHEA峰面积值,其RSD分别为2.07 %和1.65 % (n=6),表明供试品溶液在48 h内稳定性良好。
2.8 回收率
分别称取已知含量的样品6份,精密称定,分别加入相当含量的腺苷和DHEA对照品溶液,按“2.2”项下供试品溶液的制备方法制备供试品溶液,分别进行测定,计算回收率。结果腺苷、DHEA平均加样回收率为98.10 % (RSD=1.40 %)和97.72 % (RSD=1.15 %),结果见表1、2。
表1 山药样品中腺苷的加样回收率实验结果(n=6)
取样量/g | 样品中量/mg | 添加量/mg | 测得量/mg | 回收率/% | 平均回收率/% | RSD/% |
0.5014 | 0.1604 | 0.1586 | 0.3141 | 96.88 | 98.10 | 1.40 |
0.5011 | 0.1604 | 0.1586 | 0.3201 | 100.72 |
0.4989 | 0.1596 | 0.1586 | 0.3147 | 97.76 |
0.4997 | 0.1599 | 0.1586 | 0.3141 | 97.22 |
0.5001 | 0.1600 | 0.1586 | 0.3159 | 98.28 |
0.5012 | 0.1604 | 0.1586 | 0.3154 | 97.74 |
表2 山药样品中DHEA的加样回收率实验结果(n=6)
取样量/g | 样品中量/mg | 添加量/mg | 测得量/mg | 回收率/% | 平均回收率/% | RSD/% |
1.5013 | 0.0293 | 0.0305 | 0.0589 | 97.13 | 97.72 | 1.15 |
1.5024 | 0.0293 | 0.0305 | 0.0591 | 97.72 |
1.4997 | 0.0292 | 0.0305 | 0.0597 | 99.86 |
1.5001 | 0.0293 | 0.0305 | 0.0589 | 97.21 |
1.4987 | 0.0292 | 0.0305 | 0.0587 | 96.64 |
1.5011 | 0.0293 | 0.0305 | 0.0591 | 97.80 |
2.9 结果分析
精密称取不同来源的山药粉末,按“2.2”项下方法制备供试品溶液,分别进样,记录峰面积积分值,外标法计算腺苷及DHEA的含量。结果如下表3所示。
表3 不同来源山药药材中腺苷及DHEA的含量(n=3)
编号 | 样品来源 | 腺苷含量/% | DHEA含量/mg/kg |
1 | 种植铁棍山药 | 0.032 | 19.50 |
2 | 野生山药1 | 0.027 | 5.38 |
3 | 野生山药2 | 0.024 | 3.29 |
4 | 驯化野生山药雌株 | 0.037 | 24.05 |
5 | 驯化野生山药雄株 | 0.040 | 62.25 |
6 | 紫山药 | ND | ND |
从测定结果看,不同来源山药中腺苷和DHEA含量差别较大,可能由于品种及生长环境的差异造成。研究表明,驯化野生山药雄株中腺苷和DHEA含量最高,显著高于野生山药中的含量,说明驯化过程对野生山药的改良起到了很好的积极作用。另外,驯化野生山药雄株中DHEA含量比公认的营养成分较高的铁棍山药高出3倍左右,进一步说明该山药品质的优异性。
另外,紫山药中并未检测到腺苷和DHEA两种成分的存在,这可能由于紫山药自身品种差异有关。
3 小结和讨论
3.1 DHEA提取条件优化
在DHEA测定前处理时,本实验曾根据李军等人的优化方法,采用甲醇-丙酮(6:4)超声提取、水浴蒸干、二氯甲烷多次萃取等主要工序对山药中DHEA进行提取,该方法提取效果较好,DHEA可以被较好的富集和检测。但是由于提取过程复杂,实验重复性和加样回收率较难控制。本实验采用甲醇、乙醇、甲醇-丙酮(1:1,v/v)等溶剂对山药样品进行超声1h提取,结果发现,四种溶剂提取效果没有明显差异,因此选用甲醇做为最终提取溶剂。
本实验采用的方法大大简化了山药中DHEA的提取过程,减少了有毒试剂的使用,缩短了提取时间,且提取率与李军的方法相比没有显著的差异。
3.2 小结
本研究对山药中腺苷和DHEA成分的提取和测定条件进行优化,为山药质量标准建立和质量评价提供参考依据。另外,研究对包括野生、种植、驯化品种等不同来源山药中腺苷和DHEA指标含量进行测定,为山药品种的选育和驯化提供一定的研究基础。



