

UPLC-MS/MS测定葡萄酒中29种单体酚方法的建立
YANG Zhiwei, WANG Shengyi, QI Pengyu, ZHANG Ang*, LI Xiang, WANG Fei, ZHANG Jinjie
(Inspection and Quarantine Technique Centre, Qinhuangdao Entry-Exit Inspection and Quarantine Bureau of P.R. China, Qinhuangdao, Hebei, 066004, China)
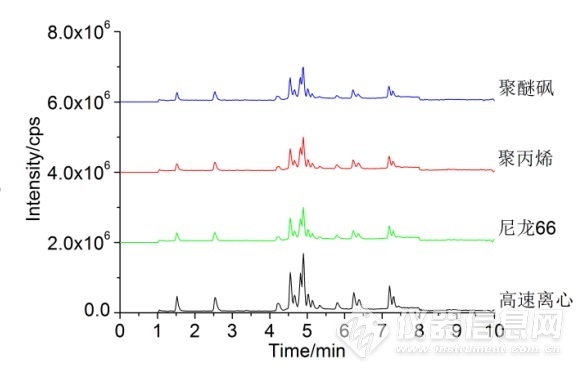
图1 3种滤膜与直接进样比较
Fig. 1 Comparison of 3 kinds of filter membranes with direct injection
分别将29种单体酚浓度为1 mg/L标准工作液以0.01 mL/min流速将标准工作液注入离子源,负离子化模式下对每种单体酚进行一级质谱分析(Q1),得到母离子峰。在进行目标离子二级扫描(MS2),得到碎片离子。
选取响应最高的两个碎片离子用于定性与定量,进行条件优化得到射入电压(EP)碰撞电压(CE)碰撞室射出电压(CXP)去簇电压(DP)等相关参数,优化后29种单体酚质谱参数见表1。
表1 29种单体酚质谱参数
Table 1 Mass Spectrometry Parameters of 29 Monomer Phenols
序号 | 名称 | 母离子(DA) | 碎片离子(DA) | DP (VOLTS) | EP (VOLTS) | CE (VOLTS) | CXP (VOLTS) |
1 | GA | 168.778 | 124.9* | -55 | -10 | -20 | -11 |
79 | -28 | -7 | |||||
2 | PA | 152.794 | 108.9* | -55 | -10 | -20 | -9 |
107.9 | -32 | -9 | |||||
3 | CA | 288.861 | 244.9* | -90 | -10 | -20 | -11 |
202.9 | -26 | -15 | |||||
4 | EA | 288.861 | 244.9* | -90 | -10 | -20 | -11 |
202.9 | -26 | -15 | |||||
5 | EGC | 304.872 | 124.9* | -100 | -10 | -26 | -11 |
164.9 | -24 | -13 | |||||
6 | EGCG | 456.912 | 168.8* | -100 | -10 | -22 | -13 |
125 | -48 | -9 | |||||
7 | ECG | 440.89 | 288.8* | -105 | -10 | -22 | -11 |
168.9 | -24 | -41 | |||||
8 | CAA | 178.792 | 134.9* | -60 | -10 | -20 | -11 |
133.9 | -32 | -11 | |||||
9 | FA | 192.804 | 133.9* | -60 | -10 | -22 | -9 |
177.9 | -18 | -3 | |||||
10 | P-CA | 162.792 | 118.9* | -20 | -10 | -20 | -9 |
92.9 | -40 | -7 | |||||
11 | CGA | 352.901 | 190.9* | -75 | -10 | -20 | -7 |
85 | -52 | -7 | |||||
12 | cis-Res | 226.815 | 184.9* | -150 | -10 | -26 | -11 |
143 | -32 | -13 | |||||
13 | trans-Res | 226.815 | 184.9* | -150 | -10 | -26 | -11 |
143 | -32 | -13 | |||||
14 | Res-3-Gly | 388.955 | 227* | -100 | -10 | -22 | -9 |
184.9 | -48 | -15 | |||||
15 | Kae | 284.833 | 116.9* | -110 | -10 | -50 | -9 |
92.9 | -58 | -7 | |||||
16 | Que | 300.832 | 150.9* | -100 | -10 | -28 | -9 |
178.8 | -24 | -13 | |||||
17 | Que-3-Glu | 462.886 | 299.8* | -135 | -10 | -36 | -11 |
270.8 | -56 | -19 | |||||
18 | Myr | 316.815 | 150.9* | -120 | -10 | -32 | -11 |
178.9 | -26 | -13 | |||||
19 | Mor | 300.811 | 150.9* | -65 | -10 | -28 | -13 |
124.9 | -28 | -17 | |||||
20 | Fis | 284.833 | 134.9* | -110 | -10 | -28 | -11 |
120.9 | -32 | -11 | |||||
21 | Api | 268.931 | 116.9* | -95 | -10 | -38 | -11 |
150.9 | -32 | -11 | |||||
22 | Lut | 284.846 | 132.9* | -75 | -10 | -42 | -11 |
131.9 | -68 | -11 | |||||
23 | Vit | 576.957 | 292.9* | -140 | -10 | -46 | -9 |
412.9 | -32 | -15 | |||||
24 | Pro B1 | 576.845 | 288.9* | -155 | -10 | -30 | -11 |
406.9 | -32 | -13 | |||||
25 | Pro B2 | 576.845 | 288.9* | -155 | -10 | -30 | -11 |
406.9 | -32 | -13 | |||||
26 | Pic | 242.89 | 158.9* | -80 | -10 | -36 | -11 |
200.9 | -28 | -9 | |||||
27 | VA | 166.806 | 151.8* | -50 | -10 | -18 | -7 |
107.9 | -24 | -9 | |||||
28 | Vin | 452.969 | 346.9* | -140 | -10 | -30 | -13 |
358.9 | -28 | -13 | |||||
29 | But | 270.887 | 134.9* | -85 | -10 | -24 | -9 |
134 | -56 | -9 |

图2 29种单体酚总离子流图
Fig. 2 Total ion flow diagram of 29 monomeric phenols
表2 29种单体酚保留时间及色谱峰编号
Table 2 Retention Time and Chromatographic Peak Number of 29 Monomer Phenols
峰号 | R.T | 名称 | 峰号 | R.T | 名称 | 峰号 | R.T | 名称 |
1 | 1.45 | GA | 8 | 4.52 | EGCG | 13 | 5.2 | Myr |
2 | 2.34 | PA | 8 | 4.61 | Vit | 14 | 5.59 | Mor |
3 | 2.71 | Pro B1 | 9 | 4.75 | trans-Res | 14 | 5.6 | cis-Res |
4 | 2.92 | EGC | 9 | 4.75 | Res-3-Gly | 15 | 5.96 | Lut |
5 | 3.78 | CGA | 9 | 4.73 | Que-3-Glu | 16 | 6.07 | Que |
5 | 3.84 | CA | 10 | 4.8 | ECG | 17 | 6.89 | Vin |
6 | 4.35 | Pro B2 | 10 | 4.8 | p-CA | 17 | 6.92 | But |
7 | 4.44 | CAA | 11 | 4.93 | FA | 18 | 7.08 | Api |
7 | 4.41 | VA | 12 | 5.03 | Pic | 19 | 7.25 | Kae |
7 | 4.49 | EC | 13 | 5.21 | Fis |
|
|
|
表3 单体酚结构式
Table 3 Structural Formulas of Monomeric Phenols
序号 |
| 名称 | R1 | R2 | R3 | R4 |
1 |
| GA | OH | OH | - | - |
PA | OH | H | - | - | ||
2 |   | EC | OH | H | OH | - |
CA | H | OH | OH | - | ||
EGC | OH | OH | OH | - | ||
EGCG | OH | OH | Gallate | - | ||
ECG | H | OH | Gallate | - | ||
3 |
| CAA | OH | | OH | - |
CGA | Quinicacid | | OH | - | ||
p-CA | OH | | H | - | ||
FA | OH | | OCH3 | - | ||
4 |
| trans-Res | H |
| - | - |
cis-Res | H | | - | - | ||
Res-3-Gly | OGlu | | - | - | ||
5 | | Que | H | H | OH | O |
Kae | H | H | H | OH | ||
Que-3-Glu | H | H | OH | OGlu | ||
Myr | H | OH | OH | OH | ||
Mor | OH | H | H | OH | ||
6 |
| Fis | OH | H | OH | H |
Vit | H | ORham | H | OH | ||
Api | H | H | H | OH | ||
Lut | OH | H | H | OH | ||
7 | | Pro B1 |
| - | - | - |
Pro B2 |
| - | - | - | ||
8 | | Vin | - | - | - | - |
9 | | But | - | - | - | - |
10 |
| Pic | - | - | - | - |
11 |
| VA | - | - | - | - |
表4 方法学验证
Table 4 Methodological Validation
序号 | 单体酚 | 回归方程 | R2 | 回收率/% | RSD/% | 检出限/(mg/L) | 定量限/(mg/L) |
1 | GA | Y = 95 200X + 28 400 | 0.998 8 | 90.8 ~ 96.7 | 6.32 ~ 7.54 | 0.000 3 | 0.001 |
2 | PA | Y = 75 000X - 967 | 0.996 9 | 92.9 ~ 104 | 4.16 ~ 4.95 | 0.000 3 | 0.001 |
3 | CA | Y = 5 650X + 2 330 | 0.995 8 | 94.6 ~ 102 | 2.78 ~ 3.32 | 0.003 0 | 0.010 |
4 | EC | Y = 5 170X + 9 390 | 0.997 8 | 94.9 ~ 99.5 | 2.12 ~ 2.47 | 0.001 5 | 0.005 |
5 | EGC | Y = 3 410X - 3 010 | 0.999 0 | 92 ~ 96 | 1.88 ~ 2.19 | 0.001 5 | 0.005 |
6 | EGCG | Y = 17 200X - 2 940 | 0.997 5 | 91.8 ~ 102 | 3.79 ~ 4.52 | 0.001 5 | 0.005 |
7 | ECG | Y = 18 400X - 8 370 | 0.996 0 | 91.4 ~ 99.5 | 3.00 ~ 3.53 | 0.000 3 | 0.001 |
8 | CAA | Y = 105 000X + 48 300 | 0.998 2 | 96.4 ~ 101 | 2.10 ~ 2.46 | 0.000 3 | 0.001 |
9 | FA | Y = 27 800X - 6 680 | 0.997 2 | 93.1 ~ 98 | 4.00 ~ 4.73 | 0.000 3 | 0.001 |
10 | p-CA | Y = 190 000X + 26 300 | 0.997 8 | 92.4 ~ 101.4 | 3.54 ~ 4.16 | 0.000 3 | 0.001 |
11 | CGA | Y = 36 500X + 294 | 0.996 1 | 95.6 ~ 99.2 | 1.31 ~ 1.53 | 0.000 3 | 0.001 |
12 | cis-Res | Y = 2 120X + 2 810 | 0.999 5 | 92.8 ~ 99.4 | 2.64 ~ 3.13 | 0.000 3 | 0.001 |
13 | trans-Res | Y = 5 650X - 1 270 | 0.996 7 | 93.1 ~ 102 | 3.23 ~ 3.82 | 0.000 6 | 0.002 |
14 | Res-3-Gly | Y = 20 200X - 4 730 | 0.996 1 | 95.2 ~ 101.8 | 2.30 ~ 2.72 | 0.000 3 | 0.001 |
15 | Kae | Y = 1 860X - 1 410 | 0.996 5 | 95.6 ~ 96.3 | 1.21 ~ 1.44 | 0.000 3 | 0.001 |
16 | Que | Y = 10 300X - 10 300 | 0.993 9 | 92.5 ~ 104.5 | 4.82 ~ 5.65 | 0.000 3 | 0.001 |
17 | Que-3-Glu | Y = 30 700X - 10 800 | 0.999 1 | 91.8 ~ 101.9 | 3.38 ~ 3.97 | 0.000 3 | 0.001 |
18 | Myr | Y = 2 010X - 2 740 | 0.997 0 | 91.8 ~ 104.1 | 4.71 ~ 5.61 | 0.001 5 | 0.005 |
19 | Mor | Y = 13 400X - 6 650 | 0.998 1 | 97.3 ~ 101 | 1.79 ~ 2.13 | 0.000 3 | 0.001 |
20 | Fis | Y = 4 240X + 9 630 | 0.998 6 | 91.6 ~ 99.2 | 2.86 ~ 3.39 | 0.000 3 | 0.001 |
21 | Api | Y = 18 500X + 3 510 | 0.998 3 | 94.9 ~ 99.1 | 1.73 ~ 2.03 | 0.000 3 | 0.001 |
22 | Pro B1 | Y = 1 530X - 192 | 0.996 9 | 98.9 ~ 99.6 | 0.26 ~ 0.31 | 0.001 5 | 0.005 |
23 | Pro B2 | Y = 2 000X + 406 | 0.999 0 | 94.8 ~ 102 | 2.60 ~ 3.07 | 0.000 3 | 0.001 |
24 | Lut | Y = 5 770X - 4 240 | 0.955 1 | 96.8~101.1 | 1.78 ~ 2.09 | 0.000 3 | 0.001 |
25 | Pic | Y = 11 400X + 5 670 | 0.997 3 | 91.8 ~ 99.1 | 3.00 ~ 3.55 | 0.000 3 | 0.001 |
26 | Vit | Y = 18 200X - 7 350 | 0.997 7 | 99.1 ~ 103 | 1.36 ~ 1.60 | 0.000 3 | 0.001 |
27 | VA | Y = 5 590X + 633 | 0.999 2 | 91.6 ~ 99.1 | 2.78 ~ 3.26 | 0.001 5 | 0.005 |
28 | Vin | Y = 3 790X - 2 910 | 0.994 8 | 92.3 ~ 98.1 | 2.23 ~ 2.66 | 0.001 5 | 0.005 |
29 | But | Y = 95 700X - 931 00 | 0.995 9 | 94.3 ~ 102 | 2.8 3~ 3.38 | 0.000 3 | 0.001 |
表5 实际样品中单体酚测定结果及稀释倍数(n = 27)
Table 5 Determination Results and Dilution Times of Monomer Phenol in Actual Samples ( n = 27 )
序号 | 单体酚 | 干红葡萄酒/(mg/L) | 桃红葡萄酒/(mg/L) | 干白葡萄酒/(mg/L) | 稀释倍数 |
1 | PA | 1.880 ~ 12.000 | 3.530 | 0.417 ~ 1.420 | 50 |
2 | p-CA | 1.810 ~ 8.470 | 4.930 | 0.777 ~ 5.810 | 50 |
3 | VA | 1.950 ~ 9.610 | 2.010 | 0.128 ~ 0.573 | 50 |
4 | GA | 14.400 ~ 78.500 | 15.400 | 0.351 ~ 3.050 | 500 |
5 | CAA | 4.240 ~ 14.100 | 13.200 | 2.160 ~ 6.620 | 100 |
6 | FA | 0.230 ~ 0.974 | 1.000 | 0.285 ~ 1.470 | 10 |
7 | cis-Res | 0.529 ~ 5.960 | 0.834 | - | 50 |
8 | trans-Res | 0.295 ~ 8.730 | 1.120 | - | 50 |
9 | Pic | 0.081 ~ 0.141 | 3.970 | 0.000~1.790 | 10 |
10 | CA | 9.040 ~ 50.080 | 21.100 | 1.380 ~ 5.700 | 500 |
11 | EA | 6.120 ~ 45.500 | 17.200 | 0.610 ~ 5.130 | 500 |
12 | Que | 0.470 ~ 17.300 | 6.220 | 0.019 ~ 6.21 | 50 |
13 | EGC | 0.651 ~ 9.280 | 1.000 | 0.076 ~ 1.470 | 100 |
14 | Myr | 4.120 ~ 55.700 | 0.579 | 0.000 ~ 0.136 | 500 |
15 | Res-3-Gly | 0.485 ~ 6.000 | 0.860 | 0.000 ~ 0.528 | 10 |
16 | Que-3-Glu | 0.086 ~ 5.050 | 0.511 | 0.000 ~ 0.763 | 10 |
17 | Pro B1 | 9.570 ~ 77.300 | 8.080 | 0.241 ~ 3.910 | 500 |
18 | Pro B2 | 4.540 ~ 49.900 | 7.050 | 0.000 ~ 1.440 | 500 |
19 | 总计 | 75.560 ~ 331.243 | 108.594 | 8.671 ~ 39.244 |
|

图3 3种不同类型葡萄酒总离子流与标准品对照图
Fig. 3 Comparison chart of total ion current and standard for three different types of wine