1绪论
1.1研究对象
黄曲霉毒素B1的毒性高于氰化钾毒性,而且具有极强的致癌性、致突变性及致畸性。黄曲霉毒素B1耐热,280℃才可裂解,故一般烹调加工温度下难以破坏。黄曲霉毒素的污染可导致严重的婴幼儿急性、慢性中毒和癌症,导致生长障碍、肝脏损伤和肝癌等脏器损伤,甚至死亡[1]。特殊医学用途全营养配方食品是为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工配制而成的配方食品[2]。其配方及基质复杂,严格控制原料的质量安全,同时按照GB 29922-2013食品安全国家标准 特殊医学用途配方食品通则的要求对特殊医学用途全营养配方食品黄曲霉毒素B1进行重点监控检测,保障终端产品安全。本文旨在对黄曲霉毒素B1检验方法进行研究,对标准曲线低浓度、检出限浓度、定量限浓度在仪器上灵敏度及响应值低不易检出、难积分的风险问题进行分析验证,并得出有效结论。
1.2立题依据
高效液相色谱-柱后衍生法检测食品中的黄曲霉毒素B1,适用于谷物及其制品、豆类及其制品、坚果及籽类、油脂及其制品、调味品、婴幼儿配方食品和婴幼儿辅助食品[3]。研究表明,高效液相色谱法是当前在黄曲霉毒素定量检测方面有着相当应用广度的方法。此种方法将样品中的黄曲霉毒素B1经柱层析分离后,通过测量色谱峰的面积实现定量检测。高效液相色谱法在实际应用过程中表现出灵敏、准确并且重复性好等多方面优点,并且适合食品中四种黄曲霉毒素含量的检测[4]。依据GB 5009.22-2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》为特殊医学用途全营养配方食品中黄曲霉毒素B1检测方法应用提供有效依据。对检测方法的线性关系、回收率、检出限、定量限、精密度进行验证,结果均符合GB/T27404-2008实验室质量控制规范 食品理化检测[5]的要求。
2材料
2.1仪器
Agilent高效液相色谱仪(安捷伦科技(中国)有限公司)、KRC光化学柱后衍生器(青岛普瑞邦生物工程有限公司)、BSA224S-CW万分之一电子天平(赛多利斯科学仪器(北京)有限公司)、BL-220H千分之一电子天平(日本岛津)、TGL-10B高速离心机(上海安亭科学仪器厂)、固相萃取装置(青岛普瑞邦生物工程有限公司)、方形水浴氮吹仪(上海习仁科学仪器有限公司)。
2.2试剂、标准品、耗材
色谱纯甲醇(20211224)、分析纯氯化钠(20210310)、分析纯磷酸氢二钠(20171127)、优级纯磷酸二氢钾(20201209)、分析纯氯化钾(20210114)、分析纯盐酸(20200715)、优级纯吐温-20(20170323)、一次性微孔滤头(20211109)购自国药集团化学试剂有限公司、色谱纯乙腈(203023)购自Thermo Fisher、黄曲霉毒素B1标准品CAS号1162-65-8(21040251)购自坛墨质检科技股份有限公司、玻璃纤维滤纸(50150030)购自上海安谱实验科技股份有限公司、免疫亲和柱(P0828B1)购自北京华安麦科生物技术有限公司、水为GB/T 6682-2008[6]规定的一级水。
3方法与结果
3.1特殊医学用途全营养配方食品中黄曲霉毒素B1的测定
3.1.1色谱条件:
a)流动相:水:乙腈-甲醇( 50+50 )=68%:32%
b)色谱柱:C18柱(柱长250mm,柱内径4.6mm,填料粒径5μm);
c)流速:1.0mL/min;
d)柱温:40℃;
e)进样量:50μL;
f)光化学柱后衍生器;
g)高效液相色谱仪配有配荧光检测器激发波长:360nm;发射波长:440nm;
3.1.2标准溶液的配制:
a)标准储备液(100ng/mL):准确移取黄曲霉毒素B1标准储备溶液(10μg/mL)1mL至100mL容量瓶中,乙腈定容。密封后避光-20℃下保存,三个月内有效。
b)标准系列工作溶液:准确移取标准工作液10μL、50μL、200μL、500μL、1000μL、2000μL、4000μL至10mL容量瓶中,用初始流动相定容至刻度,即得黄曲霉毒素B1浓度为0.1ng/mL、0.5ng/mL、2.0ng/mL、5.0ng/mL、10.0ng/mL、20.0ng/mL、40.0ng/mL的系列标准溶液。
3.1.3样品制备
称取5g试样(精确至0.01g)于50mL离心管中,加入甲醇-水溶液(70+30),涡旋混匀,置于超声波振荡器20min,在6000r/min下离心10min,取上清液备用。准确移取4mL上述上清液,加入23mL吐温-20的PBS,混匀。将低温下保存的免疫亲和柱恢复至室温。免疫亲和柱内的液体放弃后,将上述样液移至50mL注射器筒中,调节下滴速度,控制样液以1mL/min~3mL/min的速度稳定下滴。待样液滴完后,往注射器筒内加入2×10mL水,以稳定流速淋洗免疫亲和柱。待水滴完后,用真空泵抽干亲和柱。脱离真空系统,在亲和柱下部放置西林瓶,取下50mL的注射器筒,2×1mL甲醇洗脱亲和柱,控制1mL/min~3mL/min的速度下滴,再用真空泵抽干亲和柱,收集全部洗脱液至西林瓶中。在50℃下用氮气缓缓地将洗脱液吹至近干,用初始流动相定容至1.0mL,涡旋30s溶解残留物,0.22μm滤膜过滤,收集滤液于进样瓶中以备进样。不称取试样,同法制备空白试验。
3.1.4线性关系考察
将黄曲霉毒素B1系列标准工作溶液由低到高浓度依次进样检测,以峰面积为纵坐标、浓度为横坐标绘制标准曲线。在色谱积分过程中发现标准曲线第一点0.1ng/mL目标峰不明显,响应值低几乎接近设备噪声,强制手动积分会导致线性偏离或拟合程度失信,影响检验结果。
3.1.5试样溶液的测定
待测样液中待测化合物的响应值应在标准曲线线性范围内,浓度超过线性范围的样品则应稀释后重新进样分析。试样中黄曲霉毒素B1的残留量按公式计算:
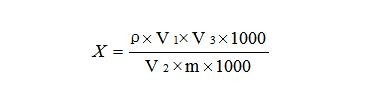
式中:
X——试样中黄曲霉毒素B1的含量,μg/Kg;
ρ——进样液中黄曲霉毒素B1按照外标法在标准曲线中对应的浓度,单位为纳克每毫升(ng/mL);
V1——试样提取液体积,mL;
V3——样品经免疫亲和柱净化洗脱后的最终定容体积,单位为毫升( mL );
V2——用于免疫亲和柱的分取样品体积,单位为毫升( mL );
1000——换算系数;
m——试样的称样量,g;
3.1.6数据分析
GB 5009.22-2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》第三法 高效液相色谱-柱后衍生法,检出限为0.03μg/kg,定量限为0.1μg/kg。分析对比浓度关系,检出限低于标准系列工作溶液最低点(0.1ng/mL),定量限相当于标准系列工作溶液最低点(0.1ng/mL)。而标准系列工作溶液最低点(0.1ng/mL)上机检测目标峰不明显,响应值低几乎接近设备噪声。所以规定的检出限、定量限按照现在的检验参数不易检出、很难积分。并采用加标回收的方式对检出限0.03μg/kg,定量限0.1μg/kg进行验证。色谱峰均不能有效积分。
对检验方法中的参数条件进行分析,GB 5009.22-2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》第三法 高效液相色谱-柱后衍生法中规定待测样液中待测化合物的响应值应在标准曲线线性范围内,浓度超过线性范围的样品则应稀释后重新进样分析。若提高标准曲线最低点浓度可进行有效积分,但黄曲霉毒素B1为真菌毒素,且GB 2761-2021《食品安全国家标准 食品中真菌毒素限量》中标准限值为≤0.5μg/Kg。提高标准曲线最低点浓度,不能保证样品中黄曲霉毒素B1完全检出,存在食品安全风险。
分析方法中流动相、进样量均为色谱参考条件。以调整流动相比例、增加进样量、减少样品稀释倍数来控制变量,来弥补黄曲霉毒素B1在仪器设备响应值低的缺陷,设计了实验进行分析如表1:
表1分析实验设计
Table 1 Analysis Experiment Design
项目 | GB 5009.22-2016色谱条件 | 调整后色谱条件 |
色谱参考条件 |
流动相比例:
水:乙腈-甲醇( 50+50 )=68%:32% |
流动相比例:
水:乙腈-甲醇( 50+50 )=60%:40% |
进样量:50μL |
进样量:80μL |
对上机后标准曲线进行分析,流动相比例为水:乙腈-甲醇( 50+50 )=68%:32%调整为水:乙腈-甲醇( 50+50 )=60%:40%,即增加有机相比例,提高流动相极性,目标峰出峰时间提前。出峰速度快,色谱峰两个拐点的切线在基线上截距间的距离减少,在设备对黄曲霉毒素B1响应值不变的前提下峰高增加,同时进样量由50μL调整为80μL也提高了仪器设备的响应值。并使用该方法制作标准曲线,得到标准曲线回归方程式为y=5375837.2661x-194170.2330(R2=1.0000)如图1,结果表明在0.1ng/L~40.0 ng/L范围内呈良好的线性关系。
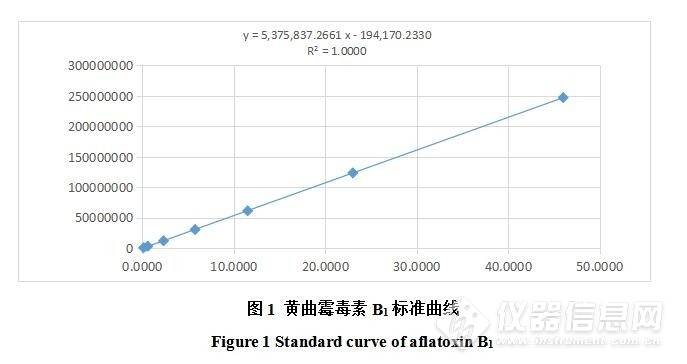
图1 黄曲霉毒素B1标准曲线
Figure 1 Standard curve of aflatoxin B1
3.2样品测定
对特殊医学用途全营养配方食品样品按照3.1.3过程进行处理,同时将准确移取4mL上清液,调整为移取10mL上清液,即增加用于免疫亲和柱的分取样品体积,以减少样品稀释倍数。用3.1.5过程进行计算,结果均未检出,符合GB 29922-2013食品安全国家标准 特殊医学用途配方食品通则要求。检验结果如表2:
表2检测结果
Table 2 Test Results
样品名称 | 样品编号 | 检测结果,μg/Kg | 检测结果平均值,μg/Kg |
特殊医学用途全营养配方食品 | 1 | 未检出 | 未检出 |
2 | 未检出 |
3.3加标回收率实验(检出限、定量限验证)
准备4个梯度加标样品,分别加入已知含量标准溶液。配置成检出限浓度0.03μg/Kg、定量限浓度0.1μg/Kg、随机选取一点浓度0.2μg/Kg、国标限量浓度0.5μg/Kg进行回收率实验。
对以上样品按照调整后条件进行检测。用测得量减去样品中的含量,并除以加标量。得到黄曲霉毒素B1检出限浓度0.03μg/Kg能够有效积分,且S/N值为3.0;定量限浓度0.1μg/Kg能够有效积分,且S/N值为7.3,回收率为69%;随机选取一点浓度0.2μg/Kg能够有效积分,回收率为100%;随机选取国标限量浓度0.5μg/Kg能够有效积分,回收率为74%。回收率结果均符合GB/T 27404中附录F中60%~120%范围的标准要求。表明本方法准确度好、灵敏度高,加标回收率实验(检出限、定量限验证)结果如表3:
表3样品加标回收率实验
Table 3 Sample spiking recovery rate experiment
样品编号 | 样品本底含量,mg | 加标量,mg | 测得量,mg | 加标回收率,% | 平均回收率,% |
1-1 | 0 | 0.09777 | 0.064523 | 65.99 | 69 |
1-2 | 0 | 0.09777 | 0.061363 | 62.76 |
1-3 | 0 | 0.09777 | 0.071259 | 72.88 |
1-4 | 0 | 0.09777 | 0.074496 | 76.20 |
1-5 | 0 | 0.09777 | 0.066477 | 67.99 |
1-6 | 0 | 0.09777 | 0.066277 | 67.79 |
2-1 | 0 | 0.1955 | 0.19884 | 101.71 | 100 |
2-2 | 0 | 0.1955 | 0.20075 | 102.69 |
2-3 | 0 | 0.1955 | 0.19582 | 100.16 |
2-4 | 0 | 0.1955 | 0.19651 | 100.52 |
2-5 | 0 | 0.1955 | 0.18979 | 97.08 |
2-6 | 0 | 0.1955 | 0.19403 | 99.25 |
3-1 | 0 | 0.4946 | 0.37336 | 75.49 | 74 |
3-2 | 0 | 0.4946 | 0.36375 | 73.54 |
3-3 | 0 | 0.4946 | 0.34956 | 70.69 |
3-4 | 0 | 0.4946 | 0.37416 | 75.65 |
3-5 | 0 | 0.4946 | 0.36013 | 72.81 |
3-6 | 0 | 0.4946 | 0.37510 | 75.84 |
3.4精密度测试
利用3.3加标回收率实验过程,计算在重复性条件下获得测定结果的RSD分别为7.1%、2.0%、0.8%(n=6)。结果均符合GB/T 27404-2008 实验室质量控制规范 食品理化检测中≤30%的标准要求。表明该方法精密度重复性良好。
4讨论
GB 5009.22-2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》第三法 高效液相色谱-柱后衍生法,对特殊医学用途全营养配方食品中的黄曲霉毒素B1中含量进行了测定。按照原有参考条件标准曲线低浓度点很难有效积分。原因可能为浓度低,仪器设备响应值偏低或缺陷。通过设计实验,提高色谱参考条件中流动相比例中有机相比例(水:乙腈-甲醇( 50+50)=68%:32%调整为水:乙腈-甲醇( 50+50 )=60%:40%)、增加仪器设备进样量(50μL调整为100μL)、增加用于免疫亲和柱的分取样品体积(4mL调整为10mL),以减少样品稀释倍数。来提高仪器设备的响应值。为确保实验的可信度,对线性关系进行了验证考察,结果表明范围内呈良好的线性关系;对加标回收率实验(检出限、定量限验证)进行了测试验证,结果表明本方法准确度好、灵敏度高;对方法精密度进行了测试,结果表明该方法精密度重复性良好。
综上所述,调整了流动相比例,增加进样量、增加用于免疫亲和柱的分取样品体积以减少样品的稀释倍数,提高了仪器设备响应值。整个测定方法简单易行,结果准确。本文可为后续按照GB 5009.22-2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》第三法 高效液相色谱-柱后衍生法,检测特殊医学用途全营养配方食品中黄曲霉毒素B1提供一定的参考。
参考文献
[1]GB 29923-2013 食品安全国家标准特殊医学用途配方食品良好生产规范系列标准实施指南[J].
[2]GB 29922-2013 食品安全国家标准 特殊医学用途配方食品通则[S].
[3]GB 50090.22-2016 食品安全国家标准食品中黄曲霉毒素B族和G族的测定[S].
[4]高磊.黄曲霉毒素B1的常见检验方法分析[J].中外食品工业,2014,16-0035-02.
[5] GB/T 27404-2008 实验室质量控制规范 食品理化检测[S].
[6] GB/T 6682-2008 分析实验室用水规格和试验方法[S].