外泌体是由不同细胞分泌的纳米大小的囊泡,在细胞内通讯和物质转运中发挥重要作用。由于其独特的结构和组成特征,外泌体具有优异的生物相容性,源自不同细胞的外泌体继承了亲本细胞的天然生物学特征,具有低免疫原性和克服生物屏障的能力,已被广泛用作肿瘤治疗的天然药物和递送载体。然而,大多数外泌体由于靶向效率低、治疗效果不理想、产量低等挑战,限制了其应用。探索具有多功能且强大的生物学功能的外泌体并对其进行工程改造以提高治疗效果势在必行。


就在2024新年的第一天,中国农业科学院特产研究所彭英华研究员团队在Chemical Engineering Journal期刊(IF=16.7)上发表题为“工程化鹿茸干细胞外泌体通过重组免疫抑制性肿瘤微环境增强免疫检查点抑制物的抗肿瘤功效”的文章。这项研究中,作者构建了鹿茸工程外泌体,称为M2Pep-Exo(pIC),是通过在ASCs外泌体表面用M2巨噬细胞靶向肽 (M2Pep) 修饰,并将Toll样受体 3 (TLR3) 激动剂poly(I:C) 包装其内开发而成,用于增强肿瘤免疫治疗。由于鹿茸的肿瘤抗性和年度生长的特点而易于获取,源自 ASCs 的外泌体作为天然纳米载体具有抑制肿瘤生长的巨大潜力。M2Pep-Exo(pIC)在肿瘤组织中实现了更好的富集,并可以通过使肿瘤相关巨噬细胞 (TAM) 的重极化和促进树突状细胞 (DCs) 的生长来增强机体抗肿瘤免疫反应。导致肿瘤部位的细胞毒性 CD8+ T 细胞浸润增加,从而实现有效的抗肿瘤治疗。此外,M2Pep-Exo(pIC) 与PD-L1抗体的组合不仅可以阻止原发肿瘤的进程,还可以抑制肿瘤的转移。这些发现强调了通过重塑免疫抑制性肿瘤微环境 (TME) 来增强PD-L1检查点屏障活性的一种极具前景的方法,从而实现实体瘤更大效果的免疫治疗。
鹿茸干细胞的分离和表征
ASCs是从梅花鹿鹿茸的中干细胞层中分离而来。倒置显微镜下观察,ASCs贴在培养皿上,呈长梭形漩涡状排列,与MSCs特征形态一致。流式细胞术和免疫荧光分析的数据显示,ASCs表达MSCs标志蛋白CD44和CD90,且CD44和CD90的阳性率均超过98%(图1A和B),确认其为 MSCs。此外,ASC还具有脂肪细胞、骨细胞和软骨细胞三系分化的能力。
M2Pep-Exo(pIC) 的合成与表征
M2Pep-Exo(pIC)合成示意图如图2所示。首先,通过超速离心法从ASCs培养上清液中分离出Exo外泌体。然后,通过 DSPE-PEG-M2Pep 和 Exo 的简单共孵育制备 M2Pep-Exo,其中 DSPE-PEG-M2Pep 包含烷基链会自动锚定到外泌体膜上的脂筏上。随后,通过超声处理的方法将poly(I:C) 封装到M2Pep-Exo中,构建M2Pep-Exo(pIC)。封装的poly(I:C) 进一步增强了M2-TAM的重极化潜力,同时促进了DCs的成熟。Exo、M2Pep-Exo 和 M2Pep-Exo(pIC) 在 透射电镜 图像上均表现出明显的杯状和双层膜囊泡(图 1)。在所有亲本外泌体和工程外泌体中观察到的形态和结构相似性证明,M2Pep的修饰和 pIC 的封装对外泌体的形态和完整性没有明显的影响。
通过NanoCoulter纳米库尔特颗粒分析仪测定了各囊泡的大小。 Exo、M2Pep-Exo 和 M2Pep Exo(pIC) 的平均尺寸分别为 66.0 nm、71.0 nm 和 85.0 nm(图 1)。修饰后的外泌体的尺寸与典型的外泌体尺寸保持一致。由于 pIC 的加载,M2Pep-Exo(pIC)比 Exo 和 M2Pep-Exo 表现出更大的尺寸。Western Blot证实了所有样本中均存在外泌体标记蛋白(Alix、TSG101和CD81),也证明外泌体已成功从ASC中分离出来并且经过M2Pep修饰和PICC封装后,外泌体的完整性并未被破坏。此外,如图1K 展示了Exo 的 负电荷特性(zeta 电位为 –22.0 ± 4.2 mV,其稳定性将延长血液循环,有助于下游生物学应用;由于 Exo膜 和 M2Pep 的结合,M2Pep-Exo 的 zeta 电位从 降至至 – 11.0 ± 2.8 mV;相比之下封装在囊泡内的poly(I:C)并不改变M2Pep-Exo(pIC) 的表面 zeta 电位 (-13.0 ± 2.8 mV)。以上单颗粒电位的定量检测均来自于NanoCoulter纳米库尔特颗粒分析仪的zeta电位功能。
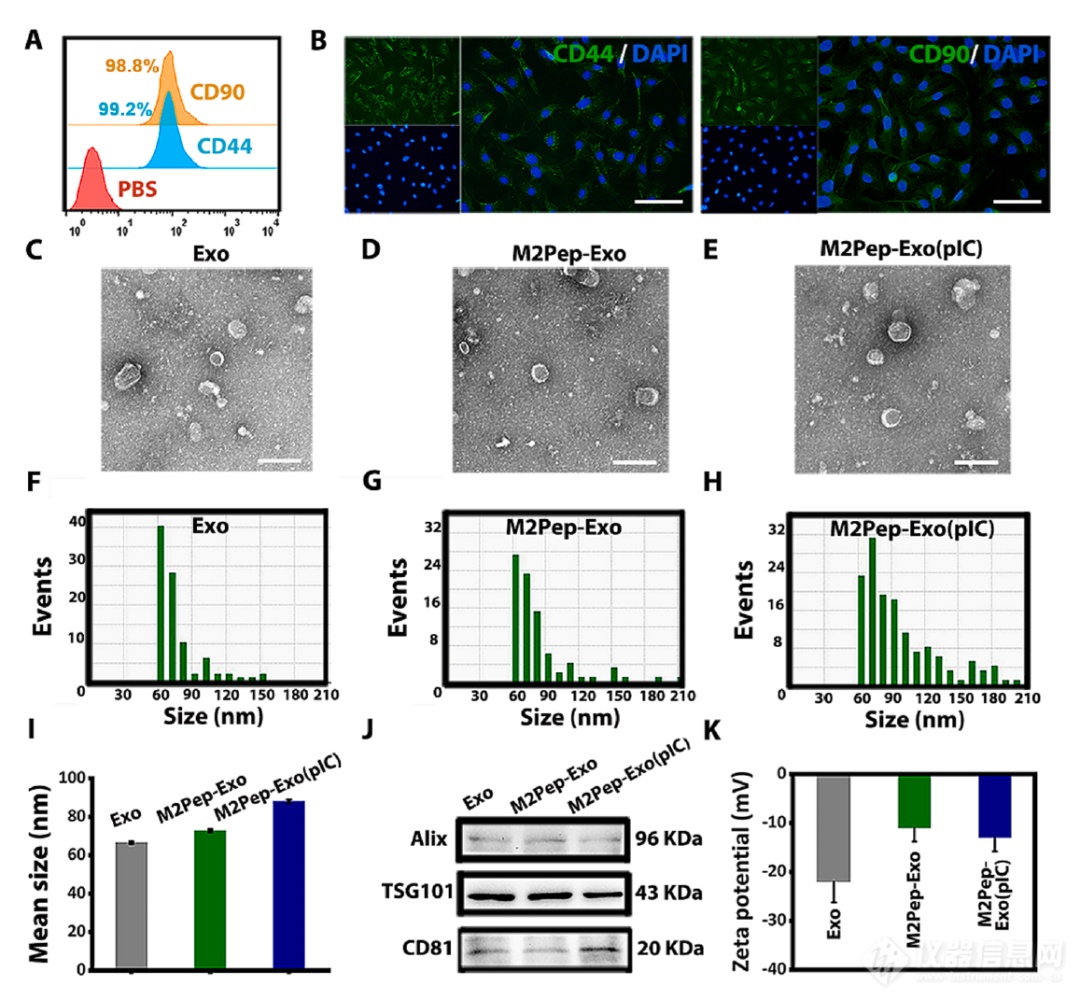
图1. ASCs 的鉴定以及 Exo、M2Pep-Exo 和 M2Pep-Exo(pIC) 的表征。(A, B) 通过流式细胞术和免疫荧光染色鉴定ASCs表面标志蛋白 (CD44 和CD90) 的表达;分别通过 TEM 检测 Exo、M2Pep-Exo 和 M2Pep-Exo(pIC) 的形态 (C-E) ,通过NanoCoulter颗粒分析仪外泌体的尺寸分布 (F-H);(I) 通过纳米流式细胞术检测Exo、M2Pe p-Exo 和M2Pep -Exo(pIC)的平均大小;(J) 通过Western Blot分析外泌体特异性蛋白(Alix、TSG101 和 CD81)的表达。(K) NanoCoulter颗粒分析仪测试 Exo、M2Pep-Exo 和 M2Pep-Exo(pIC)的 zeta 电位。
M2Pep-Exo 体外靶向
体外TAMs重极化诱导抗肿瘤活性
人们普遍认为,重极化的M1-TAM分泌的经典促炎症细胞因子可以诱导免疫激活和抗肿瘤活性。为此,作者使用CCK-8检测transwell 系统下室中4T1细胞的细胞活力。正如预期的那样,M2Pep-Exo(pIC)的处理对4T1 细胞表现出显着的增殖抑制作用,说明其诱导的TAM重新编程可以诱导针对肿瘤细胞的细胞毒性。同时作者从4T1细胞中提取了总蛋白并通过Western Blot实验发现了M2Pep-Exo(pIC) 相比其他各组大大增强了促凋亡蛋白 (Caspase 3 和 Bax) 的表达,并降低了抗凋亡蛋白 (Bcl-XL) 的表达水平。这些发现都强烈表明 M2Pep-Exo(pIC)可以有效地恢复抗炎症性M2-TAMs转变为促炎症性M1型,导致体外肿瘤细胞增殖抑制和凋亡。
M2Pep-Exo(pIC) 体外激活 DCs
体内M2Pep-Exo(pIC) 的抗肿瘤作用
M2Pep-Exo(pIC) 体内激活免疫反应的评价
M2Pep-Exo(pIC) 联合PD-L1抗体的体内转移肿瘤抑制作用
理想的肿瘤治疗不仅应破坏原发肿瘤,而且还要有效抑制或消除转移部位残留的肿瘤细胞。PD-L1检查点抑制剂具有通过抑制CTLs耗竭来增强抗肿瘤免疫反应的能力。将 PD-L1 阻断与其他治疗药物相结合被认为是消除转移部位残留肿瘤细胞的一种有前景的方法。53.54 。因此,受以上工程化外泌体重组免疫抑制TME结果的鼓舞,作者进一步评估了M2Pep-Exo(pIC) 与抗PD-L1抗体治疗相结合的对于远距离转移肿瘤的治疗潜力。在开发的“双侧”4T1 荷瘤小鼠模型(在原发性肿瘤植入7天后将人工转移肿瘤植入右侧)实验中,对照组相比,单独的PD-L1抗体治疗稍微推迟了原发肿瘤的生长,并且在转移肿瘤中显示出有限的疗效,而M2Pep-Exo(pIC) 治疗明显延迟了原发性和远端肿瘤的进程。值得注意的是,M2Pep-Exo(pIC)与PD-L1抗体的组合不仅极大地抑制了原发肿瘤,而且还显著地抑制了远端肿瘤的生长,在两个位置均获得了最大的肿瘤重量和体积的下降,在所有实验组中诱导了最明显的肿瘤细胞凋亡。同时,M2Pep-Exo(pIC)结合PD-L1抗体的治疗不仅可以提高原发性肿瘤中CTLs细胞的比例,而且在远端肿瘤中与单一治疗组相比均表现出显著的CTLs浸润增加,并表现出最大浓度的促炎症细胞因子(TNF-α、IL-6 和 IFN-γ)水平。因此,联合治疗可重建免疫抑制TME并增强CTLs的浸润,有效地激活抗肿瘤免疫反应,从而实现对原发性和转移性肿瘤的卓越协同抑制。
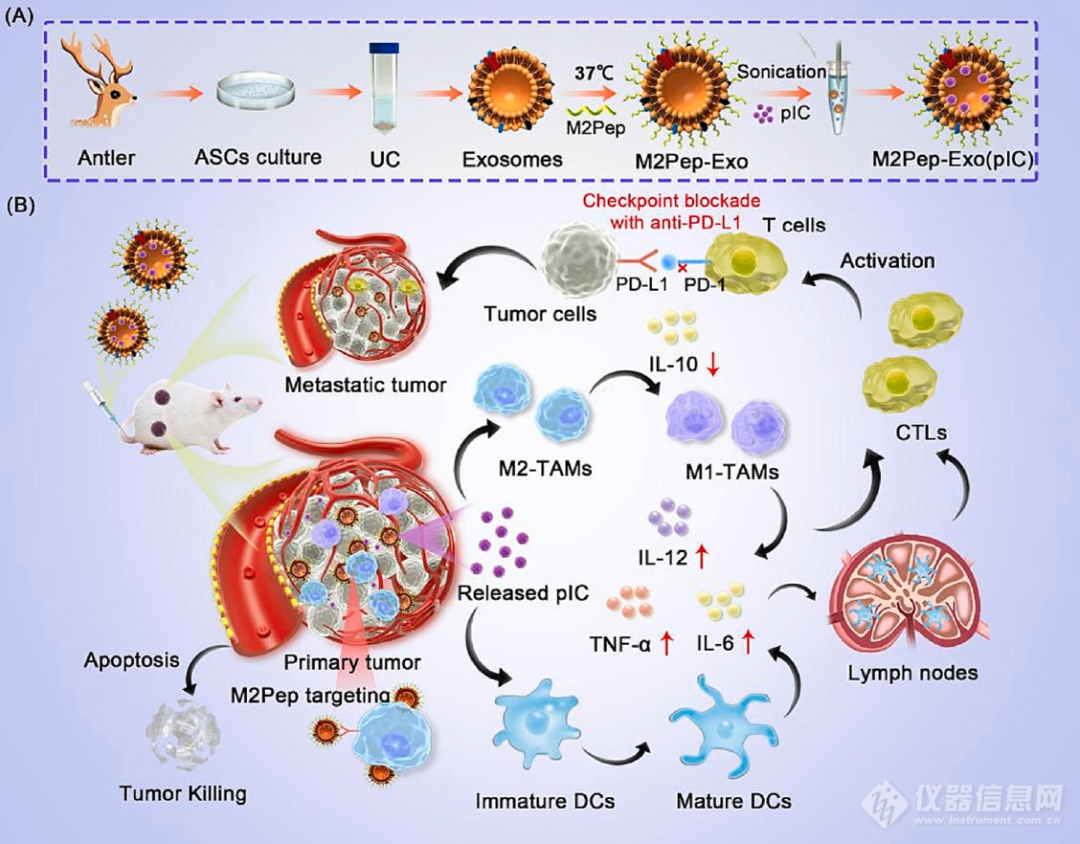
结论
作者成功构建了一种高效且生物相容的基于外泌体的工程纳米药物递送系统——用 M2 巨噬细胞靶向肽 M2Pep 进行修饰,并用 TLR3 激动剂 poly(I:C)封装的鹿茸干细胞来源外泌体最有效地靶向 M2-TAM,从而增强肿瘤部位的外泌体和 poly(I:C) 富集。M2Pep-Exo(pIC) 可以通过重极化 M2-TAM 来重建免疫抑制性 TME转变为 M1-TAM并诱导 DC 成熟,从而促进促炎症细胞因子的释放和 CTLs 的浸润,实现有效的癌症治疗。此外,与PD-L1免疫检查点阻断联合治疗时,M2Pep-Exo(pIC)不仅可以抑制原发肿瘤,还可以抑制转移肿瘤(图2)。该工作为治疗转移性恶性肿瘤提供了一种有前景的联合用药方案。

文献速递| 使用电阻脉冲感应方法评估五种细胞外囊泡分离方法的质量和效率
粒径分布计算用PDI还是SPAN? 别再傻傻分不清了
【Nature子刊】改进与优化基于NTA的EV单颗粒荧光标记及检测方法
干货:MISEV2023指南解读(一):EV的表征
相关产品

关注

拨打电话

留言咨询