一次性单细胞蛋白质组和代谢组同步分析策略
导读:文章提出了一种新策略scPMA,能在单次分析中同时获取单个细胞的蛋白质和代谢物信息,有助于深入理解细胞状态调控机制,已在《Analytical Chemistry》发表。
细胞异质性作为细胞系统中一种普遍存在的现象,受到生物研究领域的日益关注。在传统的群体分析中,单个细胞的独特差异往往被整体的平均值所掩盖,而这些被忽略的细节恰恰构成了细胞分化过程中的关键线索。随着微阵列芯片、核酸测序、质谱等技术的进步,对单一细胞进行基因组、转录组、代谢组和蛋白组分析已不再遥不可及。特别是核酸扩增技术的进步极大地推动了基因组、转录组在单细胞层面的测序技术的应用。尽管取得了这些进步,但在单细胞层面对蛋白质和代谢物的分析仍然面临重大挑战,这主要是由于它们的量有限且缺少有效的扩增手段。本文提出了一种新的策略,通过一次性单细胞蛋白质组和代谢组分析(scPMA),可以在单次LC-MS/MS分析中同时获取单个细胞的蛋白质和代谢物信息。通过这种策略,研究人员能够整合单个细胞的多组学数据,以深入理解细胞内部相互作用的网络和调控细胞状态的复杂机制。
scPMA策略共包括以下三个部分(图1):单细胞捕获及分离、纳升级样品预处理、一次性LC注入和质谱检测。前两个环节都是基于课题组前期自制的机械装置操作完成的,最后一部分才是scPMA策略的亮点。在常规分析流程中,由于蛋白质组和代谢组在物理化学特性上的根本差异,它们通常需要匹配不同的质谱检测技术。因此,在传统的样本预处理阶段,蛋白质和代谢物会被分离,随后各自经历特定的处理流程,并最终分别进行LC-MS/MS检测。然而,这些额外的分离和处理步骤不仅增加了分析的复杂性,而且往往不可避免地会导致样本的损失,特别是在处理单细胞水平的微量样本时,这种损失尤为显著,可能对研究结果的准确性和可靠性造成影响。基于此,作者希望能够开发一种易于使用的方法来实现同一单细胞个体的蛋白质组和代谢组同步分析。
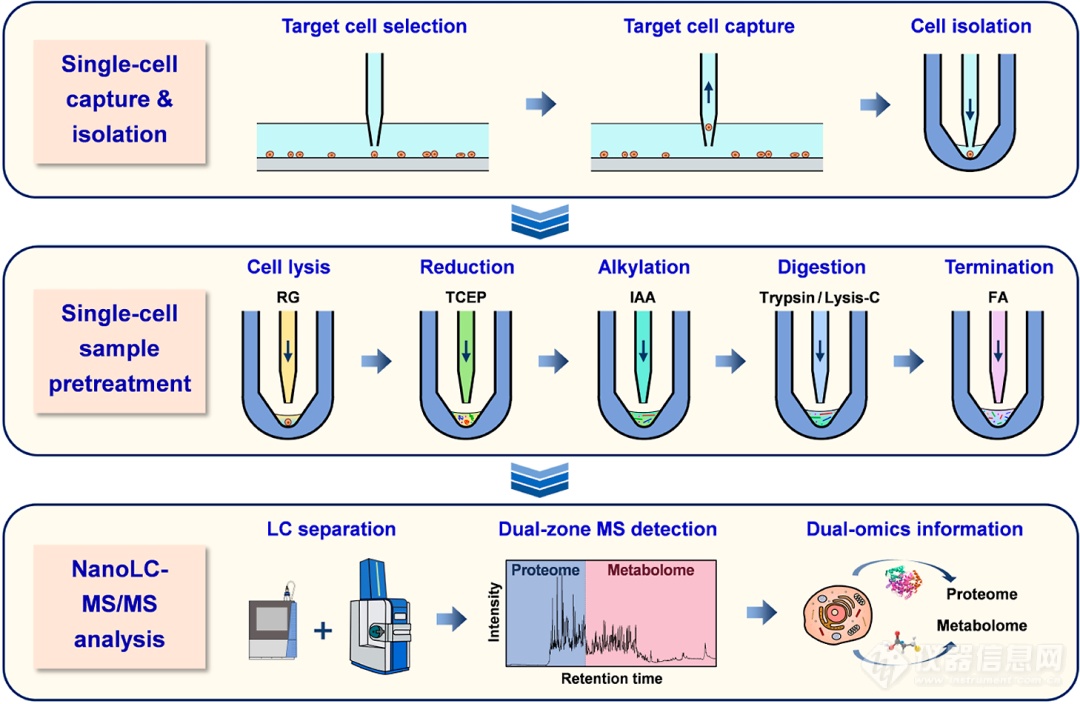
图1 一次性单细胞蛋白质组和代谢组同步分析示意图
实际上,代谢物和蛋白酶切后的肽段在C18反相色谱柱上的保留时间是存在差异的。如图2所示,在作者设置的45 min梯度下,大部分A549细胞酶切的肽段在9至17 min的范围内就已流出(图2a),而此时流动相中乙腈的最高含量仅为40%。而A549细胞产生的代谢物则主要分布在17 min之后,只有极少部分是在17 min以前流出(<10)(图2b)。导致这些现象的根本原因是肽段与代谢物之间疏水性的差异,因此,该策略更适合蛋白组与有一定疏水性的代谢物分析。得益于C18的有效分离,可以在色谱梯度的不同时间段针对不同的样本成分(肽段/代谢物)设置不同的质谱检测参数(图2c)。有效的色谱分离加与之匹配的双区域质谱检测便可实现一次性单细胞蛋白质组和代谢组双重分析。与之前的单组学的结果相比,scPMA策略在定量深度上并无明显差异(图2d-f)。
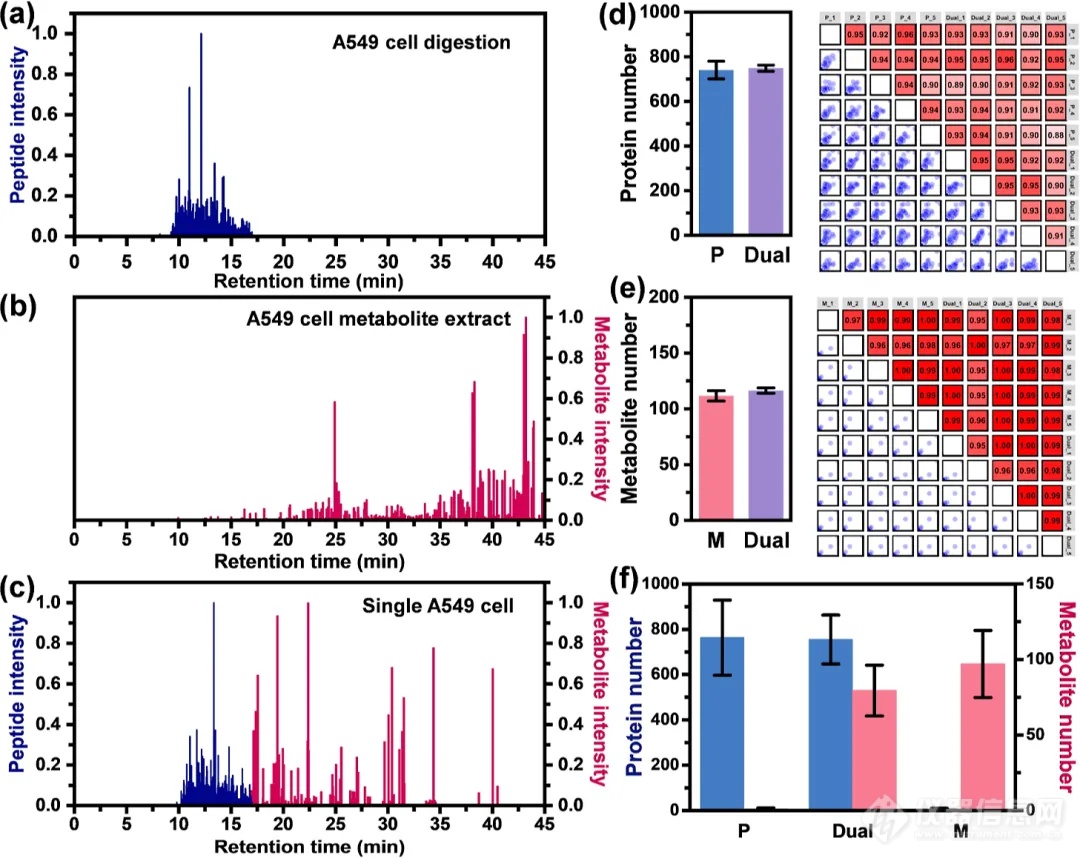
图2 单蛋白质组和代谢组分析与scPMA的性能比较
通过scPMA策略,研究者们能够对单个肿瘤细胞(包括A549、HeLa和HepG2细胞)进行双重组学分析,平均定量了816、578和293个蛋白质以及72、91和148个代谢物。并利用UMAP聚类和随机森林机器学习模型,基于单细胞的蛋白质组、代谢组和双重组学信息,实现了对细胞类型的初步分类(图3、4)。根据结果可得知,细胞在代谢组中的异质性要大于蛋白组。
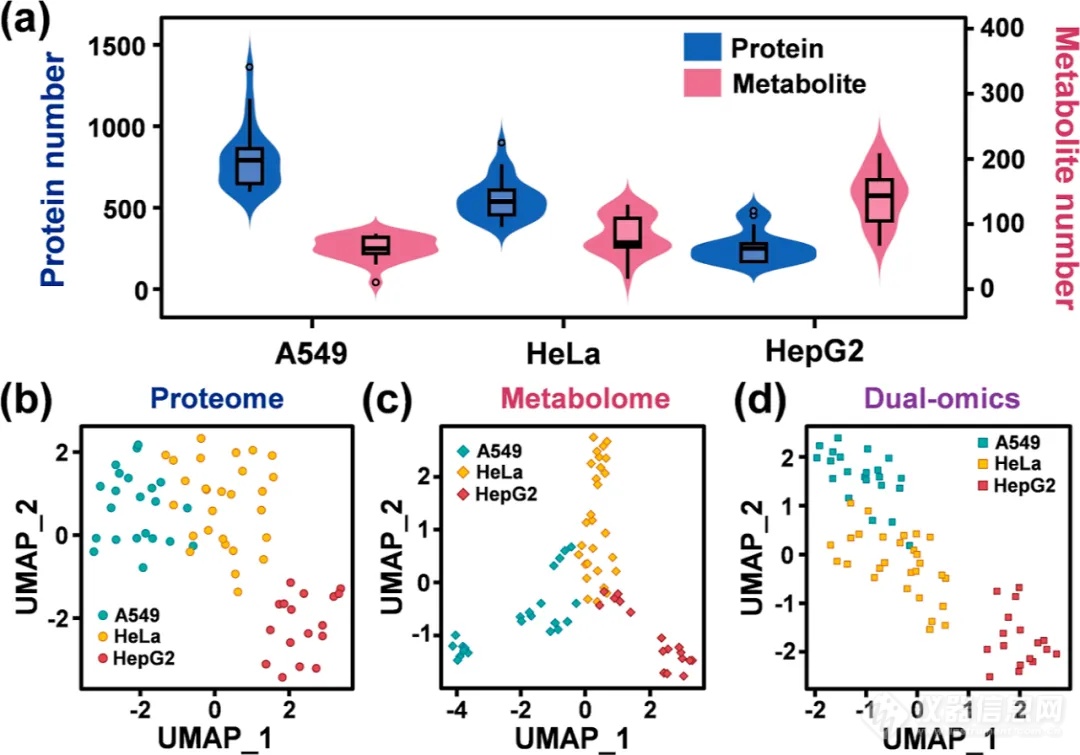
图3 scPMA策略分析单个肿瘤细胞(包括A549、HeLa和HepG2细胞)
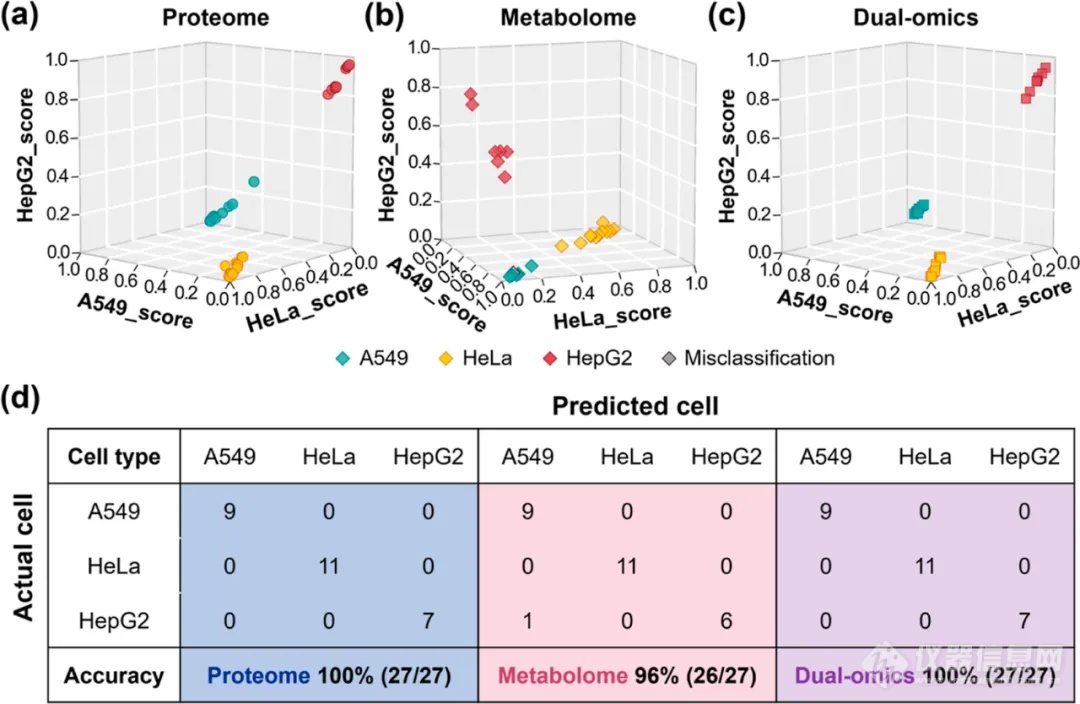
图4 基于单细胞的蛋白质组、代谢组和双重组学信息对细胞进行分类
随后,作者还利用scPMA方法在单细胞水平上研究了多柔比星对肿瘤细胞的诱导作用(图5)。对比药物处理组的各个单细胞样本发现给药后不同的单细胞在蛋白质表达上存在着异质性,这也是在群体分析中无法观察到的现象。与未给药的细胞相比,给药组共鉴定出255个差异蛋白(图5b、c),一些肺癌细胞中过表达的蛋白显著降低。大部分的差异蛋白涉及的通路与DNA、染色质、核小体的合成有关(图5g)。同样,给药组和未给药组中鉴定出的代谢物也被用于UMAP聚类(图5d)和差异分析。差异分析结果(图5e、f)显示,93种代谢物有差异表达。其中,多柔比星仅在给药组检测到。值得注意的是,在给药组的各个细胞中,多柔比星丰度有明显的离散分布,甚至有10倍的丰度差异。这一结果表明不同的细胞个体具有不同的药物吸收水平,从而表现出明显的细胞异质性,这可能为进一步深入探索提供启发。基于差异蛋白质组和代谢组信息,利用MetaboAnalyst 5.0进行联合通路分析,分别富集出62条和234条相关通路。其中有37条显著相关的通路涉及的差异蛋白和代谢物与核糖体、DNA复制等药物作用机制有关(图5i)。
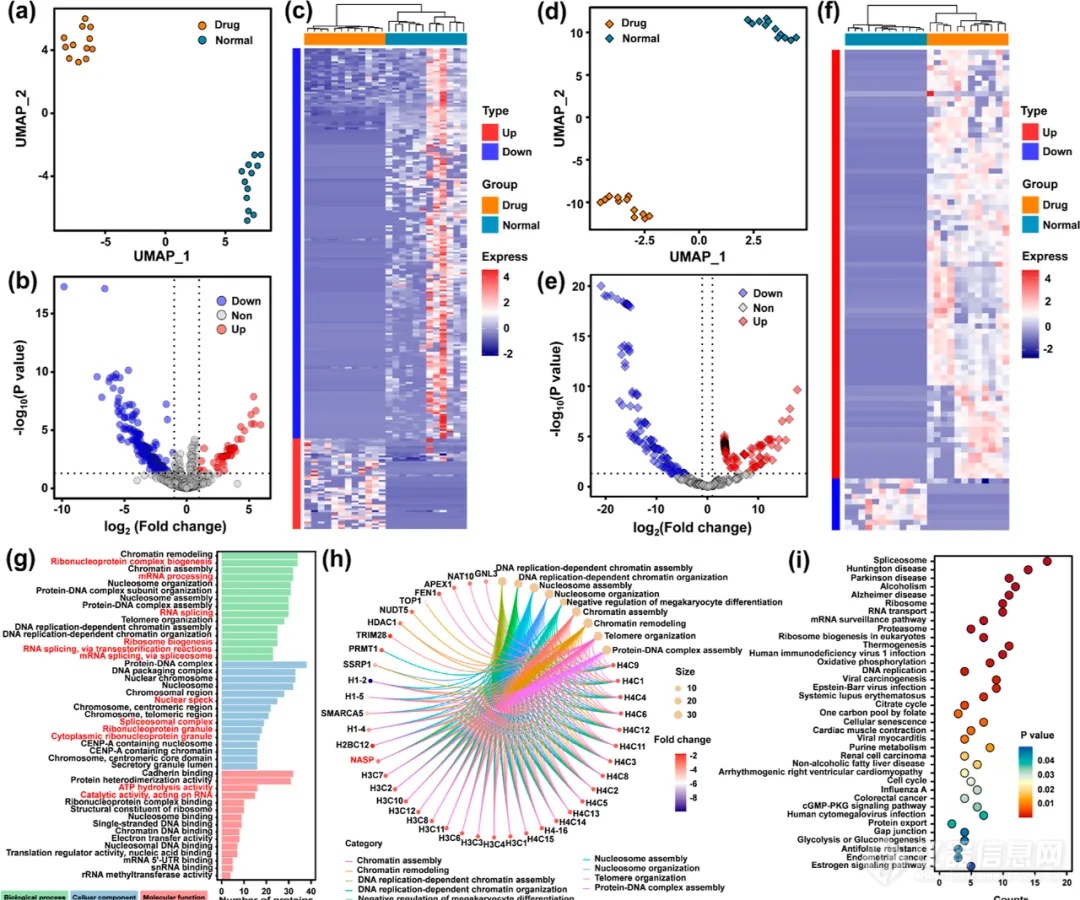
图7.氘代差异分析流程示意图
这些结果展示了scPMA策略在单细胞分析中的潜力,尤其是在药物干预研究中的应用前景。同时,这项工作也证明了一次性获取单细胞蛋白质组和代谢组信息的可行性,为未来在细胞分化、衰老和肿瘤免疫等领域的研究提供了新的工具。
本文2024年发表在Analytical Chemistry上,One-Shot Single-Cell Proteome and Metabolome Analysis Strategy for the Same Single Cell。该文章的通讯作者是来自浙江大学化学系微分析系统研究所的方群教授。
来源于:仪器信息网
热门评论
最新资讯
新闻专题

















