推荐厂家
暂无
暂无




眼看着寨卡病毒肆虐30多个国家,感染了辣么多人,还可能导致感染孕妇产下小头症婴儿,本宝宝真是一阵火大http://simg.instrument.com.cn/bbs/images/default/em09504.gif。身为仪器信息网的小编,本宝宝决定做点什么,于是乎“聚焦寨卡病毒 实现快速检测”的专题出世了(点开链接http://www.instrument.com.cn/zt/zika)。分割线————哎http://simg.instrument.com.cn/bbs/images/brow/em63.gif,本宝能力有限、没有找到相关资料,怎样检测寨卡病毒、试剂盒到底啥样滴,怎么更快的检测出是否感染?希望有大神能提供一些帮助(越多越好哦),也欢迎各位多提宝贵意见和建议,让大家更好的了解这一该死的病毒。先送上膝盖,请笑纳http://simg.instrument.com.cn/bbs/images/brow/em20.gif。

【网络会议】:病毒检测方法在病毒灭活和去除验证中的应用和比较——默克密理博生物制药工艺基础课堂十三【讲座时间】:2015年08月18日 14:00【主讲人】:谭宁毕业于华东师范大学,生物学硕士,拥有9年生物技术行业从业经历,现担任默克密理博华东区生物工艺开发主管,负责华东区域单抗,重组蛋白和疫苗客户的工艺开发工作,对下游澄清,过滤,超滤,层析,除病毒工艺有着丰富的经验,熟悉生物工艺的放大和故障排除。【会议介绍】 近年来,随着单抗市场在国内的兴起,对病毒清除技术(灭活和去除)的验证也提出了更高的要求,从最初的低pH孵育到最近几年除病毒膜过滤技术在病毒清除方面的成熟的应用,包括层析技术也逐渐被大家重视,从而进一步提高下游工艺对于病毒的总的对数清除率。在验证实验中,不管是哪种病毒清除技术,都是通过人为挑战病毒,然后采用感染力或者其他适合的分析方法来估测样品中的病毒滴度,然后测量出该步骤的病毒对数清除率,因此选择一种合适的病毒检测分析方法对于病毒对数清除率的计算非常重要。在病毒清除验证中,病毒的检测分为三种情况:第一种情况根据病毒的感染性来定量病毒的滴度,有两种方法,第一种称为病毒空斑形成实验,。第二种方法称作TCID50半数细胞培养物感染量实验,这种检测方法是以细胞培养物中产生细胞病变效应(Cyto-pathic Effect,CPE)为基础的检测手段。第二种情况是定量PCR的方法,尽管空斑形成和TCID50这两种以细胞为基础的感染性分析被视为病毒清除研究中的估测病毒滴度的金标准,qPCR方法已经被迅速接受为病毒清除研究中估测病毒粒子的替代和补充方法。第三种情况是直接用电子显微镜来计数病毒数目,但是由于该方法不能区分感染性病毒颗粒与非感染性病毒颗粒,因此无法判断病毒的感染力,主要用于细胞发酵液的病毒初始量的计算中,因此着重介绍空斑形成实验,TCID50实验和qPCR三种检测方法。本次讲座将主要介绍在生物下游病毒清除技术中应用的病毒检测方法,以及不同病毒检测方法的区别以及适用范围。 -------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名,通过审核后即可参会。2、报名并参会用户有机会获得100元手机充值卡一张哦~3、报名截止时间:2015年08月18日 13:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/15905、报名及参会咨询:QQ群—379196738http://ng1.17img.cn/bbsfiles/images/2017/10/2015042911235201_01_2507958_3.jpg
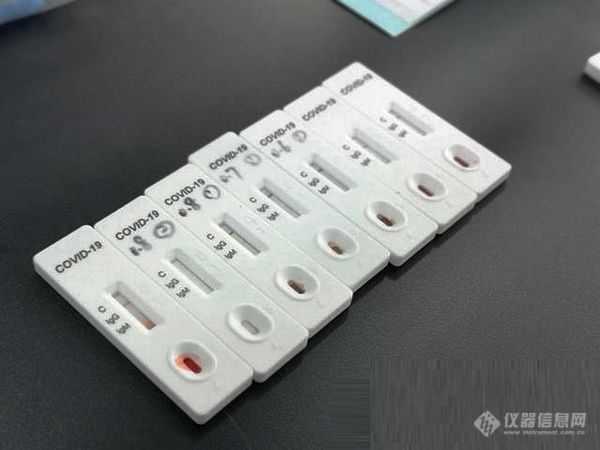
[font=arial][color=#cc0000][size=16px][b]新型冠状病毒抗体快速检测试纸条,通过肉眼观察试纸颜色即可快速读出检测结果。[/b][/size][/color][/font][font=arial][color=#cc0000][size=16px][b]“只需一滴血,10—15分钟就能让病毒无处遁形。”首先对患者的手指进行消毒,用配套的采血针扎一下,挤出绿豆大小的一滴血液,然后用配套的滴管把血液吸出来,滴加到试剂卡的样品孔里面,再滴加配套的样本稀释液,等待样本完成层析过程,10到15分钟便能肉眼看到结果。[/b][/size][/color][/font][size=16px][font=arial][color=#cc0000][b]试剂卡上标有三个标识:C、IgG、IgM。“C线叫做质控线。层析过程后,C处出现一道紫红色线则表示试纸条有效,反之无效。如果IgG和IgM处没出现红线说明样本的检测结果是阴性。如果在IgG或者IgM处出现一道紫红色的线,或者出现两条线,则代表这个患者感染了新冠肺炎。”[/b][/color][/font][/size][font=arial][size=16px][color=#333333][img=,600,450]https://ng1.17img.cn/bbsfiles/images/2020/03/202003121832307064_1386_1841897_3.jpg!w600x450.jpg[/img][/color][/size][/font]

 400-622-8982
400-622-8982
 留言咨询
留言咨询

 400-622-8982
400-622-8982
 留言咨询
留言咨询

 400-622-8982
400-622-8982
 留言咨询
留言咨询