推荐厂家
暂无
暂无






希望大家能多发一些单分子荧光检测方面的资料,这方面国内做的太少了!
分子荧光和液相的荧光检测器有何异同之处???我没有用过分子荧光,用过液相+荧光检测器测定过维生素,不知道二者有何异同?俺是菜鸟,能放在一起比较吗?
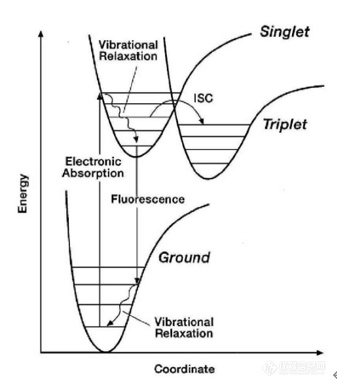
[align=center][b][font=宋体]浅谈单分子荧光检测技术的原理及其在生命科学中的应用[/font][/b][/align][align=center][font=宋体]吴晶[/font][sup][font='Times New Roman',serif]1[/font][/sup][font=宋体],刘皎[/font][sup][font='Times New Roman',serif]1,*[/font][/sup][/align][align=center][font='Times New Roman',serif]1. [/font][font=宋体]北京大学医药卫生分析中心,北京,[/font][font='Times New Roman',serif]100191[/font][/align][align=center][font='Times New Roman',serif]* [/font][font=宋体]通讯作者[/font][/align][b][font=宋体]摘要[/font][/b][font=宋体]由于单分子检测([/font][font='Times New Roman',serif]SingleMolecule Detection, SMD[/font][font=宋体])特有的[/font][font=宋体]高灵敏度、高空间分辨率、高时间分辨率、高信号质量等特点[/font][font=宋体],使其[/font][font=宋体]有望发现其他常规实验中难以发现的实验现象,因此[/font][font=宋体]成为了生物学、医学及药学等生命科学领域重要的科研工具。本文结合作者所在的北京大学医药卫生分析中心生物成像平台的工作经验,概述了单分子荧光检测技术的原理以及在生命科学中的应用,以期为相关科研技术人员提供参考。[/font][b][font=宋体]关键词[/font][/b][font=宋体]单分子荧光检测,荧光互相关光谱,荧光寿命成像,应用[/font][b][font='Times New Roman',serif]Abstract[/font][/b][font='Times New Roman',serif]Single Molecule Detection (SMD)has become an important scientific research tool in the fields of biology,medicine and pharmacy due to its unique sensitivity, resolution and signalquality. Based on the author's work experience in the biological imaging lab ofPeking University Medical and Health Analysis Center, this paper summarizes theprinciple and applications of SMD in the life sciences, in order to providereference for related scientific researchers and technicians.[/font][b][font='Times New Roman',serif]KeyWords [/font][/b][font='Times New Roman',serif]SMD, FCS, FLIM, Application[/font][b][font='Times New Roman',serif]1 [/font][font=宋体]引言[/font][/b][font=宋体]单分子检测([/font][font='Times New Roman',serif]Single Molecule Detection, SMD[/font][font=宋体])技术是一种能够在单分子水平上检测分子的技术,它具[/font][font=宋体]有高灵敏度、高空间分辨率、高时间分辨率、高信号质量等特点[/font][font=宋体]。[/font][font=宋体]它不但实现了某种意义上可称之为最高灵敏度的分子检测,而且有可能实时监测反应途径和追踪大分子在执行生理功能时的结构变化,因此有望发现其他常规实验中难以发现的实验现象。[/font][font=宋体]在单分子检测技术发展之前,大多数的分子实验是探测分子的综合平均效应([/font][font='Times New Roman',serif]Ensemble Averages[/font][font=宋体]),即探测大量由一种(或多种)对象组成的一个整体所表现出的平均响应和平均值[/font][font='Times New Roman',serif][1][/font][font=宋体]。这一平均效应掩盖了许多特殊的信息,尤其是生物学里很多小概率事件的发生。相比之下,单分子检测可以逐个地对体系中的单个分子进行研究,通过时间相关的方法,得到某一分子特性的分布状况。[/font][font=宋体]这对于了解机体细胞的物理、化学性质及其参与细胞正常功能的机制是十分必要的。它快速、卓越的进展无疑将影响许多科学领域,为医学、生物学、化学、物理[/font][font=宋体]学和纳米材料等领域提供新的检测手段,目前已成为当今科学研究的热点之一。[/font][font=宋体]在过去的几十年里,科研人员开发和设计了各种技术和实验来检测单个分子。例如上个世纪五十年代使用透射电镜拍摄了[/font][font='Times New Roman',serif]DNA[/font][font=宋体]和蛋白质等单分子的第一张图像;六十年代,有学者开展了间接检测水溶性生物分子的荧光研究,获得了含有高浓度底物的低浓度酶的液滴中存在的分子数量;七十年代,膜片钳被用于研究单分子,此后被广泛应用于离子通道蛋白的研究;八十年代,利用可扩散的多重荧光标记技术检测了单脂质分子;九十年代,应用宽场单荧光成像技术对单荧光团分子进行检测和成像,并且利用单分子荧光定位技术获得了大约[/font][font='Times New Roman',serif]30nm[/font][font=宋体]的分辨率;进入二十一世纪,研究人员开始在单分子水平上只使用一种荧光染料标签,对活细胞进行直接成像,并通过荧光显微镜进行观察[/font][font='Times New Roman',serif][2][/font][font=宋体]。[/font] [font=宋体]单分子荧光检测技术是实现单分子检测的手段之一,它利用单个荧光分子的荧光发射特性,对其进行精细控制和观测。[/font][font=宋体]本文拟通过对单分子荧光检测技术,包括荧光相关光谱[/font][font='Times New Roman',serif]/[/font][font=宋体]荧光互相关光谱([/font][font='Times New Roman',serif]Fluorescence Correlation Spectroscopy/ Fluorescence Cross-CorrelationSpectroscopy, FCS/FCCS[/font][font=宋体])及荧光寿命成像([/font][font='Times New Roman',serif]Fluorescence Lifetime Imaging Microscopy, FLIM[/font][font=宋体])技术的特征、原理及这些技术在生命科学领域的应用等方面进行阐述,以其为相关科研技术人员提供参考。[/font][b][font='Times New Roman',serif]2 [/font][font=宋体]单分子荧光检测技术概述[/font][/b][font='Times New Roman',serif]2.1[/font][font=宋体]荧光发射原理[/font][font='Times New Roman',serif][3][/font][font=宋体]荧光作为一种发射光,它的产生涉及对光子的吸收和再发射两个过程。简单的说,荧光产生有四个步骤(图[/font][font='Times New Roman',serif]1[/font][font=宋体]):[/font][align=center][img=,337,387]https://ng1.17img.cn/bbsfiles/images/2023/10/202310241358038590_3596_3237657_3.png!w337x387.jpg[/img][/align][align=center][font=宋体]图[/font]1 [font=宋体]荧光发射循环示意图[/font][/align][font='Times New Roman',serif](1)[/font][font=宋体]电子吸收入射光子后由基态向激发态跃迁,其跃迁速率在一定范围内与激光功率成正比;[/font][font='Times New Roman',serif](2)[/font][font=宋体]电子跃迁到不同电子能级或同一电子能级的不同振动能级上,经内转换和振动弛豫降落到最低激发单重态的最低振动能级上,这一过程需[/font][font='Times New Roman',serif]1x10[sup]-11[/sup]~1x10[sup]-13[/sup]s[/font][font=宋体];[/font][font='Times New Roman',serif](3)[/font][font=宋体]电子由激发态经发射光量子跃迁到基态的不同振动能级上,这一过程称为荧光发射;[/font][font='Times New Roman',serif](4)[/font][font=宋体]电子基态的内弛豫。[/font][font=宋体]物质发射荧光的能力用荧光量子产率来衡量。[/font][font='Times New Roman',serif]2.2 [/font][font=宋体]单分子荧光检测的基本要求[/font][font=宋体]对单分子荧光的检测必须满足两个基本要求[/font][font='Times New Roman',serif][1][/font][font=宋体]:[/font][font='Times New Roman',serif](1)[/font][font=宋体]在被照射的体积中只有一个分子与激光发生相互作用。这一点可以很方便地通过调整研究体系的浓度(密度)来达到;[/font][font='Times New Roman',serif](2)[/font][font=宋体]确保单分子的信号大于背景干扰信号([/font][font='Times New Roman',serif]background signal[/font][font=宋体]),其中关键的问题是要有效减少拉曼散射、瑞利散射及其杂质荧光所造成的干扰。[/font][font=宋体]因此,要获得理想的信噪比,需要将激发体积最小化。因显微镜物镜的焦点最小体积约[/font][font='Times New Roman',serif]1μm[sup]3[/sup][/font][font=宋体],故激光扫描共聚焦显微镜([/font][font='Times New Roman',serif]laser scanning confocalmicroscopy, LSCM)[/font][font=宋体]是探测单分子荧光的主要方法之一。[/font][b][font='Times New Roman',serif]3 [/font][font=宋体]单分子荧光检测技术在生命科学中的应用[/font][/b][font='Times New Roman',serif]3.1 [/font][font=宋体]荧光相关光谱[/font][font='Times New Roman',serif]/[/font][font=宋体]荧光互相关光谱([/font][font='Times New Roman',serif]FCS/FCCS[/font][font=宋体])技术[/font][font='Times New Roman',serif][4-7][/font][font='Times New Roman',serif]FCS[/font][font=宋体]和[/font][font='Times New Roman',serif]FCCS[/font][font=宋体]都是在涨落光谱技术的基础上衍生而来的,通过检测某一微小区域内荧光信号的瞬时涨落变化,分析分子的密度、扩散以及分子之间的相互作用,是一种新兴的单分子检测技术。由于[/font][font='Times New Roman',serif]FCS/FCCS[/font][font=宋体]的高灵敏性可以用来检测生物系统中发生的小概率时间,因此此技术主要用于分子之间相互作用、活细胞分析、核酸分析、蛋白质的寡聚化、蛋白质的动力学研究以及纳米制剂粒径测量等研究,在检测物质浓度、扩散速度、分子结合速率等方面体现出巨大的优越性,亦可用于肿瘤的早期诊断以及高通量药物筛选等。[/font][font='Times New Roman',serif]FCS[/font][font=宋体]技术,即在[/font][font='Times New Roman',serif]CLSM[/font][font=宋体]焦点的微小测量区域内,通过对荧光强度随时间变化的自发性波动分析和其时间函数自相关的分析,并通过计算机统计与拟合运算,在活细胞内单分子水平给出分子的扩散系数、分子数目、分子浓度及分子之间结合与分离状态等动力学参数的检测方法。其实质是监测带有荧光基团的物质在激光作用体积内的扩散情况,可揭示异质群体中的每个个体,并对各自的亚群进行鉴定、分类、定量比较,亦可对复杂的生化反应提供详细、确定的动力学参数。例如,张强课题组就通过[/font][font='Times New Roman',serif]FCS[/font][font=宋体]技术测定了负电蛋白与不同电荷的纳米颗粒结合情况不同,导致扩散系数呈显著性差异,从而判断出纳米颗粒与血浆中蛋白结合情况[/font][font='Times New Roman',serif][8][/font][font=宋体]。而薛采宁等人也使用[/font][font='Times New Roman',serif]FCS[/font][font=宋体]技术实现了无标记小分子药物筛选[/font][font='Times New Roman',serif][9][/font][font=宋体]:[/font][font='Times New Roman',serif]FCS[/font][font=宋体]可以根据荧光标记的蛋白分子的特征扩散时间的变化来区分蛋白质的聚集程度,定量评价蛋白质与药物的相互作用,如荧光标记蛋白聚集体的特征扩散时间越短,蛋白质与药物之间的相互作用越强。[/font][font=宋体]发明[/font][font='Times New Roman',serif]FCS[/font][font=宋体]的最初目的是在生物系统中研究非常稀的样本浓度的化学动力学特征。随着探测手段、自相关电子学等方面的技术进步,[/font][font='Times New Roman',serif]FCS[/font][font=宋体]在生物化学中的研究和应用越来越广泛,如经典的细胞膜中脂质扩散研究就是通过[/font][font='Times New Roman',serif]CLSM[/font][font=宋体]整合了[/font][font='Times New Roman',serif]FCS[/font][font=宋体]技术后所取得的巨大进展。[/font][font='Times New Roman',serif]FCCS[/font][font=宋体]技术,确切来说是[/font][font='Times New Roman',serif]FCS[/font][font=宋体]技术的一种延伸应用。其既保持了[/font][font='Times New Roman',serif]FCS[/font][font=宋体]技术的灵敏性,又可以解决[/font][font='Times New Roman',serif]FCS[/font][font=宋体]对两种粒子的扩散速度要有明显不同的要求(至少相差[/font][font='Times New Roman',serif]2[/font][font=宋体]倍,即二者质量差相差[/font][font='Times New Roman',serif]8[/font][font=宋体]倍)。该技术在实验中通常将两种粒子用不同的荧光进行标记,荧光分子被激发后,产生两种互不干扰的荧光信号,分别被两个独立的检测器探测,然后将探测到的信息进行交叉函数分析。如果分子间存在相互作用,那么两种不同的荧光信号将同时经过检测通道,这时两个检测器就会产生同步的信号波动,从而产生互相关信号;而当单色荧光分子独立在微区域内运动时,则不会产生互相关信号。这样,相互作用的荧光分子和独立运动的荧光分子就被区分开来。由于[/font][font='Times New Roman',serif]FCCS[/font][font=宋体]技术直接反映分子间的相互作用,而不像[/font][font='Times New Roman',serif]FRET[/font][font=宋体]技术那样受分子扩散或聚集的影响,因此在生物分子互作、蛋白寡聚化、酶活性研究领域中有重要的应用前景。[/font][font='Times New Roman',serif]3.2 [/font][font=宋体]荧光寿命成像([/font][font='Times New Roman',serif]FLIM[/font][font=宋体])技术[/font][font='Times New Roman',serif]FLIM[/font][font=宋体]技术是研究细胞内生命活动状态的一种非常可靠的方法。荧光寿命是指分子受到光脉冲激发后返回基态之前在激发态的平均停留时间,是荧光团的固有性质(表[/font][font='Times New Roman',serif]1[/font][font=宋体]),取决于荧光分子所处的微环境,因此其不受探针浓度、激发光强度和光漂白效应等因素影响,且能区分荧光光谱非常接近的不同荧光团,故具有非常好的特异性和很高的灵敏度。此外,由于荧光分子的荧光寿命能十分灵敏地反映激发态分子与周围微环境的相互作用及能量转移,因此[/font][font='Times New Roman',serif]FLIM[/font][font=宋体]技术可提供细胞自身荧光寿命信息,亦可被用来实现对微环境中许多生化参数的定量测量,如细胞中折射率、黏度、温度、[/font][font='Times New Roman',serif]pH[/font][font=宋体]值的分布和动力学变化、局部氧气浓度测量、活细胞内钙浓度测量等,这在生物医学研究中具有非常重要的意义。目前[/font][font='Times New Roman',serif]FLIM[/font][font=宋体]技术在细胞生物学中一些重要科学问题的研究、临床医学上一些重大疾病的诊断与治疗研究以及纳米材料的生物医学应用研究等方面均有广泛应用,并取得了许多利用传统的研究手段无法获取的数据。如[/font][font='Times New Roman',serif]Melissa C Skala[/font][font=宋体]等人[/font][font='Times New Roman',serif][10][/font][font=宋体]及李慧等人[/font][font='Times New Roman',serif][11][/font][font=宋体]均报道了通过[/font][font='Times New Roman',serif]FLIM[/font][font=宋体]手段无标记测量肿瘤细胞或组织内[/font][font='Times New Roman',serif]NADH, FAD[/font][font=宋体]和其他内源性光学生物标志物的荧光特性,来实现对正常细胞或组织与肿瘤细胞或组织之间代谢途径差异的检测。[/font][align=center][font=宋体]表[/font][font='Times New Roman',serif]1 [/font][font=宋体]荧光寿命特性[/font][/align] [table][tr][td] [align=center][font=宋体][color=black]取决于[/color][/font][/align] [/td][td] [align=center][font=宋体][color=black]不依赖于[/color][/font][/align] [/td][/tr][tr][td] [font=宋体][color=black]染料浓度[/color][/font] [/td][td] [font=宋体][color=black]染料固有特性(如异构化、质子化、蛋白质折叠等)[/color][/font] [/td][/tr][tr][td] [font=宋体][color=black]光漂白[/color][/font] [/td][td] [font=宋体][color=black]微环境(如[/color][/font][font='Times New Roman',serif][color=black]pH[/color][/font][font=宋体][color=black]、离子浓度、环境氧浓度、温度等)[/color][/font] [/td][/tr][tr][td] [font=宋体][color=black]样品厚度[/color][/font] [/td][td] [font=宋体][color=black]分子结合[/color][/font] [/td][/tr][tr][td] [font=宋体][color=black]激发光强度[/color][/font] [/td][td] [font='Times New Roman',serif][color=black] [/color][/font] [/td][/tr][tr][td] [font=宋体][color=black]光源噪声[/color][/font] [/td][td] [font='Times New Roman',serif][color=black] [/color][/font] [/td][/tr][/table][font='Times New Roman',serif]3.3 [/font][font=宋体]荧光寿命成像[/font][font='Times New Roman',serif]-[/font][font=宋体]荧光共振能量转移[/font][font='Times New Roman',serif](Fluorescence Lifetime Imaging Microscopy- Fluorescence Resonance EnergyTransfer, FLIM-FRET[/font][font=宋体])[/font][font='Times New Roman',serif][12][/font][font=宋体]荧光共振能量转移[/font][font='Times New Roman',serif](Fluorescence Resonance Energy Transfer, FRET) [13][/font][font=宋体]是指两个荧光基团间能量通过偶极[/font][font='Times New Roman',serif]-[/font][font=宋体]偶极耦合作用以非辐射方式从供体传递给受体的现象。目前[/font][font='Times New Roman',serif]FRET[/font][font=宋体]技术可广泛用于单个固定细胞、亚细胞或活细胞原位生理环境下检测生物大分子的构象变化和分子间的直接相互作用,如检测配体[/font][font='Times New Roman',serif]-[/font][font=宋体]受体、蛋白分子共定位、转录机制、蛋白折叠以及蛋白质二聚化等,亦可用于检测酶活性变化、细胞凋亡以及膜蛋白的研究等[/font][font='Times New Roman',serif][12][/font][font=宋体]。[/font][font=宋体]在[/font][font='Times New Roman',serif]FRET[/font][font=宋体]体系中,常用的荧光能量供体、受体对主要有:[/font][font='Times New Roman',serif]CFP/YFP[/font][font=宋体]、[/font][font='Times New Roman',serif]BFP/RFP[/font][font=宋体]、[/font][font='Times New Roman',serif]CY3/CY5[/font][font=宋体]等。进行[/font][font='Times New Roman',serif]FRET[/font][font=宋体]实验时,需要满足以下几个条件:[/font][font='Times New Roman',serif]① [/font][font=宋体]所检测样品包含两个荧光分子,能量的提供者叫做供体,能量的接受者叫做受体;[/font][font='Times New Roman',serif]② [/font][font=宋体]供体与受体的距离在[/font][font='Times New Roman',serif]10nm[/font][font=宋体]之间;[/font][font='Times New Roman',serif]③ [/font][font=宋体]供体的发射波长与受体的激发波长一致。当供体的激发波长照射样品时,若没有[/font][font='Times New Roman',serif]FRET[/font][font=宋体]效应产生,只会检测到供体的发射光;反之,如果有[/font][font='Times New Roman',serif]FRET[/font][font=宋体]效应发生,则[/font][font='Times New Roman',serif]CLSM[/font][font=宋体]可检出供体发射的荧光减弱,而受体的发射光增强。[/font][font='Times New Roman',serif]FRET[/font][font=宋体]本身不是一种成像技术,而是一个物理过程。传统的[/font][font='Times New Roman',serif]FRET[/font][font=宋体]过程分析通常是基于荧光强度成像来实现,分析的结果容易受光谱串扰的影响。而将[/font][font='Times New Roman',serif]FLIM[/font][font=宋体]技术应用于[/font][font='Times New Roman',serif]FRET[/font][font=宋体]过程分析,利用了[/font][font='Times New Roman',serif]FLIM[/font][font=宋体]技术可定量测量这一优势,可非常灵敏地反映供体荧光分子与受体荧光分子之间的能量转移过程,目前被认为是测量[/font][font='Times New Roman',serif]FRET[/font][font=宋体]效果的金标准。[/font][font=宋体]当受体分子与供体之间的距离[/font][font='Times New Roman',serif]10nm[/font][font=宋体]时,供体的能量转移到受体,受体从基态发生能量跃迁,从而影响供体的荧光寿命。与没有受体分子的时候相比,发生[/font][font='Times New Roman',serif]FRET[/font][font=宋体]的供体分子的荧光寿命降低。因此,[/font][font='Times New Roman',serif]FLIM-FRET[/font][font=宋体]联合能够实时监测生物细胞中蛋白质的动态变化,如蛋白质折叠、分子间(蛋白[/font][font='Times New Roman',serif]-[/font][font=宋体]蛋白,蛋白[/font][font='Times New Roman',serif]-[/font][font=宋体]核酸)相互作用和细胞间信号分子传递、分子运输以及病理学研究等。[/font][b][font='Times New Roman',serif]4 [/font][font=宋体]结论和展望[/font][/b][font=宋体]近年来,研究人员应用了多种技术来检测单分子,如从传统的技术到最近发展的生物传感技术。而荧光检测越来越受欢迎,并且在等离子体共振、全内反射荧光、多光子激发荧光显微镜和近年来发展起来的生物传感技术等改进形式中仍然受到关注。随着近场扫描显微镜、光激活定位显微镜、受激发射损耗显微术或超分辨率荧光显微镜等先进显微技术的发展,单分子的超分辨率成像亦成为可能。此外,随着纳米生物技术的发展,几种先进的纳米技术也对单分子检测在更大程度上发挥着指导作用。[/font][font=宋体]总之单分子检测特有的[/font][font=宋体]高灵敏度、高空间分辨率、高时间分辨率、高信号质量等特点[/font][font=宋体],[/font][font=宋体]经过近几十年的发展,在[/font][font=宋体]生物学、医学及药学等生命科学领域已经成为不可或缺的科研工具。[/font][font='Times New Roman',serif] [/font][b][font=宋体]参考文献[/font][/b][font='Times New Roman',serif]1. [/font][font=宋体]周拥军[/font][font='Times New Roman',serif], [/font][font=宋体]陈德强[/font][font='Times New Roman',serif], [/font][font=宋体]夏安东[/font][font='Times New Roman',serif], [/font][font=宋体]黄文浩[/font][font='Times New Roman',serif]. [/font][font=宋体]单分子的荧光特性及其在生物学上的应用[/font][font='Times New Roman',serif]. [/font][font=宋体]物理[/font][font='Times New Roman',serif], 2000, 29(11): 657-661[/font][font='Times New Roman',serif]2. [/font][font='Times New Roman',serif]NidhiChauhan, Kirti Saxena, Utkarsh Jain. Single molecule detection from microscopyto sensors. 2022. doi: https://doi.org/10.1016/j.ijbiomac.2022.04.038[/font][font='Times New Roman',serif]3. [/font][font=宋体]盖宏伟[/font][font='Times New Roman',serif]. [/font][font=宋体]单分子荧光成像检测及其应用研究[/font][font='Times New Roman',serif][D]. [/font][font=宋体]大连[/font][font='Times New Roman',serif]: [/font][font=宋体]中国科学院大连化学物理研究所[/font][font='Times New Roman',serif], 2005, 2-3[/font][font='Times New Roman',serif]4. [/font][font=宋体]曲绍峰[/font][font='Times New Roman',serif], [/font][font=宋体]林金星[/font][font='Times New Roman',serif], [/font][font=宋体]李晓娟[/font][font='Times New Roman',serif]. FCS/FCCS[/font][font=宋体]技术及其在植物细胞生物学中的应用[/font][font='Times New Roman',serif]. [/font][font=宋体]电子显微学报[/font][font='Times New Roman',serif], 2014, 33(5): 461-468[/font][font='Times New Roman',serif]5. [/font][font=宋体]张普敦[/font][font='Times New Roman',serif], [/font][font=宋体]任吉存[/font][font='Times New Roman',serif]. [/font][font=宋体]荧光相关光谱及其在单分子检测中的应用进展[/font][font='Times New Roman',serif]. [/font][font=宋体]分析化学[/font][font='Times New Roman',serif], 2005, 33(6): 875-880[/font][font='Times New Roman',serif]6. [/font][font=宋体]黄茹[/font][font='Times New Roman',serif], [/font][font=宋体]周小明[/font][font='Times New Roman',serif]. [/font][font=宋体]荧光相关光谱在生物化学领域中的应用[/font][font='Times New Roman',serif]. [/font][font=宋体]激光生物学报[/font][font='Times New Roman',serif], 2013, 22(4): 289-293[/font][font='Times New Roman',serif]7. [/font][font=宋体]游俊[/font][font='Times New Roman',serif]. [/font][font=宋体]荧光相关光谱([/font][font='Times New Roman',serif]FCS[/font][font=宋体])在生物活细胞中的应用[/font][font='Times New Roman',serif]. [/font][font=宋体]湖北大学学报[/font][font='Times New Roman',serif]([/font][font=宋体]自然科学版[/font][font='Times New Roman',serif]), 2005, 27(1): 53-56[/font][font='Times New Roman',serif]8. [/font][font='Times New Roman',serif]ZibinZhang, Junji Ren, Wenbing Dai, etc. Fast and Dynamic Mapping of the ProteinCorona on Nanoparticles Surfaces by Photocatalytic Proximity Labeling. Advancedmaterials, 2023, 35: 2206636[/font][font='Times New Roman',serif]9. [/font][font='Times New Roman',serif]CainingXue, Wenxin Yu, Haohan Song, etc. A study of protein-drug interaction based onsolvent-induced protein aggregation by fluorescence correlation spectroscopy.Analyst, 2022, 147: 1357[/font][font='Times New Roman',serif]10. [/font][font='Times New Roman',serif]MelissaC Skala, Kristin M Riching, Annette Gendron-Fitzpatrick, etc. In vivomultiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes,and cellular morphology in precancerous epithelia. PNAS, 2007, 104(49): 19494-9[/font][font='Times New Roman',serif]11. [/font][font='Times New Roman',serif]Hui Li,Jia Yu, Rongli Zhang, etc. Two-photon excitation fluorescence lifetime imagingmicroscopy: A promising diagnostic tool for digestive tract tumors. Journal ofInnovative Optical Health Sciences, 2019, 12(5):1930009 1-16[/font][font='Times New Roman',serif]12. [/font][font=宋体]罗淋淋[/font][font='Times New Roman',serif], [/font][font=宋体]牛敬敬[/font][font='Times New Roman',serif], [/font][font=宋体]莫蓓莘[/font][font='Times New Roman',serif],[/font][font=宋体]等[/font][font='Times New Roman',serif]. [/font][font=宋体]荧光共振能量转移[/font][font='Times New Roman',serif]-[/font][font=宋体]荧光寿命显微成像([/font][font='Times New Roman',serif]FRET-FLIM[/font][font=宋体])技术在生命科学研究中的应用进展[/font][font='Times New Roman',serif]. [/font][font=宋体]光谱学与光谱分析[/font][font='Times New Roman',serif], 2021, 41(4): 1023-1031[/font][font='Times New Roman',serif]13. [/font][font=宋体]肖忠新[/font][font='Times New Roman',serif], [/font][font=宋体]张进禄[/font][font='Times New Roman',serif]. [/font][font=宋体]荧光共振能量转移技术在激光共聚焦显微镜中的应用[/font][font='Times New Roman',serif]. [/font][font=宋体]中国医学装备[/font][font='Times New Roman',serif], 2014,8(11): 73-75[/font]

 400-860-5168转6107
400-860-5168转6107
 留言咨询
留言咨询

 400-860-5168转0980
400-860-5168转0980
 留言咨询
留言咨询

 400-860-5168转0185
400-860-5168转0185
 留言咨询
留言咨询