推荐厂家
暂无
暂无



 400-612-9980
400-612-9980
 留言咨询
留言咨询

 400-831-3689
400-831-3689
 留言咨询
留言咨询

 400-860-5168转4275
400-860-5168转4275
 留言咨询
留言咨询


[b][size=15px][color=#595959]自身[/color][/size][size=15px][color=#595959]免疫[/color][/size][size=15px][color=#595959]性肝炎(AIH)[/color][/size][/b][size=15px][color=#595959]是一种以淋巴细胞浸润和自身抗体产生为特征的界疾病,然而其病因尚不清楚。有研究发现,在AIH患者的外周血中维持免疫稳态的必需因子调节性T (mTreg)细胞的频率降低,表明Treg细胞数量不足和Treg细胞功能异常可能在AIH的发病过程中起重要作用。AIH的治疗通常采用高剂量的类固醇以抑制免疫系统。有研究表发现,复合益生菌可调节[b]肠道菌群[/b]和肠道通透性,降低辅助性T细胞1型(Th1)和Th17细胞水平,提高Treg细胞水平,抑制[b]TLR4/核因子-κB (NF-κB)通路[/b]的激活,调节AIH的发生。因此,对于AIH患者,Treg细胞与肠道微生物群的相互作用可能提供一种可行的治疗策略。[/color][/size][size=15px][color=#595959]中药常用[b]片仔癀(PTH)[/b]含有牛黄、麝香、三七、蛇胆等成分,常用于治疗肝脏疾病,包括AIH。研究发现,PTH通过控制NF-κB信号通路和NLRP3炎性小体,减少血液中IL-1、IL-6和IL-17的产生,减轻胶原性[/color][/size][b][size=15px][color=#595959]关节炎[/color][/size][/b][size=15px][color=#595959]小鼠的关节炎症。然而,PTH治疗AIH的确切机制尚不完全清楚。[/color][/size][align=center] [/align] [size=15px][color=#595959]通过测定AIH小鼠肠道菌群结构和[b]记忆调节性T (mTreg)细胞[/b]功能水平的变化,探讨PTH在AIH小鼠模型中的作用机制。[/color][/size] [align=center] [/align] [size=15px][color=#595959]给予PTH预防10 d后,用刀豆球蛋白A(Con A)诱导AIH小鼠模型。流式细胞术检测小鼠mTreg细胞水平,16S rRNA分析小鼠肠道菌群,western blotting检测[b]toll样受体(TLR)2、TLR4/核因子-κB (NF-κB)和CXCL16/CXCR6信号通路[/b]的激活情况。[/color][/size] [align=center] [/align] [size=15px][color=#595959][/color][/size][size=15px][color=#595959]PTH减轻AIH小鼠肝脏病理损伤,降低辅助性T - 17细胞数量和干扰素-γ、[/color][/size][b][size=15px][color=#595959]肿瘤[/color][/size][size=15px][color=#595959]坏死[/color][/size][size=15px][color=#595959]因子[/color][/size][/b][size=15px][color=#595959]- α、白细胞介素(IL)-1β、IL-2、IL-6、IL-21的表达。同时,[b]PTH刺激有益菌的丰度[/b],促进TLR2信号的激活,从而增加Treg/mTreg细胞数量产生IL-10,抑制TLR4/NF-κB和CXCL16/CXCR6信号通路的激活。[/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size] [align=center] [/align] [b][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959]PTH调节肠道菌群平衡,恢复mTreg细胞,减轻实验性AIH,与TLR/CXCL16/CXCR6/NF-κB信号通路密切相关[/color][/size][/b][size=15px][color=#595959]。这些发现提示PTH可能通过平衡肠道菌群,干扰mTreg细胞调节Treg细胞分化,是AIH的一种天然替代疗法。[/color][/size]
β-乳球蛋白属于乳白蛋白还是属于乳球蛋白里面的一种成分?最近看到有两种版本,其一,说是属于乳白蛋白里面的一种成分,乳白蛋白包括α-乳白蛋白、β-乳球蛋白和血清白蛋白。乳球蛋白即免疫球蛋白。其二,乳白蛋白包括α-乳白蛋白和血清白蛋白,乳球蛋白包括β-乳球蛋白和免疫球蛋白。现在不知道哪种说法对,请各位指教!!!谢谢!!!
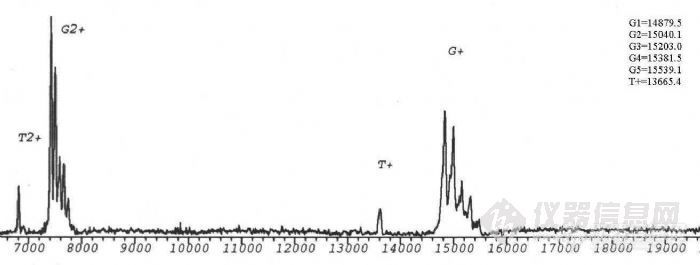
生物质谱在糖蛋白结构分析中的应用项目完成人:桑志红 蔡 耘项目完成单位:国家生物医学分析中心 随着人们对糖蛋白参与生命活动机理的日益深入了解,对天然糖蛋白及重组糖蛋白类药物的分析越来越受到重视。重组糖蛋白类药物的质量控制更是直接关系到药物的疗效及至人类的健康。九十年代以来,随着带有反射功能的基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF-MS)和纳升电喷雾串联质谱(nano-ESI-Q-TOF)等具有软电离方式的现代质谱 技术的发展,质谱以其高灵敏度和强有力的分析混合物的能力,提供了生物大分子的分子量、序列、一级结构信息以及结构转换、修饰等方面的信息,使糖基化分析有了重要的进展。 通常研究糖蛋白的方法是把蛋白链上的寡糖切下来,分别研究蛋白部分和寡糖部分的结构,因此无法研究与两部分共同相关的结构问题,也不能区分不同糖基化位点上切下来的寡糖。自90年代初,国外有人开始用质谱法研究糖蛋白的结构,同时描述了各个位点的不均一性。我们用建立的现代生物质谱技术研究糖蛋白一级结构的方法,将其应用与基因重组糖蛋白的结构分析。为糖蛋白结构分析及基因重组糖蛋白类药物的质量控制提供新的手段。一、 生物质谱研究糖蛋白结构方法的建立实验所用仪器为:1.德国BRUKER 公司的REFLEXIII型基质辅助激光解吸附电离飞行时间质谱仪,N2激光器,波长337nm,线性飞行距离150cm,加速电压2kv。2.英国Micromass 公司Q-TOF型电喷雾串联质谱仪。源温80°C,气体流速40L/h,枪头电压650V,检测频率2.4S,氩气碰撞池压力6*10-5mbar。1. 基质的选择,在MALDI-TOF-MS分析中,基质起着相当重要的作用。不同的基质对不同类的物质响应不同,a-氰基-4-羟基肉桂酸用于测定糖蛋白核糖核酸酶B效果相对较好。2. 糖蛋白分子量的测定,糖蛋白核糖核酸酶B由124个氨基酸组成,在34位Asn处连有一个高甘露糖型N-糖链。由于糖链的微不均一性,与普通蛋白质及核酸不同,其分子离子峰在MALDI-TOF-MS 质谱图上表现为一簇峰,各峰之间约相差一个糖基。正是由于这种微不均一性,使得其分子离子峰变宽,灵敏度降低。糖链分子量越大,峰越宽,灵敏度越低,所以一般只有糖链较短,蛋白的质量不太大的糖蛋白才能测定其平均分子量。用MALDI-TOF可直接测定糖蛋白核糖核酸酶B的平均分子量为 15208.6Da。http://ng1.17img.cn/bbsfiles/images/2011/03/201103211511_284179_1604317_3.jpg3. 糖含量的测定,采用O聚糖酶及内糖苷键酶F分别作用于核糖核酸酶 B,只有内糖苷键酶F能够是其分子量发生变化,表明核糖核酸酶B分子中不存在O-连接糖链存在着N-连接糖链。内糖苷键酶F切断N-糖链五糖核心最内侧的GlcNAc-GlcNAc糖苷键,得到含一个GlcNAc的肽链,减去GlcNAc,可以计算出准确的肽链分子量T=13695.6,与糖蛋白平均分子量之差为糖链的平均分子量G=1513.4,平均糖含量为:(糖链大小/糖蛋白分子量)×100%=9.95%。4. 糖基化位点的确定,研究糖基化类型及糖基化位点的策略:采用蛋白酶酶解与糖苷内切酶酶解相结合的方法,通过酶切前后含糖肽片的位移,结合网上数据库检索,可以确定糖基化类型和糖基化位点。以不同类型的糖苷内切酶作用于糖蛋白(N-糖苷键酶或O-糖苷键酶),在MALDITOF-MS 上观察其质量的变化,可以直接确定糖蛋白中是否含有响应类型的糖链,这是我们确定糖蛋白中糖苷键类型的基础。我们采用先将核糖核酸酶B还原烷基化,加Glu-C酶切,产物再用内糖苷肩酶F酶切,可观察到含糖肽段出现位移,将核糖核酸酶B的肽质量指纹图进行数据库检索,证实发生位移的肽段中含有N-糖链特异连接位点,由此确定34位Asn为糖基化位点。另外我们采用内糖苷键酶F及肽-N-聚糖酶F两种酶进行差位酶切法对含糖肽段进行验证,两种酶酶切后分子离子峰的差值除以GlcNAc的质量,结果就是N-糖基化位点的个数5. 质谱测定氨基酸序列, 我们对核糖核酸酶B肽质量指纹谱中的含糖肽段进行了串联质谱测定,首先在一级质谱图中选择离子4972.23,在串联质谱的碰撞活化室以氩气与其碰撞产生碎片,从碎片的质荷比推算出此肽片中的一段氨基酸序列,检索结果为核糖核酸酶B,从而判断其理论序列是否一致。6. 糖链结构的研究,凝集素对糖肽的亲和提取,进一步分析糖肽序列及糖链结构的关键是含糖肽段的提取。核糖核酸酶B中糖链为高甘露糖型,我们选用对其有特异性吸附的伴刀豆球蛋白对其进行提取利用这种简捷的亲和质谱的方法,对糖肽段进行了分析。建立了亲和质谱分析糖肽类物质的方法,为今后糖肽序列分析及糖链结构分析奠定了基础。二、基因重组糖蛋白人促红细胞生成素(rhEPO)的结构分析。 利用以上建立的方法,我们对样品重组人促红细胞生成素进行了分析,断定此样品为非完全糖基化,样品中只存在N-连接的糖链,无O-糖链。应用酶切法用肽-N-聚糖酶处理后,得到两个含糖肽段,进行数据库检索,测得38位及83位为N-糖基化位点,与文献报道相符,结果可靠。因此,该项课