〓疯子哥〓
第7楼2007/12/21
气体摩尔体积·学法指导
1.能正确理解“22.4 L/mol”与“气体摩尔体积”的关系.即在标况下,气体摩尔体积约为22.4 L/mol.
2.为什么必须在相同的温度和压强的条件下比较气体体积?
答 因为气体的体积受温度和压强的影响较大.在相同的温度和压强的条件下,气体分子间的平均距离是几乎相等的,这样气体体积的大小主要决定于气体所含分子数.
3.阿伏加德罗定律的内容可简化为“三同定一同”,怎样记住是哪“三同”定“一同”呢?
答 “三同”指“同温、同压、同体积”;“一同”指“含相同的分子数”.这里温度、压强、体积都是容易测量的物理量,而分子数则不易测量.
4.“1 mol水蒸气在标况下的体积约为22.4 L”的说法为什么是错误的?
答 因为在标况下,水并不仅仅以气体的形式存在.这里所说的标况是指气体本身所处的状况,而不是指外界条件的状况.
5.怎样理解“1 mol任何气体的体积若为22.4 L,则它所处的状况不一定是标准状况”?
答 在标况下,气体的摩尔体积约为22.4 L/mol.当气体所处的状况一定(0℃,1.01×105Pa)则气体分子之间的距离就确定了,设为d,若升高温度,d增大;若增加压强,d减小.则在升温的同时加压,可保持d不变,即状态改变,体积不变.(根据理想气体状态方程可证明该结论)
6、气体摩尔体积
单位物质的量气体所占的体积叫做气体摩尔体积。气体摩尔体积的符号为Vm,它的常用单位是L/mol或者m3/mol。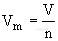
气体摩尔体积跟1mol液体或固体体积相比,有以下特点:
(1)1mol气体体积通常明显大于1mol液体或固体的体积。例如,在101kPa和100℃时,1molH2O(g)的体积约为3.06×104mL,1mol 4℃H2O(1)的体积仅为18mL。
(2)在相同状况下,1mol不同物质的液体或固体体积往往不同。例如,在20℃时1molAl的体积为10mL,1molH2O的体积为18mL,1molH2SO4的体积为53.6mL。这是由于液体或固体的体积取决于构成物质的粒子数目、粒子大小和粒子间距离这三个因素;在相同的一般状况下,1mol任何气体的体积基本相同。例如在0℃和101kPa(即标准状况)下,1mol任何气体的体积都约为22.4L。这是由于,在一定温度、压强下气体体积的大小只随分子数目的多少而发生变化。
(3)在标准状况下,气体摩尔体积约为22.4L/mol。在使用时应注意它的适用范围:特定的温度、压强——温度为0℃,压强为101kPa,不是这样条件下气体体积不能直接依据22.4L/mol进行计算;特定状态的物质——气体。而液体或固体体积不能依据22.4L/mol进行计算。
(4)由于气体都由分子构成,因此,在标准状况下,2.24L气体(即1mol气体)中都含有约6.02×1023个分子。在标准状况下,22.4L气体(即1mol气体)的质量以g作单位,在数值上应该等于它的式量。在理解这些知识的基础上,不难实现物质量(g)、物质的量(mol)和标准状况下气体体积(L)的换算。
(5)在同温同压下,气体体积大小只随分子数目的多少而变化。这一规律既适用于标准状况,又适用于非标准状况的其它相同状况。
在同温同压下,同体积的任何气体都含有相同数目的分子,这一规律称为阿伏加德罗定律。
根据阿伏加德罗定律,可以很方便地比较相同状况下气体中分子数目。例如,在20℃和101kPe条件下,容积为250mL的集气瓶里分别集满氧气和二氧化碳气体,根据阿伏加德定律可断定,其中O2和CO2的分子个数相同;若在同样状况下250mL和500mL的集气瓶里分别集满氢气和氮气,根据阿伏加德罗定律可断定,其中H2和N2的分子个数比为1∶2。
7、有关气体摩尔体积的计算
(1)换算关系和主要公式
物质的质量、物质的量、粒子数目和气体体积之间的关系:

将这些关系可具体化为4个计算公式:

应用这4个公式应该注意:当已知任某公式中的两个量时,即可求第三个量,因此,这些公式可以实现一系列的换算与计算。如果已知粒子的种类或物质的化学式,则可确定它们的摩尔质量,据①式可完成物质的量与物质的质量的换算;如果将NA的近似值6.02×1023/mol代入②式,可完成物质的量子粒子数的换算;如果将22.4L/mol代入③式,可完成物质的量和气体标准状况下体积的换算。22.4L/mol是特定气体摩尔体积,它不能用于液体或固体物质的量与体积的换算。④式为密度公式,它广泛适用于气体、液体和固体的质量与体积间的换算。但是,气体的密度较小,常以g/L为单位,液体和固体密度较大,常以g/cm3或kg/dm3为单位,计算时应该恰当地使用单位。
(2)比较粒子数的方法
常用的比较物质中基本单元(粒子)数的方法是:
①比较物质的量来确定基本单元的多少。物质的量相同时,所含基本单元(粒子)数相同;气体的基本单元是分子,因此,气体的物质的量相同时,所含分子数相同;物质的量不相同时,物质的量之比等于所含基本单元数之比;气体的物质的量之比,等于所含分子数之比。
②比较相同状况下气体的体积来确定分子数的多少。在相同状况下: